电针对睡眠剥夺大鼠脾脏TLR4信号通路以及miR146a的影响
2018-05-30胡天俊何扬子
胡天俊,何扬子
1.盘州市中医院,贵州 六盘水 553500;2.暨南大学附属第一医院,广东 广州 510000
由于经济社会的快速发展及生活、工作节奏的日益加快,迫使人们不断延长工作和学习时间,导致睡眠时间缩短,呈现出不同程度的睡眠剥夺(Sleep Deprivation,SD)现象。睡眠剥夺是指剥夺部分或整个睡眠过程后迫使受试对象出现持续觉醒的状态(通常以24 h中睡眠时间不超过4 h来衡量)。研究表明,睡眠剥夺可改变机体情绪、记忆、学习及免疫等多种功能;随着睡眠剥夺的持续存在,甚至可引起生理、心理及行为的变化,进而带来更大的危害[1~5]。本研究拟从机体TLR4免疫信号通路及miR146a的表达情况来探讨电针改善睡眠剥夺的机制。
1 材料与方法
1.1 动物与分组 32只SPF级雄性Wistar大鼠,体质量(200±20)g,6~8周龄,南方医科大学实验动物中心提供,生产许可证号:SCXK(粤)2011-0015,生产批号:NO.44002100004077,饲养于暨南大学动物实验管理中心SPF级动物房内。按照随机数字表法分为对照组、模型组、安定组和电针组,每组8只,正常隔离饲养7天后进行实验干预。实验条件为室内温度26℃,相对湿度50%,照明周期12 h/12 h,工作照度150~300 Lux,噪声与震动控制≤60 dB,实验时间为每天 8:00-17:00。
1.2 药物与试剂 安定(地西泮)注射液:天津金耀氨基酸有限公司,10 mg/2 mL,批号:1407101。戊巴比妥钠(Pentobathital Sodium):北京化学试剂公司,25 g/瓶,批号:69020100。对氯苯丙氨酸(Para-chlorophenylalanine,PCPA):日本TCI公司,250 g/瓶,批号:H110130000。
1.3 实验器材 YP601N型电子天平:上海精密科学仪器有限公司,编号380507070012,d=0.1 mg。KWD-808系列(Ⅰ型)脉冲针灸治疗仪:常州英迪电子医疗器械有限公司。0.22×25 mm无菌针灸针:苏州市华佗医疗用品有限公司,批号:150102。
1.4 模型制备与处理方法 对照组常规饲养,未作任何处理,自由进食、饮水,定期更换垫料;模型组、安定组和电针组在实验第1、2天按每只45 mg/100 g的剂量每天腹腔注射对氯苯丙氨酸(PCPA)混悬液制作大鼠睡眠剥夺模型。造模成功后,模型组不再做任何处理。安定组于实验第3天开始连续5天,每天腹腔注射安定注射液(给药剂量:根据人-鼠给药剂量体表面积折换率,按成人安定注射液催眠剂量折算出大鼠催眠剂量为0.92 mg/kg);电针组给予每天电针百会、神庭20 min,连续5天。取穴与电针操作方法:参照《常用实验动物针灸穴位图》,神庭穴位于大鼠头部额顶骨缝交界线前方,前正中线上;百会穴位于大鼠头部两耳连线中点,顶骨正中。电针操作:取1寸无菌针灸针(型号0.22×25 mm)斜刺或平刺神庭、百会穴,进针3~5 mm后连接电针仪,选用连续波型(电压6 V,频率10 Hz)并留针20 min。实验第8天,各组大鼠在戊巴比妥钠麻醉下采集脾脏作为实验样本。
1.5 指标检测 运用RT-PCR法,将10 mg大鼠脾脏组织置于组织捣碎机中破碎、匀浆提取总RNA,用反转录试剂盒配制反转录反应体系(总RNA质量约1 μg),得到反转录产物cDNA。TLR4、NF-κβ、IRAK1、TRAF6的mRNA检测采用SYBR Green I荧光法(引物序列见表1),反应总体系为15 μL;miR146a的mRNA检测采用TaqMan探针法,反应总体系为15 μL,此两法反应条件均为95℃预变性5 min;95℃变性10 s,60℃退火延伸34 s(40个循环)。反应结束后,将获得的目的基因mRNA循环阈值(Cycle threshold,CT),采用ΔΔCT(ΔΔCT=ΔCT-ΔCT基础值;ΔCT=CT目的基因-CT内参)方法分析,根据2-△△CT公式计算出相对表达量。

表1RT-PCR的引物序列
1.6 统计学方法 使用ABI7500 software(Version 2.0.5)和Data Assist3.01软件对数据进行处理,用公式2-△△CT计算基因相对表达量RQ值,将所得结果运用SPSS13.0软件进行分析,计量资料以(±s)表示,进行方差齐性检验,采用单因素方差分析(One-Way-ANOVA)表现组间差异。
2 结果
2.1 各组大鼠脾脏TLR4信号通路关键基因的表达水平比较见表2。与对照组比较,模型组大鼠脾脏TLR4、NF-κβ、IRAK1、TRAF6的mRNA表达量明显升高(P<0.01)。与模型组比较,安定组和电针组大鼠脾脏TLR4、NF-κβ、IRAK1、TRAF6的mRNA表达量显著降低(P<0.05),但并未观察到安定组与电针组间有统计学差异(P>0.05)。
2.2 各组大鼠脾脏miR146a的表达水平比较 见表3。与对照组比较,模型组大鼠脾脏miR146a的表达量升高(P<0.05)。与模型组比较,安定组大鼠脾脏miR146a的表达量显著降低,而电针组大鼠脾脏miR146a的表达量却明显升高,差异均有统计学意义(P<0.05);但并未观察到安定组与电针组间有统计学差异(P>0.05)。
表2 各组大鼠脾脏TLR4信号通路关键基因的表达水平比较(±s)
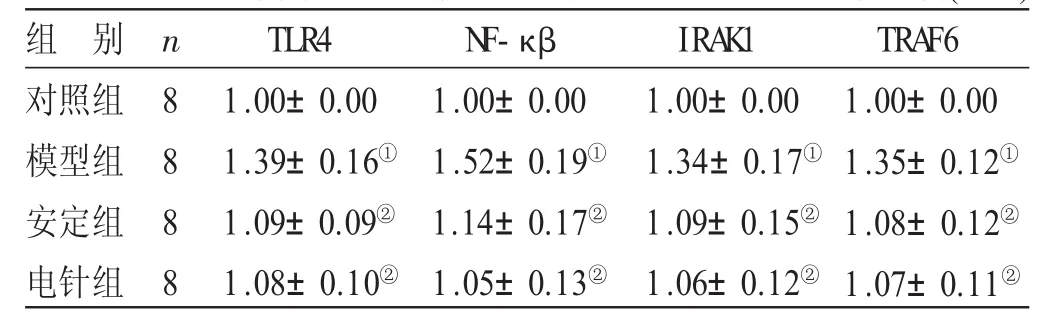
表2 各组大鼠脾脏TLR4信号通路关键基因的表达水平比较(±s)
与对照组比较,①P<0.01;与模型组比较,②P<0.05
组 别对照组模型组安定组电针组n 8 8 8 8 TLR4 1.00±0.00 1.39±0.16①1.09±0.09②1.08±0.10②N F-κβ 1.00±0.00 1.52±0.19①1.14±0.17②1.05±0.13②IRA K 1 1.00±0.00 1.34±0.17①1.09±0.15②1.06±0.12②TRA F6 1.00±0.00 1.35±0.12①1.08±0.12②1.07±0.11②
表3 各组大鼠脾脏miR146a的表达水平比较(±s)

表3 各组大鼠脾脏miR146a的表达水平比较(±s)
与对照组比较,①P<0.05;与模型组比较,②P<0.05
组 别对照组模型组安定组电针组n 8 8 8 8 miR146a 1.00±0.00 1.20±0.80①1.03±0.44②2.23±0.11②
3 讨论
现代医学认为,睡眠剥夺可引起神经-内分泌-免疫调节网络的失衡,进而影响或破坏正常睡眠过程[6]。有研究表明,睡眠剥夺大鼠体内免疫应激水平激活,促使白细胞介素-1(IL-1)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)等炎性细胞因子增多,一定程度上起到调节睡眠-觉醒中枢的作用,进而达到改善睡眠及机体免疫水平的目的[7]。
TLR4是TLRs家族中具有代表性的一员,参与了炎性免疫反应等多种疾病的发生。TLR4信号通路中依赖型骨髓样分化因子88(Myeloiddifferen-tiationfactor88,MyD88)可通过激活核转录因子-κβ(Nuclear transcription factor κβ,NF-κβ)启动炎性反应中相关细胞因子基因的转录,产生和分泌IL-1、IL-6及TNF-α等下游炎性因子,参与机体免疫、睡眠结构和睡眠觉醒行为的调节[8]。
miR146是一种多功能基因,不仅具有免疫调节功能,而且还参与造血及肿瘤等多种生理病理过程的发生与发展[9]。研究发现,miR146a可以通过结合TLR4信号通路中关键蛋白IRAK1和TRAF6的3’UTR区进而抑制整个信号通路的翻译过程,导致下游的信号分子不能激活或激活不足,对TLR4信号通路具有负性调控作用[10]。
本实验表明,经睡眠剥夺后大鼠体内TLR4信号通路激活,随之TLR4、NF-κβ、IRAK1、TRAF6关键基因表达增多,而经过电针治疗后睡眠剥夺大鼠体内miR146a的表达升高,负性调节TLR4信号通路,使TLR4、NF-κβ、IRAK1、TRAF6基因表达下降,并减少下游炎症细胞因子IL-1、IL-6和TNF-α的分泌与释放,最终达到对固有免疫应答的调控作用。此外,本实验还推测安定注射液对睡眠的调节改善作用不是通过升高miR146a的表达来调控TLR4信号通路实现的。
综上所述,miR146a对TLR4信号通路的负性调控作用复杂而微妙。通过促进miR146a的表达来调控炎症反应重要通路之一的TLR4信号通路,对于抑制过度炎症反应具有重大而深远的意义,但miR146a和TLR4信号通路之间的关系并非如此简单,它们之间已形成一个复杂的调节网络系统,这一系统对于防止机体过度炎症反应和相关疾病的发生与发展,维持机体正常生理功能起着十分重要的作用,但同时也增加了人类认识TLR4信号通路和miR146a相关疾病的难度。
[1]Otmani S, Pebayle T, Roge J, et al.Effects of driving duration and partial sleep deprivation on subsequent alertness and performance of car drivers[J].Physiol Behav,2005,84(5):715-724.
[2]Rogers NL,Szuba MP,Staab JP,et al.Neuroimmunologic aspects of sleep and sleep loss[J].Semin Clin Neuropsy chiatry,2001,6(4):295-307.
[3]李宁,汪嬿,刘锡禹,等.睡眠剥夺对认知功能影响的研究进展[J].生物医学工程学杂志,2008,25:1197-2000.
[4]王秀云,李积胜,刘公望,等.睡眠剥夺对亚健康的影响及相关机制[J].天津中医药杂志,2006,23(2):108-111.
[5]刘宁,皇甫恩,王小英,等.54 h睡眠剥夺对4名健康志愿者情绪的影响[J].中国心理卫生杂志,1998,12(4):196-199.
[6]谌剑飞.睡眠障碍的现代病因病机探索[J].中国中西医结合杂志,2012,32(2):151-152.
[7]胡天俊,虞洁,王秀莲,等.电针对睡眠剥夺大鼠行为学和脾脏IL-1β,IL-6和TNF-α的影响[J].天津中医药杂志,2016,33(1):35-38.
[8]李洋,谢杨丽,胡志安.感染和免疫反应对睡眠的影响[J].生理科学进展,2007,38(2):187-190.
[9]Yates LA,Norbury CJ,Gilbert RJ.The long and short of microRNA[J].Cell,2013,153(3):516-519.
[10]PerryMM,Moschos SA,Williams AE,et al.Rapid changes in microRNA-146a expression negatively regulate the IL-1β-induced inflammatory response in human lung alveolar epithelial cells[J].Immunol,2008,180:5689-5698.
