利胆退黄汤对ANIT诱导的胆汁淤积型黄疸模型大鼠的治疗作用
2018-05-30张广玉张玉峰汪伟王宇亮孙晓娜牛学恩党中勤
张广玉,张玉峰,汪伟,王宇亮,孙晓娜,牛学恩,党中勤
河南省中医院,河南 郑州 450002
肝内胆汁淤积属中医黄疸范畴,是一种部分或全部胆汁流出阻滞的综合症[1~2]。临床主要表现为黄疸,以目睛黄染为重要特征,早期表现为血清丙氨酸转氨酶(Alanine aminotransferase,ALT)和谷氨酰转肽酶(Glutamyl transpeptidase,GGT)水平升高,进而出现高胆红素血症,皮肤瘙痒,常伴有轻微的消化道症状,严重者可导致肝衰竭甚至死亡[3]。其发病机制较为复杂,一般认为包括感染、代谢、免疫以及遗传等,但目前为止尚未完全清楚。研究显示,肝内胆汁淤积主要是致病因子导致的毛细胆管和肝细胞器损伤,阻碍胆汁的排泌,使毛细胆管内胆栓形成[4]。
利胆退黄汤摘录于《古今名方》,由茵陈、败酱草、板蓝根、玉米须各30 g、栀子10 g、郁金12 g、金钱草60 g组成,主要用于清热利湿,利胆疏肝,为传统中药方剂。现代研究显示,茵陈能增加胆汁中胆红素等的排泄;栀子具有保肝作用,既可以加速血液中胆红素的代谢,又可以提高葡萄糖脱氢酶的活力;败酱草、金钱草、板蓝根等对胆汁分泌与排泄具有一定的促进作用,诸药并用,共奏利胆退黄之功[5~6]。临床观察与实验研究结果显示,利胆退黄汤可以调节毛细胆管的功能状态,明显改善肝细胞对胆红素的摄取与转运,促进胆汁的排泄[7~8]。
钠离子-牛磺胆酸协同转运多肽(Sodium taurocholate cotransporting polypeptide,NTCP)主要介导结合胆汁酸的摄取,胆汁酸盐输出泵(BSEP)主要使胆汁酸经肝细胞胆小管排入毛细胆管[9]。研究证明,高胆汁盐浓度可降低NTCP的表达,发生肝内胆汁淤积时,胆汁盐浓度升高可导致NTCP表达的下调,而上调BSEP蛋白水平的表达,可促进胆汁酸的代谢,避免肝脏受损。因此,当肝细胞相关转运蛋白发生改变时,会导致肝细胞摄取功能或转运功能的失常,进而引起胆汁淤积,而胆汁酸对肝细胞膜、线粒体等产生损伤[10],引起肝细胞损伤及肝功能异常。因此,本研究以ANIT制备肝内胆汁淤积大鼠模型,通过分析大鼠血清指标、肝脏组织中NTCP、BSEP蛋白表达,探讨利胆退黄汤对胆汁淤积型黄疸大鼠的疗效及其作用机制。
1 材料
1.1 实验动物 SPF级Wistar雄性大鼠48只,体质量(210±10)g,购自北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2014-0009,饲养于河南省中医院动物实验中心,室温保持21~25℃,试验期间自由饮水、进食。
1.2 实验药品 利胆退黄汤由茵陈、败酱草、板蓝根、玉米须各30 g、栀子10 g、郁金12 g、金钱草60 g组成,由河南省中医院制剂中心提供,提取物浓缩至含生药0.84 g/mL,备用。茵栀黄颗粒(鲁南厚普制药有限公司生产,批号:国药准字Z20030028)。
1.3 实验试剂 a-萘异硫氰酸盐(ANIT)(美国Sigma公司),大鼠血清丙氨酸转氨酶(ALT)、碱性磷酸酶(ALP)、天门冬氨酸氨基转移酶(AST)、γ-谷氨酰转肽酶(γ-GT)、直接胆红素(DBil)、总胆红素(TBil)和总胆汁酸(TBA)试剂盒(购于南京建成生物研究所),总RNA提取试剂盒、逆转录及PCR试剂盒(购自中国北京鼎国生物技术有限公司),NTCP、BSEP、p-actin—抗、二抗试剂盒(购自英国Abeam公司)。
1.4 实验仪器 CX7型全自动生化检测仪(美国Beakman),Blofuge28RS型高速冷冻离心机(德国贺利氏集团公司),RM2235型全自动轮转石蜡切片机(德国徕卡公司),LEITDM型倒置荧光显微镜(德国徕卡),FLUOR plus型多功能酶标仪(瑞典Tecan公司),stepone Plus型荧光定量PCR仪(美国ABI公司,olympus BX-51型病理图像采集系统(日本奥林巴斯公司),AEL-160电子分析天平(日本岛津公司)。
2 方法
2.1 动物分组 大鼠适应性喂养3天,随机分成6组:对照组,模型组,阳性药组,利胆退黄汤低、中、高剂量组,每组8只。
2.2 模型制备 ANIT溶于植物油中,浓度为2.0%。禁食12 h后,除对照组外,其余5组均一次性灌胃ANIT溶液(5 mL/kg)造模[11],诱发大鼠急性肝内胆汁淤积病变。造模48 h后,根据前期预实验结果,利胆退黄汤低、中、高剂量组给药量分别是10、20、40 g/(kg·d),阳性药组给予茵栀黄颗粒1.6 g/kg灌胃,同时对照组和模型组每天给予生理盐水灌胃,连续给药7天。给药7天后,禁食12 h,腹腔注射10%水合氯醛麻醉,采集胆汁、血液及肝脏组织。
2.3 大鼠血清学指标ALT、ALP、γ-GT、TBil、DBil、TBA检测 将采集血液置于离心管内,静置冰盒中6 h,低温条件下以4 000 r/min离心15 min,取血清。采用自动生化分析仪检测各组大鼠血清 ALT、ALP、AST、γ-GT、DBil、TBil及TBA。
2.4 大鼠肝脏组织中NTCP、BSEP蛋白表达及mRNA表达检测 采用荧光定量检测法检测大鼠肝脏组织中NTCP、BSEP蛋白表达及mRNA表达:将冷冻肝脏组织置于预冷的研钵中,充分研磨成粉末状,按Trizol试剂盒操作方法提取肝组织总RNA。按照试剂盒说明书,用提取的总RNA进行cDNA第一链合成,再用聚合酶链式反应进行cDNA扩增,反应总体积为50 μL。反应条件:94℃预变性 2 min,(94℃变性 30 s,55℃退火30 s,72℃延伸30 s,72℃再延伸2 min),完成30个扩增循环,获得基因片段,分析各自表达结果。NTCP上游引物5'-CGTGCTTGTGGAAGAACCAG-3',下游引物5'-CGGAATCA GCAAGGCACTCG-3',片段长度190 bp;BSEP上游引物5'-TGAGCTAGTGTACGAAGCAC-3',下游引物5'-CGAACTCAGG CAAGCACCGC-3',片段长度132 bp。
2.5 大鼠肝脏组织病理切片 取肝脏组织约1 cm3小块,用4%多聚甲醛固定,洗去固定液,梯度酒精进行脱水,用二甲苯透明,再置于溶化的石蜡包埋,用石蜡切片机将组织切成厚度为5 mm的薄片。取薄片先用二甲苯脱蜡,再用苏木精溶液进行染色,透明后加盖玻片封固,置于显微镜下观察组织病理变化。
2.6 统计学方法 采用SPSS14.0软件进行统计学处理,多组比较采用LSD法进行分析,计量资料以(±s)表示。
3 结果
表1 各组大鼠血清生化指标检测结果比较±s)
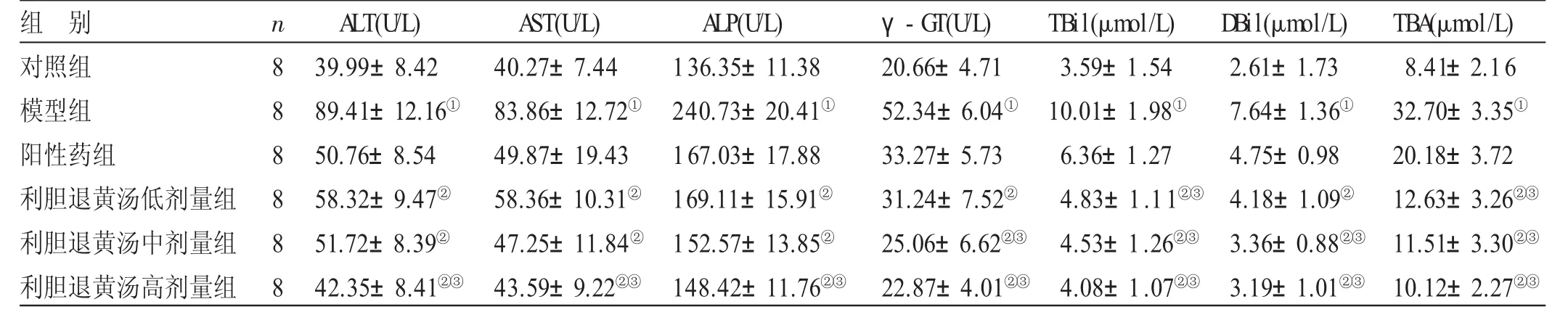
表1 各组大鼠血清生化指标检测结果比较±s)
与对照组比较,①P<0.05;与模型组比较,②P<0.05;与阳性药组比较,③P<0.05
组 别对照组模型组阳性药组利胆退黄汤低剂量组利胆退黄汤中剂量组利胆退黄汤高剂量组n 8 8 8 8 8 8 A LT(U/L)39.99±8.42 89.41±12.16①50.76±8.54 58.32±9.47②51.72±8.39②42.35±8.41②③A ST(U/L)40.27±7.44 83.86±12.72①49.87±19.43 58.36±10.31②47.25±11.84②43.59±9.22②③A LP(U/L)136.35±11.38 240.73±20.41①167.03±17.88 169.11±15.91②152.57±13.85②148.42±11.76②③γ-GT(U/L)20.66±4.71 52.34±6.04①33.27±5.73 31.24±7.52②25.06±6.62②③22.87±4.01②③TBil(μmol/L)3.59±1.54 10.01±1.98①6.36±1.27 4.83±1.11②③4.53±1.26②③4.08±1.07②③TBA(μmol/L)8.41±2.16 32.70±3.35①20.18±3.72 12.63±3.26②③11.51±3.30②③10.12±2.27②③D Bil(μmol/L)2.61±1.73 7.64±1.36①4.75±0.98 4.18±1.09②3.36±0.88②③3.19±1.01②③
3.1 各组大鼠血清生化指标检测结果比较 见表1。与对照组比较,模型组大鼠血清中ALT、AST、ALP、γ-GT、TBil、DBil、TBA水平均显著升高(P<0.05);与模型组比较,利胆退黄汤低、中、高剂量组血清ALT、AST、ALP、γ-GT、TBil、DBil、TBA显著降低(P<0.05);与阳性药组比较,利胆退黄汤高剂量组血清中ALT、AST、ALP、γ-GT、TBil、DBil、TBA水平显著降低(P<0.05)。
3.2 各组大鼠肝组织病理观察结果比较 见图1。对照组大鼠肝小叶结构完整,肝细胞索呈放射状排列,大小均匀,肝窦不扩张,内皮细胞完整,肝实质细胞无变性、坏死,核深染、核膜完整;模型组大鼠可见肝细胞肿大,排列无序不规整,显点状或灶性坏死,轮廓不清,胆管上皮细胞增生,肝窦变大,可见大量炎细胞浸润;与模型组比较,阳性药组大鼠肝组织炎细胞浸润减少,未见脂肪细胞,肝组织结构、形态恢复较好,肝细胞肿胀缓解,形态结构清晰可见,肝窦正常;利胆退黄汤低、中、高剂量组大鼠肝组织病理炎细胞浸润和脂肪细胞减少,肝细胞肿胀明显改善,肝细胞排列比较规整,细胞大小大致相等;与模型组比较,利胆退黄汤低剂量组大鼠肝组织中细胞清晰可见,肿胀减轻,炎细胞浸润减少,内皮细胞较正常;与利胆退黄汤低剂量组比较,利胆退黄汤中剂量组大鼠肝组织病理改善明显;与利胆退黄汤中剂量组比较,利胆退黄汤高剂量组大鼠肝组织病理改善较明显;与阳性药组比较,利胆退黄汤高剂量组大鼠肝组织病理改善较明显。
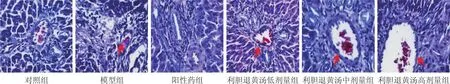
图1 各组大鼠肝组织病理切片(×400)
3.3 各组大鼠肝脏组织中NTCP、BSEP蛋白及mRNA表达见表2。与对照组比较,模型组大鼠肝脏组织中NTCP、BSEP蛋白表达及mRNA表达均明显降低,差异均有统计学意义(P<0.05);与模型组比较,利胆退黄汤低、中、高剂量组大鼠肝组织中NTCP、BSEP蛋白表达及mRNA表达均明显升高,差异均有统计学意义(P<0.05);与阳性药组比较,利胆退黄汤高剂量组大鼠肝组织中NTCP蛋白表达和NTCP mRNA表达明显升高,均有统计学意义(P<0.05),而BSEP蛋白表达和BSEP mRNA表达无明显差异(P>0.05);利胆退黄汤低、中、高剂量组两两相比可知,高剂量效果明显优于低剂量,NTCP、BSEP蛋白表达及mRNA表达具有一定的剂量依赖。
表2 各组大鼠肝脏中NTCP、BSEP蛋白及mRNA表达(±s)

表2 各组大鼠肝脏中NTCP、BSEP蛋白及mRNA表达(±s)
与对照组比较,①P<0.05;与模型组比较,②P<0.05;与阳性药组比较,③P<0.05
组 别对照组模型组阳性药组利胆退黄汤低剂量组利胆退黄汤中剂量组利胆退黄汤高剂量组n 8 8 8 8 8 8 NTCP蛋白3.268±0.133 1.792±0.107①6.118±0.117 4.031±0.142②③6.148±0.216②9.232±0.192②③NTCPmRNA 0.997±0.004 0.699±0.073①1.174±0.044 1.222±0.037②1.368±0.092②1.471±0.060②③BSEP蛋白2.673±0.062 1.049±0.055①2.916±0.026 2.451±0.049②2.539±0.051②2.617±0.046②BSEPmRNA 1.001±0.007 0.579±0.064①0.982±0.078 0.773±0.052②0.835±0.030②0.955±0.055②
4 讨论
肝内胆汁淤积是一种胆汁生成、分泌或排泄障碍产生的临床综合症,主要是由胆汁酸、胆红素等在肝脏、血液等组织内聚集,影响脂肪和脂溶性维生素的吸收造成。TBA是胆汁中一类胆烷酸的总称,可以促进脂类的消化与吸收,当肝内胆汁淤积时,胆汁酸的肠肝循环被破坏,就会导致高血清胆汁酸。
TBA对肝病具有较高的特异性,尤其是在黄疸消退等方面具有重要的参考价值。ALT主要分布在肝脏等组织中,肝内胆汁淤积时,肝细胞出现肿胀、坏死等损伤[11~14]。ALP是含锌蛋白,属于膜结合性酶,主要分布于肝脏中,当肝脏受到损伤时,ALP就会明显升高,一般ALP的升高主要与肝内胆汁淤积、骨病及肿瘤相关。本实验结果显示,造模后病理切片大鼠可见肝细胞肿大,排列无序不规整,显点状或灶性坏死,轮廓不清,胆管上皮细胞增生,肝窦变大,大量炎细胞浸润,说明本实验中胆淤积动物模型造模成功。给药7天后利胆退黄汤3组大鼠血清ALT、AST、ALP、γ-GT、TBil、DBil、TBA水平均呈现显著降低,说明利胆退黄汤治疗对血清胆红素和胆汁酸的恢复效果明显,能够很好的改善肝功能;HE染色显示大鼠肝组织病理炎细胞浸润和脂肪细胞减少,肝细胞肿胀明显改善,肝细胞排列比较规整,细胞大小大致相等,可以看出,利胆退黄汤能在不同程度上减轻炎症反应,对肝细胞和胆管上皮细胞具有一定的修复作用,对肝内胆汁淤积的治疗有效。与阳性药组比较,利胆退黄汤高剂量组血清中ALT、AST、ALP、γ-GT、TBil、DBil、TBA水平显著降低,表明利胆退黄汤在降低血清指标方面的疗效优于茵栀黄颗粒。
NTCP主要介导结合胆汁酸的摄取,只在肝脏中表达。研究表明,高胆汁盐浓度降低NTCP的表达,发生肝内胆汁淤积时,胆汁盐浓度升高可导致NTCP表达的下调[15~16]。BSEP是一种介导胆汁酸盐分泌的肝脏特异性转运体蛋白,是胆汁盐肝肠循环的主要驱动力[17~18]。本研究结果显示,模型组大鼠肝脏组织中NTCP、BSEP蛋白表达及mRNA表达均明显降低,提示ANIT可能通过抑制NTCP、BSEP的表达,阻碍胆汁酸代谢,进而诱发肝内胆汁淤积,造成肝组织细胞的损伤。利胆退黄汤低、中、高剂量组大鼠肝组织中NTCP、BSEP蛋白表达及mRNA表达均明显升高,提示利胆退黄汤可能是通过上调NTCP、BSEP的表达,提高肝细胞对胆汁酸的摄取、排泄,来保护肝细胞,以缓解肝内胆汁淤积病变。利胆退黄汤高剂量组NTCP蛋白表达和NTCP mRNA表达明显高于阳性药组,同时高剂量组BSEP蛋白表达和BSEP mRNA表达无差异性;利胆退黄汤低、中、高剂量组两两相比可知,高剂量效果明显优于低剂量,说明利胆退黄汤影响NTCP、BSEP蛋白及mRNA的表达具有一定的剂量依赖。
综上所述,利胆退黄汤可改善ANIT诱导的胆汁淤积黄疸大鼠的病理变化,可能是通过上调肝细胞中NTCP、BSEP的表达,来改善血清中ALT、AST、ALP、γ-GT、TBil、DBil、TBA的水平,以改善胆汁淤积黄疸模型大鼠的肝胆功能。
[1]董伟,梁爱华,李春英,等.龙胆泻肝丸对胆汁淤积大鼠肝脏多药耐药蛋白及中性粒细胞CD18表达影响的研究[J].中国实验方剂学杂志,2011,17(21):214-217.
[2]南京中医学院医经教研组.黄帝内经素问译释[M].上海:上海科学技术出版社,1963:224.
[3]黄志勇,余金甫,能桂先.赤芍对酸油致成人呼吸窘迫综合征治疗作用的观察[J].中国危重病急救医学,1995,7(5):257-260,317.
[4]韩平,田德安.肝内胆汁淤积发病机制及药物治疗新进展[J].胃肠病学和肝病学杂志,2016,25(5):584-588.
[5]余传隆,黄泰康,丁志遵,等.中药辞海[M].北京:中国医药科技出版社,1996.
[6]郑虎占,董泽宏,佘靖.中药现代研究与应用[M].北京:学苑出版社,1997.
[7]李杰.自拟利胆退黄汤治疗妊娠肝内胆汁淤积症临床疗效观察[J].中华中医药学刊,2015,33(11):2807-2811.
[8]呈海滨.基于FXR探讨利胆退黄法治疗肝内胆汁淤积的的机制及临床研究[D].广州:广州中医药大学,2014.
[8]Gerloff T, Stieger B,Hagenbuch B,et al.The sister of P-glycoprotein represents the canalicular bile salt export pump of mammalian liver[J]. J Biol Chem,1998,273(16):10046-10050.
[9]陆伦根,曾民德.胆汁酸对线粒体的毒性作用[J].肝脏,2008,13(4):343-346.
[10]Ohta Y,Kongo-Nishimura M,Hayashi T,et al.Saikokeishito extract exerts a therapeutic effect on alpha-Naphthylisothio-cyanate-induced liver injury in rats-through attenuation of enhanced neutrophil infiltration and oxidative stress in the liver tissue[J].J Clin Biochem Nutr,2007,40(1):31-41.
[11]黄延风,朱朝敏.大黄对幼鼠肝内胆汁淤积的治疗作用[J].第四军医大学学报,2006,27(13):1178-1181.
[12]荀蕾,卢秉久.疸清颗粒治疗肝胆湿热型急性肝内胆汁淤积症[J].中国实验方剂学杂志,2016,22(15):190-193.
[13]徐亚沙,吴芹,熊庭旺,等.清胰Ⅱ号对小鼠胆汁淤积性肝损伤的保护作用[J].中国实验方剂学杂志,2016,22(8):166-170.
[14]陈浩闵,剑斌,黄小桃,等.京尼平苷酸在胆汁淤积型大鼠体内的药动学分析[J].中国实验方剂学杂志,2015,21(17):75-78.
[15]孟强,刘克辛.转运体在肝脏中的作用[J].世界华人消化杂志,2011,19(9):881-886.
[16]朱平生,龙爱华,王兵.不同经典方剂对肝内胆汁淤积大鼠肝肾功能的影响[J].中国实验方剂学杂志,2011,17(5):200-201.
[17]刘涛,刘克辛.药物转运体的变化对肝脏疾病的影响[J].中华临床医师杂志,2011,10(5):2982-2984.
[18]柴智,周文静,高丽,等.雷公藤肝毒性及其作用机制的研究进展[J].中国实验方剂学杂志,2011,17(7):243-246.
