AM真菌多样性与植物多样性耦合关系及其对水盐梯度的响应
2018-05-30吕光辉魏雪峰龚雪伟
刘 薇, 吕光辉, 魏雪峰, 龚雪伟
(1.新疆大学资源与环境科学学院,乌鲁木齐 830046; 2.绿洲生态教育部重点实验室,新疆乌鲁木齐 830046;3.新疆大学干旱生态环境研究所,新疆乌鲁木齐 830046)
丛植菌根(arbuscular mycorrhiza,AM)真菌是一类种类丰富、分布广泛的土壤微生物[1],能与80%以上的陆生植物根系形成共生关系[2]。在这一共生关系中,AM真菌为其寄主提供矿质营养,同时也从寄主处获取碳源。借助于AM真菌,宿主植物可在恶劣环境中获得良好的生长效应[3-4]。近年来,国内外学者已对不同生态系统进行大量的AM真菌相关研究,Klironomos通过大量交叉验证试验发现,植物和AM真菌的种属身份都会影响到二者的共生关系[5];也有研究表明,AM真菌的组成和多样性对植株个体生长有很大影响[6-7]。AM真菌具有很高的物种多样性[8],随着AM真菌物种多样性增加,AM真菌对宿主植物的生长促进效应表现出多样性[9-10],即随着AM真菌物种多样性的增加,宿主植物的生长也相应增强。Moora等发现,AM真菌能够强化植物种内竞争,促进植物个体的大小不整齐性[11-12]。Zhang等发现,AM真菌能够影响植物的死亡率,进而影响种群自疏过程[13-14]。因此,AM真菌对植物个体生长的影响在大尺度上可能影响植物群落的构建和多样性特征,进而造成群落结构与功能的差异。
极端干旱、盐渍的生态系统中的AM真菌资源状况正在受到越来越多的关注[15]。目前,全球范围内共有约9.32亿hm2土地遭受盐化和碱化,这些地区植被多样性的恢复与当地的生态安全和经济发展密切相关[16-17]。已有研究表明,土壤盐分是引起干旱区植物群落多样性变化的关键因子之一[18-20],也是干旱区荒漠植物群落动态的决定因素之一[21],但关于土壤水盐协同影响下植物多样性与AM真菌多样性耦合关系的变化特征,尚未见报道。
本试验选取典型干旱荒漠区,研究AM真菌多样性与植物多样性的耦合关系对水盐梯度的响应,研究结果在一定程度上可为干旱荒漠生态系统的群落构建与生物多样性维持机制提供理论基础。
1 试验设计与研究方法
1.1 研究区及植被概况
艾比湖湿地国家级自然保护区位于新疆精河县西北(82°30′~82°50′E、44°37′~45°10′N),该区为典型大陆性干旱气候,干燥少雨多风,年平均气温5 ℃,年平均降水量为105.17 mm,蒸发量为1 315 mm。该区典型地带性土壤为灰漠土、灰棕漠土和风沙土隐域性土壤为盐(盐渍化)土、草甸土和沼泽土。多样化的土壤类型决定了旱生、超旱生、沙生、盐生、湿生和水生等植物群落的形成。艾比湖特殊的湿地-荒漠生态环境分布着数百种动植物,有其独特的生物资源多样性[22]。主要植物种类有胡杨(Populuseuphratica)、梭梭(Haloxylonammodendron)、芦苇(Phragmitesaustralis),在平原低地还有柽柳(Tamarixramosissima)、黑果枸杞(Lyciumruthenicum)、甘草(Glycyrrhizauralensis),湖滨盐沼地有盐穗木(Halostachyscaspica)、盐节木(Halocnemumstrobilaceum)、碱蓬(Suaedaglauca)和盐爪爪(Kalidiumfoliatum),山前冲积洪扇有琵琶柴(Reaumuriasoongorica)等[23]。
1.2 样品材料的采集
在艾比湖自然保护区南部阿奇克苏河北岸垂直河道每隔约2.0 km选取水盐交互作用梯度明显的3个典型样地,即高盐多水样地(SW-1),距河约1.0 km;中盐中水(SW-2),距河约3.0 km;低盐少水样地(SW-3),距河约5.0 km(表1)。在每块样地布设30 m×30 m的样方,以横坐标每隔10 m、纵坐标每隔10 m采集1份样品,共9个小样方,作植物多样性调查;以横坐标每隔5 m、纵坐标每隔6 m采1份样品,共30组植物样品,在植物根围,去掉表面的碎屑层后,挖取土壤(长10 cm×宽10 cm×深20 cm),连同植物根系装入无菌的塑料袋内,每份样品约5 kg,带回实验室进行AM真菌多样性分析。

表1 样地基本信息
注:同列数据后不同字母表示差异显著(P<0.05)。
1.3 分析方法
筛选出植物根围土样1 kg自然风干后(2~5 d)保存在低温库内(<10 ℃),用于AM真菌孢子筛选、分离与鉴定。从每份样品中抽取100 g土样,用改进的湿筛倾析-蔗糖离心法筛选AM真菌孢子[24-25]。在体视镜下先观察孢子的颜色、大小、连孢菌丝、孢子果等形态特征,进行初步分类,在此基础上,加浮载剂PVLG(聚乙烯醇-乳酸-甘油,即1.66 g聚乙烯醇、10 mL蒸馏水、10 mL乳酸、1 mL甘油),在光学显微镜(Classica,麦克奥迪E221)及体视显微镜(舜宇SZ-6745)下观察、测定孢子的颜色、大小、表面特征,孢壁颜色、类型、厚度等特征,内含物的性质,鉴定中可辅助使用Melzer’s试剂(100 g水合氯醛、100 mL蒸馏水、1.5 g碘、5 g碘化钾)和棉兰试剂(10 g石炭酸、10 mL乳酸、20 mL甘油、0.02 g棉兰、10 mL 蒸馏水),观察孢子的化学反应,对有代表性的形态进行拍照;综合以上观察结果,根据文献[26]、国际真菌INVAM(International Culture Collection of Arbuscular and Vesicular- Arbuscular Mycorrhizal Fungi)网址(www.invam.caf.wdu.edu)信息进行AM真菌鉴定。AM真菌孢子密度(spore density)以1 g土样中含有的孢子数表示;相对多度(relative abundance,RA)指该采样点AM真菌某属或某种孢子数占总孢子数的比率,即RA=(该采样点AM真菌某属或某种孢子数/该采样点AM真菌总孢子数)×100%。
1.4 数据处理
利用Excel 2010及R软件(http://cran.rproject.org)的Vegan程序包整理和计算AM真菌和植物物种多样性;用SPSS 20.0软件进行单因素方差分析检验AM真菌和植物在3个样地之间的差异。
2 结果与分析
2.1 水盐梯度下AM真菌α、β多样性的响应
比较各样地AM真菌α多样性可以看出,从SW-1到SW-3,Margalef指数随水盐梯度降低而降低,且样地间呈极显著差异(P<0.01)(图1)。而对物种多度依赖较强的Shannon-Wiener多样性指数、Simpson多样性指数、Pielou均匀度指数在样地间呈显著差异(P<0.05)。
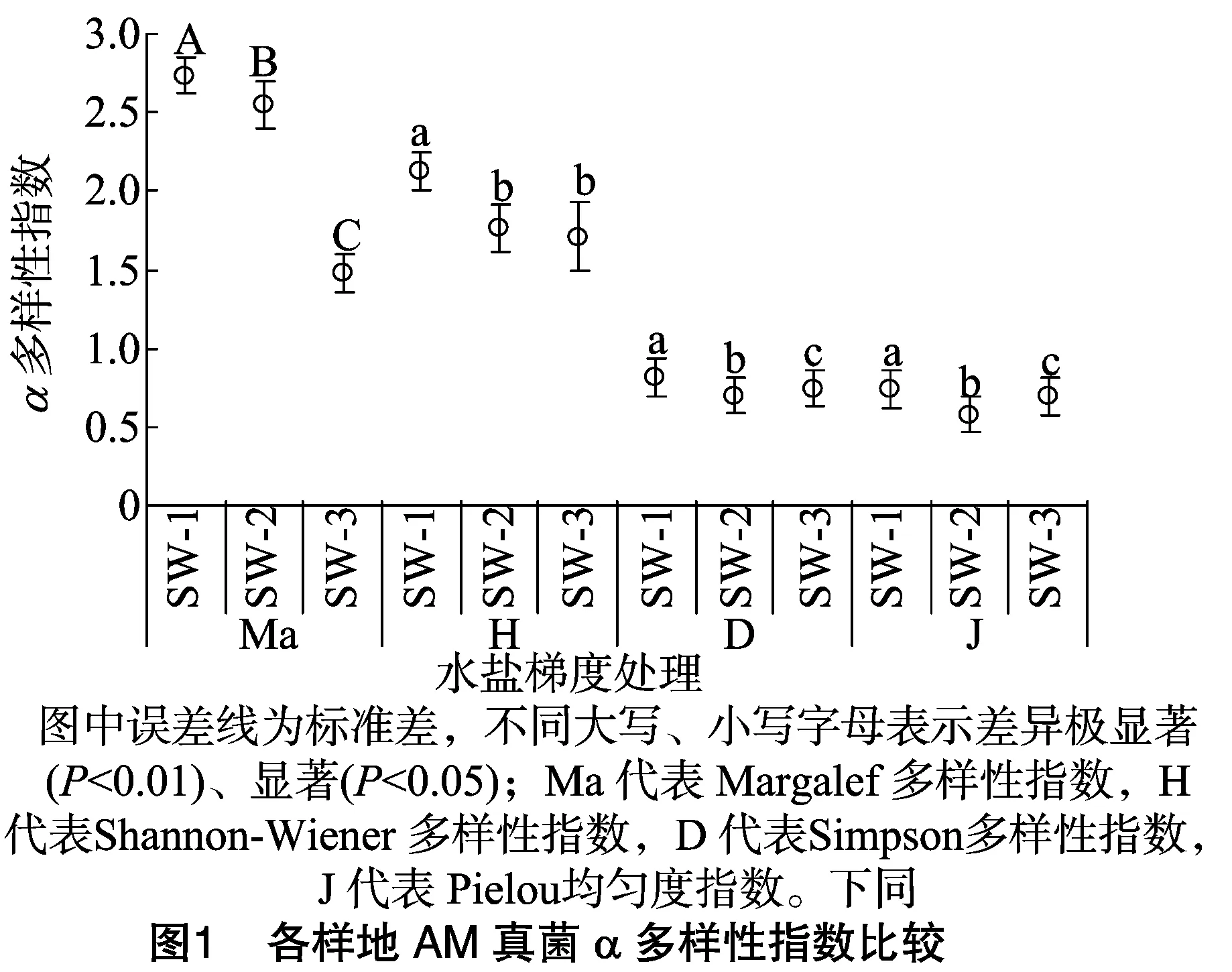
从β多样性分析结果可以看出,3个梯度之间AM真菌种类组成的Sorenson相似性指数从高到低为:SW-1与 SW-2 样地>SW-1与SW-3样地>SW-2与SW-3样地;Cody指数从高到低为:SW-2与SW-3样地>SW-1与SW-3样地>SW-1与SW-2样地,2种指数排序相反。SW-2与SW-3样地间的Sorenson指数最小,为0.36;Cody指数最大,为10.05(表2)。说明2个梯度的AM真菌群落组成差异最大,同时随着水盐梯度变化而变化。
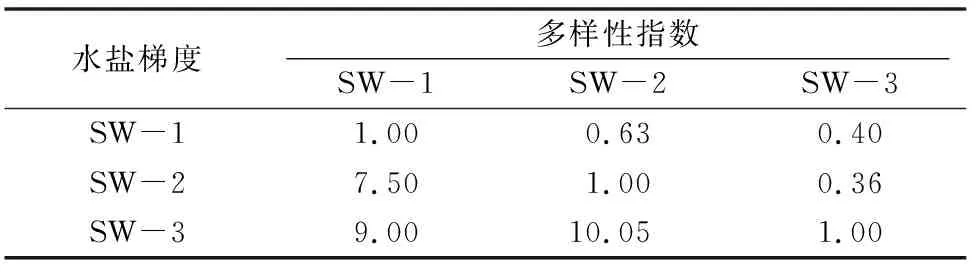
表2 各样地AM真菌种类β多样性
注:以“1.00”为对角线,右上角的为Sorenson指数βsor,左下角的为Cody指数βc。表3同。
2.2 水盐梯度下植物α、β多样性特征
依据α多样性指数的计算结果可以看出,植物多样性随水盐梯度降低在3个梯度之间均有差异性(图2)。具体来看,从SW-1到SW-3,Margalef多样性指数呈先上升后下降趋势,且样地间表现出极显著差异(P<0.01);Shannon-Wiener多样性指数、Simpson多样性指数和Pielou均匀度指数都随水盐含量减少呈先下降后上升趋势,即SW-1>SW-3>SW-2,且在高盐多水与中盐中水样地间呈显著差异(P<0.05)。
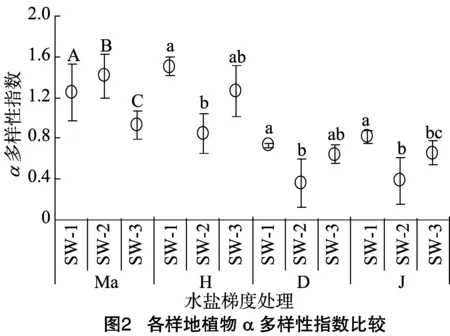
从β多样性计算结果可以看出,Sorenson指数排序为 SW-1 与SW-2>SW-2与SW-3>SW-1与SW-3;Cody指数排序为SW-1与SW-3>SW-2与SW-3>SW-1与SW-2,2种多样性指数趋势相反(表3)。随着水盐含量的减少群落组成更加相似,而且群落物种替代速率也在减弱。
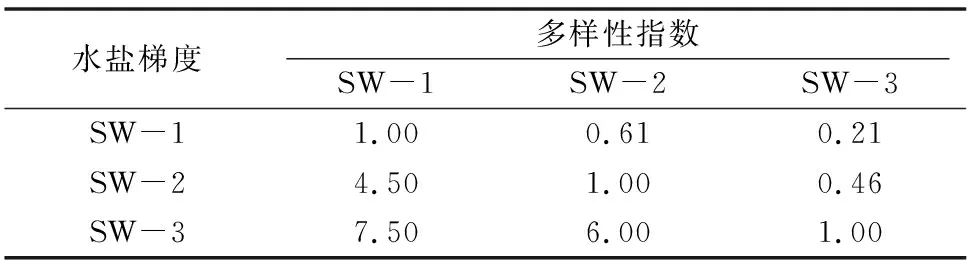
表3 植物β多样性
2.3 AM真菌多样性与植物多样性的相关性
2.3.1 AM真菌α多样性指数与植物α多样性指数相关性 对AM真菌和植物α多样性进行Pearson相关分析,结果表明,AM真菌的Shannon-Wiener多样性和植物的Margalef多样性呈极显著正相关(P<0.01),相关系数达到0.991;AM真菌的均匀度指数与植物的Simpson多样性呈显著正相关(P<0.05),相关系数为0.953;同一种多样性指数比较时,AM真菌的多样性与植物均呈正相关,其中Shannon-Wiener指数相关系数最小为0.020(表4)。
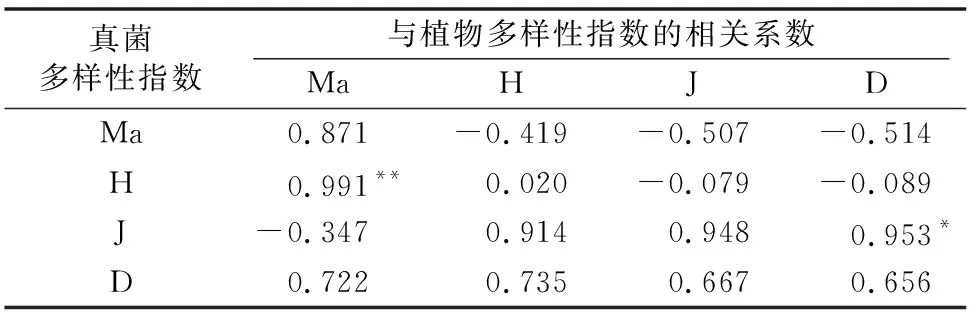
表4 植物与AM真菌α多样性的相关性
注:*、**分别表示在0.05、0.01水平上显著相关。
2.3.2 AM真菌与植物β多样性指数比较分析 在垂直河道自南向北的水盐梯度下,AM真菌Sorenson指数呈下降趋势,但不明显,Cody指数呈上升趋势,即AM真菌群落种群的演替过程是群落组成的共有种减少(图3)。说明随着土壤水盐梯度由多盐多水向少盐少水发展,群落组成相似性减小,而群落物种替代速率增大。植物Sorenson指数呈上升趋势,Cody指数呈下降趋势,体现了植物群落由多盐多水向少盐少水变化过程中植物的共有种增多、种群相似性增大,而群落物种替代速率减小。部分说明随着土壤水盐梯度向极端环境发展的过程中,耐盐植物群落向耐旱群落演替,由于水分在SW-2向SW-3发展过程中,土壤水分含量处在低水平,所以耐干旱植物群落占有优势。

3 讨论
从α多样性来看,AM真菌的Margalef指数在3个水盐梯度上随水盐降低而降低,与植物不同;植物在SW-1多样性相对较高,到SW-2和SW-3时水分成为主要胁迫,所以多样性指数降低,但SW-3高于SW-2,可能是因为盐胁迫降低,有利于草本植物生长[23],使多样性升高。而宿主植物种类和根系结构特征是AM真菌共生与繁殖的重要因素,所以随着水盐梯度的变化,宿主植物不同,AM真菌种类、多样性也随之变化[27]。AM真菌的Shannon-Wiener多样性指数、Simpson多样性指数、Pielou均匀度指数变化趋势与植物相应多样性指数大致相同,相较于植物AM真菌样地间变化幅度较小但差异显著。因为在干旱区,水分是植物生长的最主要限制因子[28],研究表明AM真菌能够提高植物的水分利用效率。干旱胁迫会诱导植物多种调控蛋白的基因表达,AM真菌可以通过调控植物抗旱性基因的表达量,来实现对干旱胁迫的适应[29]。
从β多样性来看,大量的研究结果[30-33]证实AM真菌可以通过改变植物的种间竞争能力影响植物群落组成。本研究中植物与AM真菌在不同梯度上的群落变化特征不一致,样地之间演替甚至呈相反的趋势,也有研究发现增加土壤中AM真菌的多样性可以显著提高植物群落的物种多样性[34]。植物的Sorenson指数呈上升趋势,说明随着水盐梯度的变化,群落间的共有种越来越少,因为在水盐共同胁迫下群落内的物种逐渐演变为耐旱和耐盐植物,群落组成趋向简单,而且Cody指数呈下降趋势,因为在极端环境下由耐旱耐盐植物组成的群落不易被代替,所以群落演替速率降低。对于AM真菌而言,共有种减少可能是由于在研究区内AM真菌易寄生的植物种并非一定是植物群落的优势种[35]。相对于植物演替的速率,AM真菌演替的速率较大,这可能与AM真菌对寄生植物和对环境因素特异适应,及植物根系根际环境反作用AM真菌有关,随着土壤水分含量达到极低的水平,能够适应干旱环境的植物明显减少,耐旱植物成为群落种的优势植物,而寄生于根下的AM真菌形成特异寄生干旱植物的AM真菌群落,此时在演替过程中植物消失1个种的宿主,对于特异寄生根系消失的却是一个AM真菌群落,所以AM真菌群落演替速率快于植物群落。
通过对植物多样性和AM真菌多样性进行相关性分析可以看出,宿主植物和寄生AM真菌的各多样性指数都成正相关关系,这可能是由于水分和盐分这两大因素直接影响到植物的多样性,同时也间接影响到AM真菌的物种多样性[36]。
4 结论
植物α多样性指数在不同水盐梯度上呈显著性差异,且随水盐变化,β多样性表明植物群落演替趋于选择能适应高盐多水和低盐极少水的极端环境的耐盐植物和耐旱植物。
依赖丰度的AM真菌α多样性指数表现为随水盐梯度逐渐降低,多样性亦降低,而对物种多度依赖较强的α多样性指数表现较为均衡;β多样性显示,随水盐梯度变化,AM真菌不同,水盐梯度上群落之间的共有种减少,群落演替速率加快;而植物共有种增多,群落不易被替代。
植物与AM真菌的4种多样性指数均呈正相关关系,体现了AM真菌对宿主植物和土壤水盐的双重响应;随着土壤水盐梯度由多盐多水向少盐少水发展,群落最终的演替成为组成较为简单的群落,AM真菌的演替速率大于植物群落。
:
[1]Smith S E,Read D J. Mycorrhizal symbiosis[M]. 3rd ed. San Diego:Academic Press,2008:573.
[2]Wang B,Qiu Y L. Phylogenetic distribution and evolution of mycorrhizas in land plants[J]. Mycorrhiza,2006,16(5):299-363.
[3]祝 英,熊俊兰,吕广超,等. 丛枝菌根真菌与植物共生对植物水分关系的影响及机理[J]. 生态学报,2015,35(8):2419-2427.
[4]李晓林,冯 固,张美庆,等. 丛枝菌根生态生理[M]. 北京:华文出版社,2001:136-138.
[5]Klironomos J N. Variation in plant response to native and exotic arbuscular mycorrhizal fungi[J]. Ecology,2003,84(9):2292-2301.
[6]陈 云,马克明. 城市菌根真菌多样性变化机制及功能应用[J]. 生态学报,2016,36(14):1-12.
[7]金 樑,孙 莉,王 强,等. AM真菌在草原生态系统中的功能[J]. 生态学报,2016,36(3):873-882.
[8]杨海水,熊艳琴,王 琪,等. AM真菌物种多样性:生态功能,影响因素及维持机制[J]. 生态学报,2016,36(10):2826-2832.
[9]der Heijden M G,Klironomos J M,Ursic M,et al. Mycorrhizal fungal diversity determines plant biodiversity,ecosystem variability and productivity[J]. Nature,1998,396(6706):69-72.
[10]Smith F A,Jakobsen I,Smith S E. Spatial differences in acquisition of soil phosphate between two arbuscular mycorrhizal fungi in symbiosis withMedicagotruncatula[J]. New Phytologist,2000,147(2):357-366.
[11]Moora M,Zobel M. Effect of arbuscular mycorrhiza on inter-and intraspecific competition of two grassland species[J]. Oecologia,1996,108(1):79-84.
[12]Moora M,Zobel M. Can arbuscular mycorrhiza change the effect of root competition between conspecific plants of different ages?[J]. Canadian Journal of Botany,1998,76(4):613-619.
[13]Zhang Q,Xu L M,Tang J J,et al. Arbuscular mycorrhizal mediation of biomass-density relationship ofMedicagosativaL. under two water conditions in a field experiment[J]. Mycorrhiza,2011,21(4):269-277.
[14]Zhang Q,Zhang L,Weiner J,et al. Arbuscular mycorrhizal fungi alter plant allometry and biomass-density relationships[J]. Annals of Botany,2011,107(3,SI):407-413.
[15]冀春花,张淑彬,盖京苹,等. 西北干旱区AM真菌多样性研究[J]. 生物多样性,2007,15(1):77-83.
[16]Hoeksema J D,Chaudhary V B,Gehring C A,et al. A meta-analysis of context-dependency in plant response to inoculation with mycorrhizal fungi[J]. Ecology Letters,2010,13(3):394-407.
[17]张义飞,王 平,毕 琪,等. 不同强度盐胁迫下AM真菌对羊草生长的影响[J]. 生态学报,2016,36(17):1-10.
[18]Wang S X,Dong X G,Liu L. Natural vegetation diversity differentiation under water and salt gradients in the oasis of Yanqi Basin,Xinjiang[J]. Journal of Glaciology and Geocryology,2010,32(5):999-1006.
[19]Gu F X,Zhang Y D,Pan X L,et al. Correlation between soil saltilisation and community diversity:the case of Fukang oasis[J]. Resources Science,2002,24(3):42-48.
[20]Shi R H,Li X,Dong X G,et al. Research on the relationship between natural vegetation growth and groundwater in Yanqi Basin[J]. Journal of Natural Resources,2009,7(4):542-549.
[21]张雪妮,吕光辉,杨晓东,等. 基于盐分梯度的荒漠植物多样性与群落、种间联接响应[J]. 生态学报,2013,33(18):5714-5722.
[22]杨晓东,吕光辉,田幼华,等. 新疆艾比湖湿地自然保护区植物的生态分组[J]. 生态学杂志,2009,28(12):2489-2494.
[23]杨晓东,吕光辉,张雪梅,等. 艾比湖湿地自然保护区8个乔灌木种群空间分布格局分析[J]. 植物资源与环境学报,2010,19(4):37-42.
[24]Gerdemann J W,Nicolson T H. Spores of mycorrhizal Endogone species extracted from soil by wet sieving and decanting[J]. Transactions of the British Mycological Society,1963,46(2):235-244.
[25]Daniels B A,Skipper H D. Methods for the recovery and quantitative estimation of propagules from soil[Vesicular-arbuscular mycorrhizal fungi][C].Scheack N C.Methods and principles of mycorrhizal research,1982:29-37.
[26]Schenck N C,Perez Y. Manual for identification of vesicular arbuscular mycorrhizal fungi[M].2nd ed.Florida:INVAM University of Florida Gainesville,1988:245.
[27]Tawaraya K,Saito M,Morioka M. Effect of phosphate application to arbuscular mycorrhizal onion on the devel opment and succinate dehydrogenase activity of internal hyphae[J]. Soil Science and Plant Nutrition,1994,40(4):667-673.
[28]Ruiz-Lozano J M, Porcel R,Aroca R.Does the enhanced tolerance of arbuscular mycorrhizal plants to water deficit involve modulation of drought-induced plant genes[J]. New Phytologist,2006,171(4):693-698.
[29]叶佳舒,李 涛,胡亚军,等. 干旱条件下AM真菌对植物生长和土壤水稳定性团聚体的影响[J]. 生态学报,2013,33(4):1080-1090.
[30]Smith M D,Harenett D C,Wilson G T. Interacting influence of mycorrhizal symbiosis and competition on plant diversity in tallgrass prairie[J]. Oecologia,1999,121:574-582.
[31]West H M. Influence of arbuscular mycorrhizal infection on competition betweenHolcuslanatusandDactylisglomerata[J]. Journal of Ecology,1996,84(3):429-438.
[32]WatkinsonAR,FreckletonRP.Quantifyingtheimpact of
arbuscular mycorrhiza on plant competition[J]. Journal of Ecology,1997,85(4):541-545.
[33]Hart M M,Reader R J,Klironomos J N. Plant coexistence mediated by arbuscular mycorrhizal fungi[J]. Trends in Ecology & Evolution,2003,18(8):418-423.
[34]van der Heijden M G, Horton T R.Socialism in soil?The importance of mycorrhizal fungal networks for facilitation in natural ecosystems[J]. Journal of Ecology,2009,97(6):1139-1150.
[35]Grime J,Mackey J L,Hillier S H,et al. Floristic diversity in a model system using experimental microcosms[J]. Nature,1987,328(6129):420-427.
[36]杨高文,刘 楠,杨 鑫,等. 丛枝菌根真菌与个体植物的关系及其对群落生产力和物种多样性的影响[J]. 草业学报,2015,24(6):188-203.
