木质素降解菌BP01的筛选、鉴定及其产酶特性
2018-05-30姜立春赵丽萍李小芳阮期平
姜立春, 赵丽萍,杨 萍, 王 婷, 李小芳, 朱 静, 阮期平
(绵阳师范学院分子生物学与生物制药重点实验室,四川绵阳 621000)
木质素(lignin)是一种广泛存在于植物体中的、无定形的、分子结构中含有氧代苯丙醇或其衍生物结构单元的芳香性高聚物,是由松柏醇、香豆素、芥子醇3种醇单体通过羟基或甲氧基取代的苯丙烷单体经无序聚合而成的三维复杂结构[1]。木质素主要填充于纤维素构架中,以增强植物体的机械强度,避免生物侵害和水的侵蚀,具有抗菌、抗氧化、抗吸收紫外线和阻燃等功能,同时具有较高的稳定性,因而自然降解速率缓慢。在木本植物中,木质素含量仅次于纤维素,是世界上第2位最丰富的有机物。
我国是秸秆资源最丰富的国家之一。据报道,我国农作物秸秆年产量为6亿~7亿t,约占世界总产量的1/3。木质纤维素是农作物秸秆的主要成分,也是地球上数量最大的可再生能源物质。植物体内木质素将纤维素紧紧包围,一般的微生物很难进入,因此很难分解纤维素,进而导致秸秆资源开发利用困难[2]。数据表明,造纸工业每年要从植物中分离出约1.4亿t纤维素,同时得到5 000万t左右的木质素副产品,但超过95%的木质素以“黑液”直接排入江河或浓缩直接烧掉,不符合建设节约型经济体系的思路。木质素的科学利用决定木质素经济效益的可持续发展。现今,环境污染和资源匮乏等问题不断深化,天然高分子所具有的可再生、可降解等性质也日益受到重视。因此,木质素的高效降解成为国内外的研究热点。
国内外已有的降解方法包括物理降解、化学降解、物理-化学降解、物理-生物降解、物理-化学-生物降解以及生物降解[3]。其中,生物降解法使用最多且效果最明显。降解木质素的微生物主要是真菌、细菌和放线菌,其中真菌占主导作用[4-5]。木质素降解酶的研究主要集中在白腐菌酶系,最为重要的酶有3种,即木质素过氧化物酶(lignin peroxidases,Lip)、锰依赖过氧化物酶(manganese perxidases,Mnp)和漆酶(laccase)[6]。目前,白腐真菌是唯一已知的在纯培养条件下可将木质素彻底分解的微生物,它能分泌胞外氧化酶来降解木质素,其降解木质素的能力优于分解纤维素的能力,被认为是迄今最有价值的木质素降解微生物。其类属中的虫拟蜡菌(Ceriporiopsissubvermispora)[7]、产芽孢木质素降解菌MN-8[8]、高温木质素降解菌(GeobacilluscaldoxylosilyticusJ16)[9]和绿色木霉Bax[10]等菌对木质素的降解具有较强的选择性。国内外已有许多关于白腐菌筛选及其降解木质素的研究,但因筛选方法具有局限性,造成优良菌株漏筛甚至错筛,不利于寻找新的木质素高效降解菌株[10]。且在研究过程中大多数白腐菌在降解木质素时选择性较差,所以分离筛选优良木质素降解菌及其优化发酵条件提高酶活性具有重要的现实意义。
1 材料与方法
1.1 材料
1.1.1 样品来源 校园周边竹林地表土壤、地表下5 cm土壤及长有子实体的腐木。
1.1.2 培养基 初筛培养基:K2HPO40.5 g、KH2PO40.5 g、NaCl 0.2 g、NH4NO31.0 g、MgSO40.2 g、CaCl20.2 g、FeSO4·7H2O 0.01 g、MnSO4·H2O微量、竹粉10 g(鲜竹磨粉,过40目筛,65 ℃烘16 h)、琼脂粉20 g,加蒸馏水定溶至1 L,121 ℃ 高压灭菌20 min,倒平板,备用。
复筛培养基1:马铃薯200 g、酵母粉15~20 g、蛋白胨5 g、葡萄糖10 g、氯化钠5 g、愈创木酚0.2 mL,蒸馏水定容到 1 L,pH值为7.0,琼脂粉20 g,121 ℃高压灭菌20 min,倒平板,备用。
复筛培养基2:马铃薯200 g、酵母粉15~20 g、蛋白胨 5 g、葡萄糖10 g、氯化钠5 g、苯胺兰0.1 g,蒸馏水定容到1 L,pH值为7.0,琼脂粉20 g,121 ℃高压灭菌20 min,倒平板,备用。
产酶发酵培养基:K2HPO42 g、(NH4)2SO42 g、MgSO4·7H2O 0.3 g、木质素10 g,pH值6.0,蒸馏水定容到1 L。
1.2 试验方法
1.2.1 初筛 将采集的样品各称取1 g于10 mL生理盐水中洗涤,取洗涤液,共得到5种待用样品。将上述1~5菌液分别进行梯度稀释10-3~10-6并涂布于初筛培养基上,每个平板涂布100 μL。将上述得到的菌落挑于复合营养初筛培养基中,30 ℃恒温培养箱培养,逐次分离直到得到单菌落,将分离纯化出的菌株保存、备用。
1.2.2 复筛 将初筛得到的单菌落,用灭过菌的牙签挑取,并分别接种于上述复筛培养基1平板中和复筛培养基2平板中,根据培养基产生的现象筛选出菌株。
1.2.3 酶活性的测定
1.2.3.1 木质素过氧化物酶活性测定 选用藜芦醇作为底物,反应体系如下:125 mmol/L酒石酸钠缓冲液(pH值为3.0)3.2 mL,10 mmol/L藜芦醇0.1 mL,酶液0.6 mL,加入 10 mmol/L H2O2溶液0.1 mL启动反应,测反应最初3 min内310 nm处D值的变化。以煮沸灭活15 min酶液反应混合液作对照。酶活性定义为1 min使得反应液吸光值变化0.1的酶量为1个酶活性单位(U)[11]。
1.2.3.2 锰过氧化物酶活性测定 50 mmol/L乳酸钠缓冲液(pH值为4.5)3.4 mL,1.6 mmol/L MnSO4溶液 0.1 mL,0.4 mL的培养基滤出液,预热至32 ℃加入 1.6 mmol/L H2O2溶液0.1 mL启动反应,测反应最初 3 min 内240 nm处吸光度变化。酶活性定义为1 min内1 mL培养基滤液增加0.1个D值为1个酶活性单位[12]。
1.2.3.3 漆酶的酶活测定 取1.5 mL浓度为50 mmol/L的乙酸-乙酸钠缓冲液(pH值为4.5),1 mL浓度为 0.4 mmol/L 的愈创木酚和1 mL粗酶液,放在25 mL试管中振荡混匀,预热至32 ℃反应5 min,反应结束100 ℃煮沸灭活5 min,立即冷却,然后加蒸馏水至20 mL,混匀,测定470 nm下10 min内ΔD,470 nm消光系数ε=49 600 mol/(L·cm)。酶活性定义1 L反应液1 min使ΔD470 nm值改变0.1为1 U[13]。
1.2.4 菌株鉴定
1.2.4.1 形态观察 菌株在高氏一号培固体养基上28 ℃培养36 h后进行菌落形态观察,放于4 ℃冰箱中保存。挑取单一菌落进行革兰氏染色,显微镜下观察其菌体形态结构。
1.2.4.2 生理生化鉴定 参照文献[14]中的方法对菌株BP01进行生理生化试验检测。依据《常见细菌系统鉴定手册》,对分离到的菌株BP01进行初步鉴定[15]。
1.2.4.3 基因组提取和16S rRNA基因扩增 参考Rainey等的方法[16]提取细菌总DNA,略有修改,用1.0%琼脂糖电泳检测。
PCR反应体系:16.25 μL、ddH2O、2.5 μL 10×PCR buffer、2 μL dNTPs(各2.5 mmol/L)、1.0 μL F27正向引物(5′-AG AGTTTGATCCTGGCTCAG- 3′)(10 μmol/L)、1.0 μL R1492反向引物(5′-GGTTACCTTGTTACGACTT-3′)(10 μmol/L)、2 μL模板、0.25 μLTaqDNA聚合酶(5 μg/μL),反应总体积为20 μL。扩增循环体系:94 ℃预变性4 min;94 ℃ 变性40 s,58 ℃退火40 s,72 ℃延伸80 s,35个循环;72 ℃延伸10 min。PCR扩增产物经电泳检测后,其产物回收纯化后与pMD-19T载体连接,转入感受态细胞DH5α,筛选阳性重组子,邮寄至上海英俊生物技术公司测序,核酸序列用于构建系统发育树。
1.2.4.4 16S rRNA序列分析与构建系统发育树 通过测序获得的16S rRNA序列用NCBI中BLAST搜索与GenBank数据库进行相似性分析,从而获得相应菌株16S rRNA序列,在Clustal X(1.8)程序包中进行多重序列比对排列分析。利用MEGA 6.0软件中的Neighbor-Joining法构建系统发育树[17]。
1.2.5 菌株产酶条件的优化
1.2.5.1 时间 将待优化菌种接入液体产酶培养基中,接种量为5%。置于32 ℃、160 r/min摇床上进行培养,观察并记录其生长状况,待菌液培养至其菌丝一定量时,开始测定木质素降解酶系中的Lip活性,并每过12 h测定记录1次,测定 5~7 d。作出Lip活性随培养时间变化的变化曲线,找出Lip最佳产酶活时间,并综合确定优化的最佳培养时间。
1.2.5.2 碳源及浓度 分别以葡萄糖、麦麸、蔗糖、马铃薯浸出液、可溶性淀粉和玉米粉作为液体产酶培养基中的唯一碳源,碳源的质量浓度为20 mg/mL,于32 ℃、160 r/min下摇床培养上述已经确定的最佳培养时间,后进行Lip活性的测定,综合比较选择酶活性较大的碳源。将已经选出的最佳碳源分别设置浓度为5、10、15、20、30、40 mg/mL,于上述条件下进行摇床培养,测定最佳培养时间的Lip活性,综合比较选出最佳碳源的最适酶活性浓度。
1.2.5.3 氮源及浓度 分别以牛肉膏、蛋白胨、硫酸铵、硝酸铵、酵母粉和尿素作为液体产酶培养基中的唯一氮源,氮源的质量浓度为1 g/L,于32 ℃、160 r/min下摇床培养上述已经确定的最佳培养时间,后进行Lip活性的测定。其中培养基碳源选择笔者已经确定的最佳碳源及其浓度,综合比较选择酶活性较大的氮源。将已经选出的最佳氮源分别设置浓度为0.5、1、2、4、6、8 g/L,于上述条件下进行摇床培养,测定最佳培养时间的Lip酶活性,综合比较选出最佳氮源的最适酶活性浓度。
1.2.5.4 不同pH值对产酶条件的影响 分别设定pH值为5、5.5、6、6.5、7、7.5、8、8.5,将菌株于160 r/min的摇床上进行培养。碳源、氮源分别选择已优化出的最佳碳源、氮源及其相应的浓度,于确定的最佳培养时间进行Lip活性的测定,综合比较选择酶活性最高时的pH值。
1.2.5.5 温度 分别设定温度为20、25、32、37、40、45 ℃,将菌株于160 r/min的摇床上进行培养。碳源、氮源和pH值分别选择已优化的最佳碳源、氮源及其相应的浓度和pH值,于确定的最佳培养时间进行Lip活性的测定,综合比较选择酶活性最高时的温度。
1.2.5.6 不同装液量对产酶条件的影响 于250 mL的三角瓶中分别装液30、50、80、100、120 mL液体产酶培养基,置于最佳温度160 r/min下进行摇床培养。其中,碳源、氮源、温度、pH值分别选择已优化的最佳碳源、氮源、温度和pH值,并于确定的最佳培养时间进行Lip活性的测定,综合比较选择酶活性最高时的装液量。
1.2.5.7 综合最佳条件进行培养测定 在确定的最佳碳源和氮源及其最佳浓度、温度、pH值、装液量下,将菌恒温 160 r/min 下摇床培养相应时间后测定Lip活性,与上各单因素测定酶活性比较在综合条件下其酶活性是否有大的改进,从而可以了解菌产酶条件的优化情况。
2 结果与分析
2.1 筛选结果
2.1.1 初筛 通过平板稀释法初步筛选出有木质素降解作用的菌株18株进行复筛,其中苯胺蓝脱色圈直径≥ 30 mm 的2株,脱色圈直径在20~30 mm的3株,其余13株菌脱色圈相对较小,可能降解作用较低,其中BP01的降解能力最强,其脱色圈直径为35.0 mm,且愈创木酚苯胺蓝脱色圈直径也达到了20 mm(表1)。因此,选BP01进行形态观察、生理生化试验与16S rDNA的序列测定来确定该菌株的分类地位。
2.1.2 复筛 通过对初筛得到的18株菌进行木质素过氧化物酶活性测定,其中菌株BP01木质素过氧化物酶与锰过氧化物酶活性为266.33、58.12 U/L,为18株菌中最高的;漆酶活性相对较低(表2)。因此,随后的木质素的降解条件优化以木质素过氧化物酶作为指标。
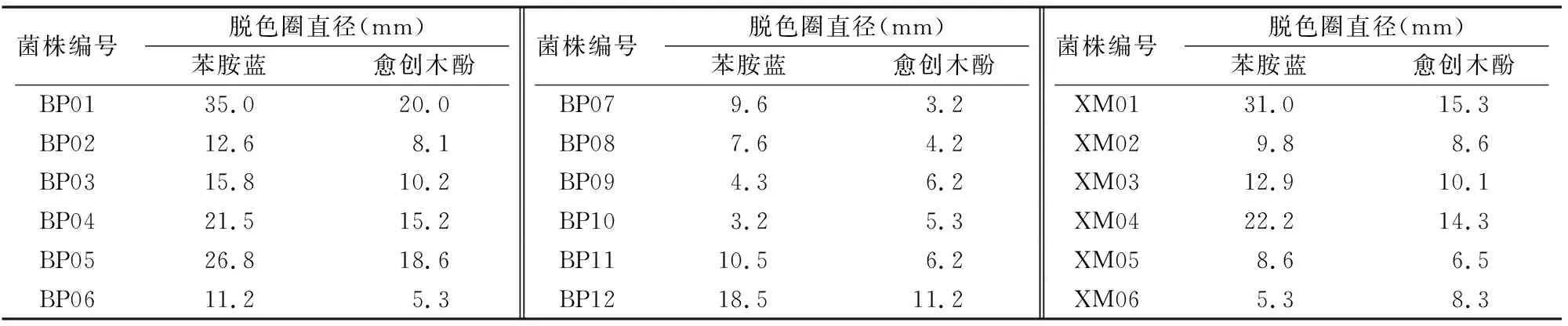
表1 木质素降解菌初筛结果
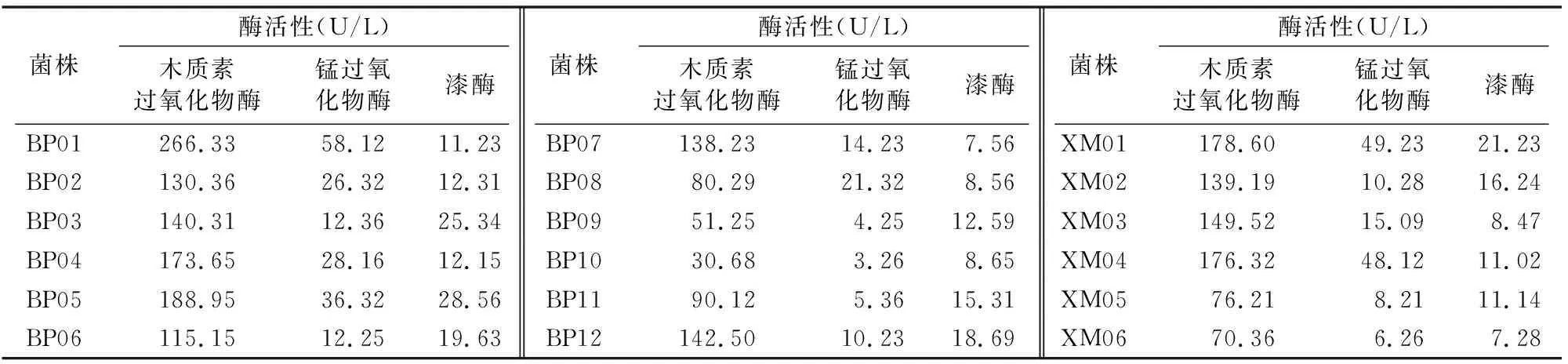
表2 18株菌木质素过氧化物酶、锰过氧化物酶和漆酶活性
2.2 鉴定结果
2.2.1 形态观察 菌株在含有木质素的营养琼脂固体平板上生长,出现了透明圈,无可溶性色素。有臭味,乳白色,湿润,菌落大而扁平,边缘不整齐呈锯齿状,表面粗糙,半透明,正反面颜色相同,生长快,易挑起,不产生色素。通过形态观察,初步判定为细菌。经革兰氏染色后发现,细胞呈杆状,革兰氏染色为紫色,呈阳性。
2.2.2 生理生化反应 该菌株能分解葡萄糖,产酸但不产气,V.P试验为阳性反应,甲基红试验为阴性,吲哚试验阳性反应,有吲哚生成,淀粉水解呈阳性,过氧化氢酶检测呈阳性,有气泡生成,不能利用明胶,硝酸盐还原试验呈阳性,不产硫化氢。根据BP01菌株的形态特征和生理生化特征鉴定的结果,对照《伯杰氏细菌鉴定手册》,初步得出菌株BP01与类芽孢杆菌属(Paenibacillus)细菌很相近。
2.2.3 菌株BP01序列测定 测序后得到菌株BP01序列长度为1 516 bp,其序列如下:
A C G G T T A C C T T G T T A C G A C T T C A C C C C A A T C A T C T A C C C C A C C T T C G A C G G C T G G C T C C T T G C G G T T A C C C C A C C G G C T T C G G G T G T T G T A A A C T C T C G T G G T G T G A C G G G C G G T G T G T A C A A G A C C C G G G A A C G T A T T C A C C G C G G C A T G C T G A T C C G C G A T T A C T A G C A A T T C C G A C T T C A T G C A G G C G A G T T G C A G C C T G C A A T C C G A A C T G A G A C C G A C T T T G T T G G G A T T G G C T C C A C C T C G C G G T T T C G C G A C C C G T T G T A T C G G C C A T T G T A G T A C G T G T G T A G C C C A G G T C A T A A G G G G C A T G A T G A T T T G A C G T C A T C C C C A C C T T C C T C C G G T T T G T C A C C G G C A G T C A T C C T A G A G T G C C C A C C C A A A G T G C T G G C A A C T A A G A T C A A G G G T T G C G C T C G T T G C G G G A C T T A A C C C A A C A T C T C A C G A C A C G A G C T G A C G A C A A C C A T G C A C C A C C T G T C T C C T C T G T C C C G A A G G A A A G T C C T A T C T C T A G G A C G G T C A G A G G G A T G T C A A G A C C T G G T A A G G T T C T T C G C G T T G C T T C G A A T T A A A C C A C A T A C T C C A C T G C T T G T G C G G G T C C C C G T C A A T T C C T T T G A G T T T C A G T C T T G C G A C C G T A C T C C C C A G G C G G A A T G C T T A A T G T G T T A A C T T C G G C A C C A A G G G T A T C G A A A C C C C T A A C A C C T A G C A T T C A T C G T T T A C G G C G T G G A C T A C C A G G G T A T C T A A T C C T G T T T G C T C C C C A C G C T T T C G C G C C T C A G C G T C A G T T A C A G C C C A G A A A G T C G C C T T C G C C A C T G G T G T T C C T C C A C A T C T C T A C G C A T T T C A C C G C T A C A C G T G G A A T T C C A C T T T C C T C T T C T G T A C T C A A G C T T T G C A G T T T C C A T T G C G A C T C G A A G T T G A G C T C C G A G T T T A A A C A A C A G A C T T A C A A G G C C G C C T G C G C G C G C T T T A C G C C C A A T A A T T C C G G A C A A C G C T T G C C C C C T A C G T A T T A C C G C G G C T G C T G G C A C G T A G T T A G C C G G G G C T T T C T T C T C A G G T A C C G T C A C C T A T G G A G C A G T T A C T C T C C A T A G C G T T C T T C C C T G G C A A C A G A G C T T T A C G A T C C G A A A A C C T T C A T C A C T C A C G C G G C G T T G C T C C G T C A G A C T T T C G T C C A T T G C G G A A G A T T C C C T A C T G C T G C C T C C C G T A G G A G T C T G G G C C G T G T C T C A G T C C C A G T G T G G C C G A T C A C C C T C T C A G G T C G G C T A T G C A T C G T C G C C T T G G T G A G C C G T T A C C C C A C C A A C T A G C T A A T G C A C C G C A G G T C C A T C C A T A A G T G G C A G A T T G C T C C G C C T T T C C C A A C T C G G C C A T G C G A C C A A A T T G C G T A T C C G G T A T T A G C A T C C G T T T C C G A A T G T T A T C C C A G T C T T A T G G G C A G G T T A C C C A C G T G T T A C T C A C C C G T C C G C C G C T A A C C A C G C G T T T C C C G A A G G A A A C G C T A G G T C C G C T C G A C T T G C A T G T A T T A G G C A C G C C G C C A G C G T T C G T C C T G A G C C A T G A T C A A A C T C T
2.2.4 16S rDNA系统发育树的构建 测序获得的菌株BP01的16S rDNA序列,将测得的序列与数据库中已注册的16S rDNA序列用BLAST搜索进行序列相似性比较分析。将Genbank中与菌株BP01相似性较高的12个菌株进行系统发育树的构建(图1),供试菌株的16S rDNA序列与芽孢杆菌属的标准菌株同源相似度大部分在97%以上。通常当2个细菌的16S rDNA的相似性大于95%时,可将其归为同一属[18],而同源性大于96%的序列均来自类芽孢杆菌属,初步将此菌株归为类芽孢杆菌属。同时BP01在系统发育树上与类芽孢杆菌(Paenibacillusxinjiangensisstrain B538)B538(登录号为NR_043221)聚集在同一个分支中,且16S rDNA序列的同源相似性最为99%。结合其形态特征及生理生化特性与类芽孢杆菌属较为一致,因此菌株BP01为类芽孢杆菌属,命名为Paenibacillussp. BP01。
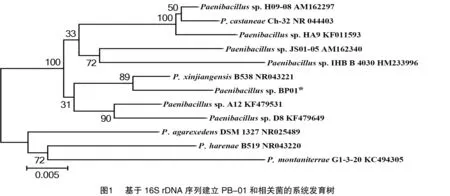
2.3 产酶优化结果
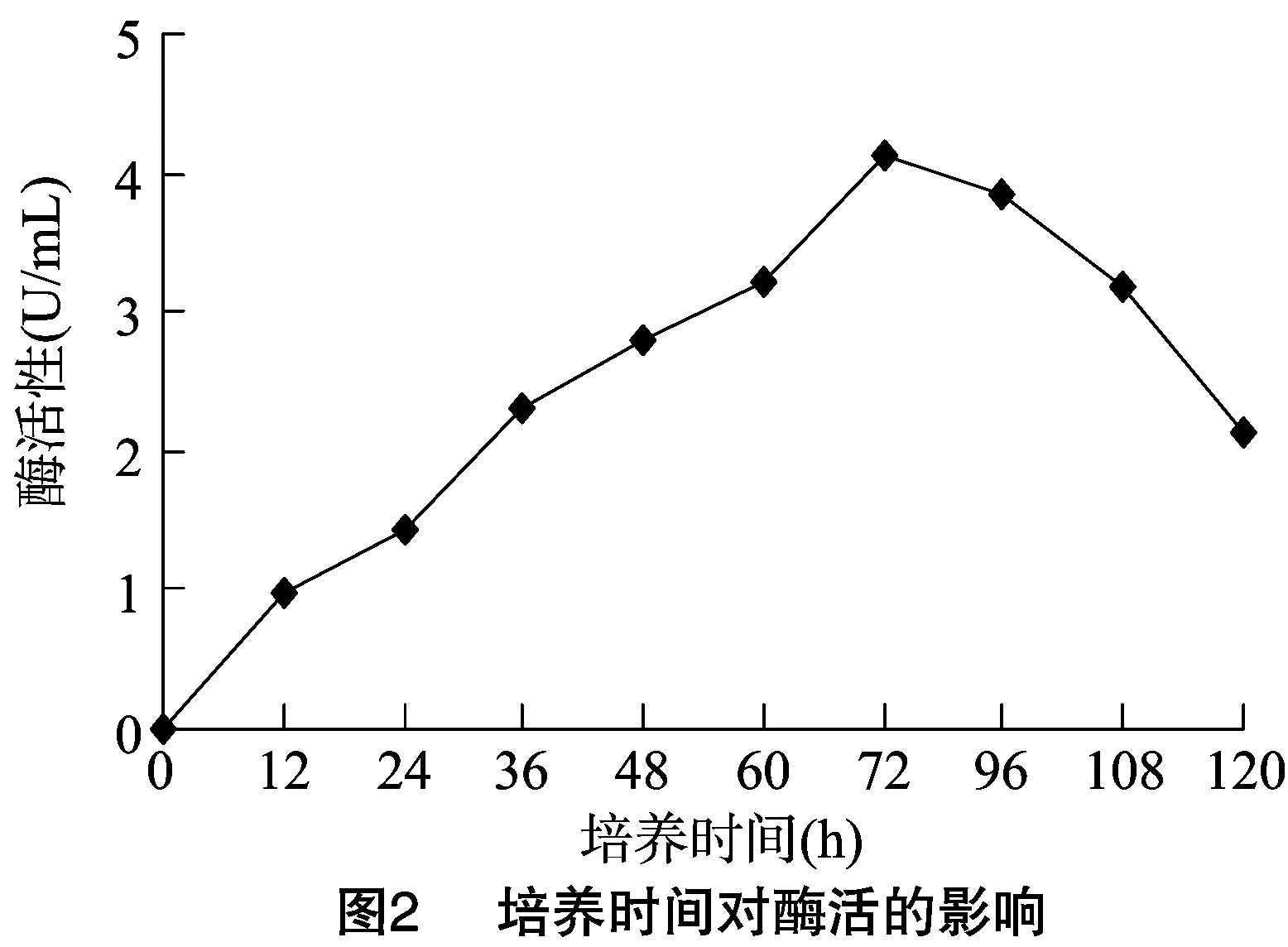
2.3.1 BP01培养时间 将BP01接入产酶发酵培养基中(接种量为2%),置于32 ℃、160 r/min摇床上进行培养,观察并记录其生长状况,每12 h测定记录1次,共5 d。结果发现,BP01的酶活性在0~72 h逐渐增大,在72 h时达到最大,当培养时间超过72 h其酶活性随着时间的增大而减小(图2)。因此,确定培养时间确定为72 h。
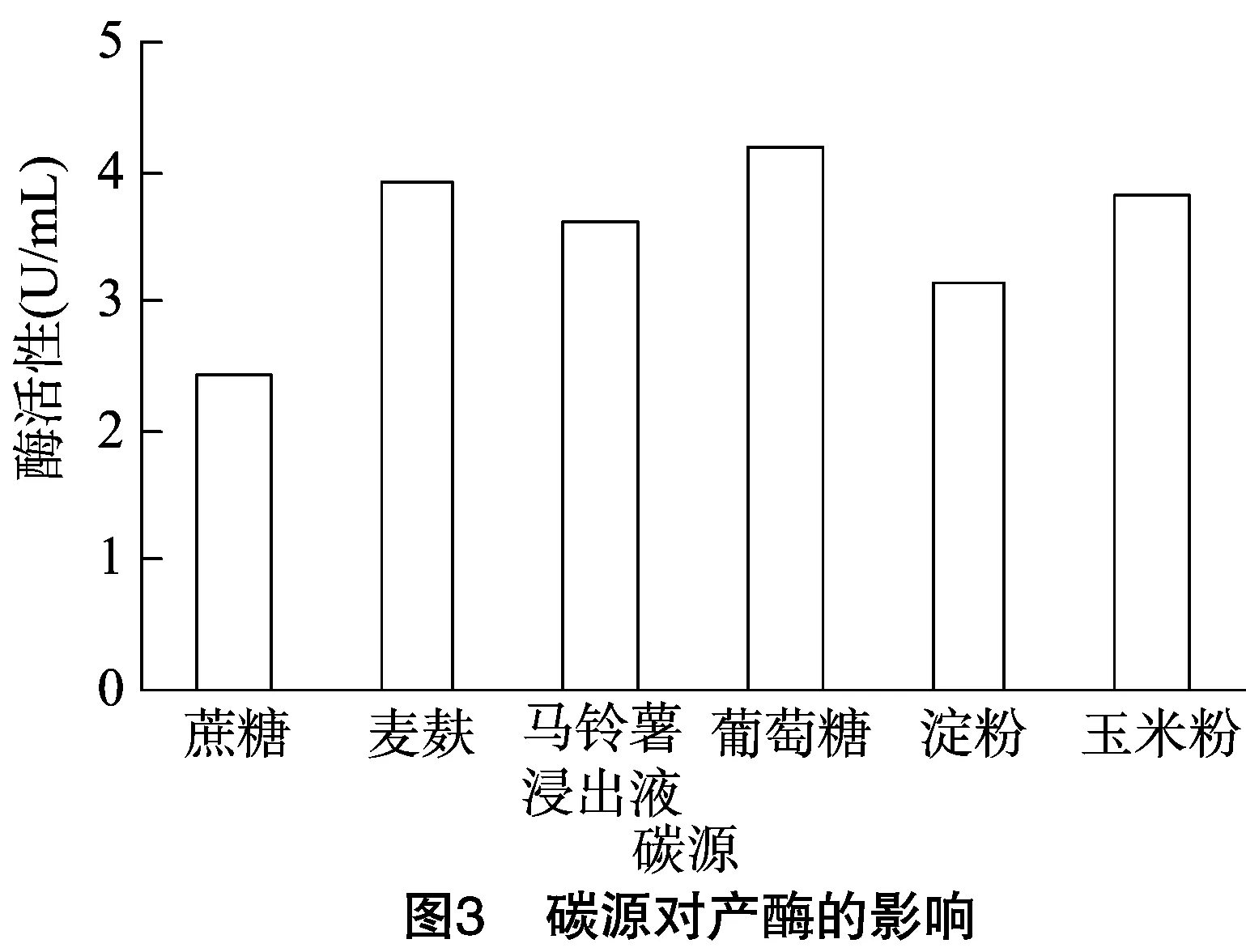
2.3.2 BP01最佳碳源的确定 以葡萄糖、麦麸、蔗糖、马铃薯浸出液、可溶性淀粉(质量浓度为2 g/100 mL)作为唯一碳源,将BP01接种后的三角瓶于32 ℃、160 r/min摇床上培养2 d,对酶活性进行测定。结果发现,BP01是在葡萄糖作为唯一碳源条件下培养,具有最大的酶活性(4.21 U/mL,图3)。因此,葡萄糖为BP01产酶最佳碳源。
将最佳碳源葡萄糖分别设置浓度为10、15、20、30、40 mg/mL 于上述条件下进行摇床培养,测定培养2 d后的Lip活性。结果发现,当葡萄糖的浓度为15 mg/mL时,其酶活性达到最大,为4.49 U/mL(图4)。因此,选择15 mg/mL作为最佳碳源葡萄糖的最适浓度。
2.3.3 BP01最佳氮源的选择 以牛肉膏、蛋白胨、硫酸铵、硝酸铵、酵母粉、尿素作为产酶发酵培养基中的唯一氮源,氮源的质量浓度为1 g/L;碳源选择15 g/L葡萄糖将接种 BP01 的三角烧瓶于32 ℃、160 r/min下摇床培养2 d,对Lip活性进行测定。结果发现,BP01在酵母粉为氮源的条件下培养,酶活性最大时为4.32 U/mL(图5)。因此,将酵母粉作为产酶培养的最佳氮源。
将最佳氮源酵母粉分别设置浓度为 0.5、1、2、4、6、8 mg/mL,于上述条件下进行摇床培养2 d,测定Lip的活性。结果发现,当酵母粉浓度为6 mg/mL时,其酶活性最大为5.48 U/mL(图6)。因此选择6 mg/mL作为最佳氮源酵母粉的最佳浓度。

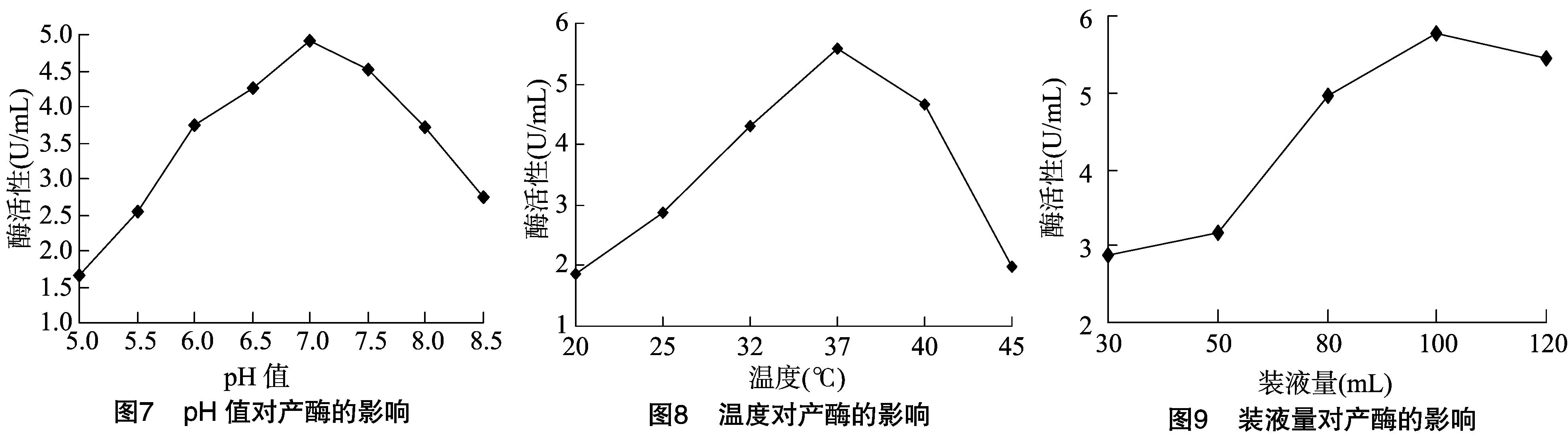
2.3.4 BP01 pH值的选择 将产酶发酵培养基的pH值分别调至5、5.5、6、6.5、7、7.5、8、8.5,加入15 g/L葡萄糖、6 g/L酵母粉,将BP01接种后的三角瓶于32 ℃、160 r/min下摇床培养 2 d,培养基相应成分及浓度使用前面已经优化出来的结果,测定Lip活性。结果发现,当pH值=7时BP01的酶活性最大,为4.93 U/mL(图7)。因此,选择pH值=7作为产酶最佳的pH值,过酸过碱对产酶都有一定的影响。
2.3.5 BP01温度的选择 将恒温摇床的温度分别设置为28、32、37、40、45 ℃,加入15 g/L葡萄糖、6 g/L酵母粉,培养基的pH值调至为7,将BP01接种后的三角瓶于160 r/min下摇床培养 2 d,测定Lip活性。结果发现,当温度为37 ℃时,其酶活性最大,为5.57 U/mL(图8)。因此,选择37 ℃作为最佳的产酶温度。
2.3.6 BP01装液量选择 于250 mL的三角瓶中分别装40、60、80、120 mL液体产酶培养基,加入15 g/L葡萄糖、6 g/L酵母粉,pH值调至7,将BP01接种后的三角瓶置于37 ℃、160 r/min 下进行摇床培养2 d,测定Lip活性。结果发现,当装液量为100 mL时,其酶活性最大(图9)。因此,选择 100 mL 作为产酶的最佳装液量。
2.3.7 BP01综合最佳条件培养 综合前面的优化结果,即在15 g/L葡萄糖、6 g/L酵母粉、pH值=7、37 ℃和装液量为 100 mL 的条件下,将接种BP01后的三角瓶置于160 r/min摇床上进行摇床培养3 d,取部分6 000 r/min离心10 min得到取上清液为粗酶液。测定Mnp活性达到了6.47 U/mL,对于所测的这个酶活性虽然不是在整个试验过程中酶活性最高的数据,但是对于试验之初还是较大的提高,起到了一定的优化作用。
3 结论
从腐木上的子实体筛选出菌株能选择性降解木质素的菌株BP01,通过生理生化鉴定试验及16S rDNA序列分析对菌株进行鉴定试验确定菌株BP01为类芽孢杆菌属。在 BP01 产酶特性研究中,对其产酶条件进行研究及条件优化,经测定,菌株BP01在碳源(葡萄糖)15 g/L、氮源(酵母粉)6 g/L、温度为37 ℃、pH值=7.0、装液量100 mL的条件下培养 72 h,其产过氧化物酶(Lip)活性达到最高,为6.47 U/mL。这将为深入研究木质素的生物降解及其开发利用提供试验依据。
:
[1]宋晓雪. 嗜碱木质素降解菌株筛选鉴定与生长条件优化[D]. 大连:大连理工大学,2013:1-10.
[2]石 倩. 农作物秸秆木质素降解研究现状[J]. 农业科技与装备,2013(3):73-74.
[3]李 轶,刘雨秋,谷士艳,等. 玉米秸秆纤维降解的预处理工艺条件筛选[J]. 沈阳农业大学学报,2013,44(1):99-103.
[4]王 敏. 白腐菌降解木质素研究进展[J]. 衡水学院学报,2011,13(1):51-53.
[5]胡雪竹. 木质素降解酶的研究进展[J]. 安徽农业科学,2011,39(11):6326-6328,6363.
[6]张 宇,许敬亮,李 东,等. 木质素降解菌Ceriporiopsissubvermispora的研究进展[J]. 武汉理工大学学报,2009(10):104-108.
[7]李红亚,李术娜,王树香,等. 产芽孢木质素降解菌MN-8的筛选及其对木质素的降解[J]. 中国农业科学,2014,47(2):324-333.
[8]晋果果,翁海波,李萍萍,等. 高温木质素降解菌GeobacilluscaldoxylosilyticusJ16的筛选及其产酶发酵性质研究[J]. 中国农学通报,2011,27(8):334-339.
[9]姜明国,黎海菲,陆冠颖,等. 木质素降解菌Bax的筛选及特性研究[J]. 生物技术通报,2011(3):200-203.
[10]王茂成. 木质素降解真菌的筛选鉴定及相关酶活性研究[D]. 重庆:西南大学,2013:1-9.
[11]Ming T,Kirk T K. Lignin peroxidase of Phanerochaete chrysosporium[J]. Methods in Enzymology,1988,161(1):238-249.
[12]谢 君,任 路,李 维,等. 白腐菌液体培养产木质纤维索降解酶的研究[J]. 四川大学学报(自然科学版),2000,37(期缺失):161-166.
[13]崔艳红,张海棠,孟庆辉,等. 白腐真菌产木质素降解酶的条件及酶学性质的研究[J]. 吉林农业科学,2008,33(2):43-47.
[14]陈 坚,刘 和,李秀芬. 环境微生物实验技术[M]. 北京:化学工业出版社,2008:19-59.
[15]黎满香,林荣高,薛立群,等. 湖南猪源粪肠球菌的分离鉴定及16S rDNA系统进化分析[J]. 中国兽医学报,2011,31(9):1290-1294.
[16]Rainey F A,Wardrainey N,Kroppenstedt R M,et al. The genusNocardiopsisrepresents a phylogenetically coherent taxon and a distinct actinomycete lineage:proposal of Nocardiopsaceae fam nov[J]. International Journal of Systematic Bacteriology,1996,46(4):1088-1092.
[17]Tamura K,Stecher G,Peterson D,et al. MEGA6:molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution,2013,30(12):2725-2729.
[18]杨苏声. 细菌分类学[M]. 北京:中国农业出版社,1997:1-7.
