黄芪茎总黄酮的纯化工艺及抗氧化性研究
2018-05-30韩运华
韩运华, 石 磊
(1.吉林化工学院,吉林吉林 132022; 2.吉林石化公司有机合成厂,吉林吉林 132021)
黄芪是应用非常广泛的药食两用传统中药材,为豆科植物膜荚黄芪[Astragalusmembranaceus(Fisch.) Bunge]和蒙古黄芪[A.membranaceus(Fisch.) Bunge var.mongholicus(Bunge) Hsiao]的干燥根[1],东北是黄芪的主产区之一。黄芪的传统应用部位是根部,黄芪根主要用于气虚乏力、内热消渴、表虚自汗等病症的治疗[2],关于黄芪根的药理活性及化学成分的研究已有较多文献资料[3-5]。黄芪黄酮是黄芪根中的一类重要活性成分,具有调节免疫、清除自由基、抗突变等多种生理活性,主要含有毛蕊异黄酮及苷、芒柄花素、芒柄花苷等活性成分[6-8]。文献资料表明多种天然黄酮类化合物均具有较好的抗氧化性能、增强人体免疫力、抗衰老等多种生理作用[9-13]。目前,我国主要利用黄芪的根部,大部分黄芪的地上部分即黄芪茎叶被作为废物丢弃,未被有效利用,使黄芪这一天然资源严重浪费,而黄芪茎中含有许多黄酮类化合物,而黄芪总黄酮是黄芪抗氧化、清除自由基的主要活性成分[14-15],而在很多人类疾病病原体中自由基起着重要的作用[16],人体内如果有大量自由基的生成会引起癌症、糖尿病等众多疾病[17-19],会加快人体的衰老过程[20],所以引起了人们对黄芪茎的研究兴趣,目前市场上已经出现了添加黄芪茎粉的畜禽饲料,饲料中添加黄芪茎粉后,对鸡、兔具有明显的促生长作用和增强免疫能力,能够提高畜禽的生产性能和重大疾患的防治[21]。大孔吸附树脂是一种具有多孔性、比表面积大的高分子吸附剂,已广泛应用于天然植物中黄酮类化合物的富集、纯化[22-23]。本试验针对黄芪茎总黄酮的大孔树脂纯化工艺开展试验研究,达到减少资源浪费,提高农民收益的目的,为黄芪茎的综合利用提供依据。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂 黄芪茎购于吉林省均林中草药种植有限公司;芸香苷对照品(供含量测定用,中国食品药品检定研究院);大孔吸附树脂(ADS-17、XDA-8、LSA-21、LSA-10、AB-8、LX-36、D-101、LSA-33型,西安蓝晓科技新材料股份有限公司);DPPH·(分析纯,上海如吉生物科技有限公司);对氨基苯磺酸(分析纯,天津市科密欧化学试剂有限公司);2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、盐酸萘乙二胺(分析纯,天津市化学试剂研究所有限公司);过硫酸钾、维生素C(分析纯,天津市永大化学试剂有限公司);其他试剂均为市售分析纯化学试剂;水为重蒸馏水。
1.1.2 仪器与设备 TU-1810型紫外-可见分光光度计(北京普析通用仪器有限责任公司);RE-52C型旋转蒸发仪(上海亚荣生化仪器厂);SHA-B型水浴恒温振荡器(金坛市科析仪器有限公司);SHB-ⅢA型循环水式多用真空泵(郑州长城科工贸有限公司);XMTD-8222型电热鼓风干燥箱(上海精密实验设备有限公司)。
1.2 数据分析
试验数据均为3次重复,取平均值,数据分析采用Origin 6.0软件。
2 结果与分析
2.1 标准曲线的绘制及样品含量测定
参照文献[17]绘制芸香苷标准曲线[24]。称取干燥至恒质量的芸香苷9.5 mg,精确称定,置50 mL容量瓶中,加60%乙醇溶解,定容,摇匀,配制成质量浓度为 0.188 9 mg/mL 的对照品溶液,备用。精确吸取芸香苷对照品溶液0.5、1.0、2.0、3.0、4.0、5.0 mL,置于25 mL容量瓶中,加入0.1 mol/L 的AlCl3溶液5.0 mL,醋酸-醋酸钠缓冲溶液2.5 mL,60%乙醇定容。40 ℃水浴反应15 min,冷至室温,以相应的显色剂溶液为空白,按照紫外可见分光光度法,在406 nm处测定其吸光度。以芸香苷对照品溶液的吸光度为纵坐标,其质量浓度(mg/mL)为横坐标,绘制标准曲线,回归方程:D=27.16C-0.001 1,r=0.999 4。结果表明芸香苷进样质量浓度在0.003 778~0.037 78 mg/mL范围内呈良好线性关系。
精确吸取黄芪茎提取液、大孔树脂吸附后的溶液和解吸液各适量,分别置于25 mL容量瓶中。按上述方法在406 nm处测定上述溶液的吸光度,计算树脂对黄芪茎总黄酮的比吸附量、吸附率及比解吸量、解吸率和浸膏中总黄酮的含量[25]。计算公式如下:
比吸附量(mg/g)=(C0×V0-C1×V1)/m0;
吸附率=[(C0×V0-C1×V1)/(C0×V0)]×100%;
比解吸量(mg/g)=(V2×C2)/m0;
解吸率={(V2×C2)/[(C0×V0-C1×V1)]}×100%;
干浸膏总黄酮含量=(m2/m1)×100%。
式中:C0为黄芪茎提取液总黄酮质量浓度,mg/mL;C1为大孔树脂吸附后溶液总黄酮质量浓度,mg/mL;C2为解吸液中黄芪茎总黄酮质量浓度,mg/mL;V0为黄芪茎提取液体积,mL;V1为吸附后溶液体积,mL;V2为解吸液体积,mL;m0为树脂的称样量,g;m1为解吸液干燥后固体的称样量,mg;m2为解吸液中总黄酮的测定量,mg。
2.2 大孔吸附树脂的预处理
称取LSA-21、ADS-17、LX-36、XDA-8、LSA-10、AB-8、D-101、LSA-33等各种型号的大孔吸附树脂适量,分别加入到玻璃柱中,参照文献[26]进行预处理,密封备用[26]。
2.3 黄芪茎提取液的制备
称取粉碎的黄芪茎30 g,按料液比1 ∶10(g ∶mL)加入70%乙醇水溶液,回流提取2次,每次2 h,过滤,滤液减压浓缩至相对密度1.18~1.22(60 ℃)的稠膏,加蒸馏水定容至250 mL容量瓶中,备用。
2.4 大孔吸附树脂的筛选
2.4.1 静态吸附与解吸试验 称取8种已预处理好的湿树脂各2 g,分别置于具塞锥形瓶中,随后分别加入黄芪茎提取液30 mL,在水浴恒温振荡器中25 ℃振荡2 h,静置48 h,过滤,将过滤后的不同树脂分别置于具塞锥形瓶中,各加入80%乙醇水溶液50 mL,在水浴恒温振荡器中25 ℃振荡2 h,静置48 h,过滤。分别吸取各树脂吸附后的溶液、解吸液各适量,分别加入至25 mL容量瓶中,按“1.3.1”节方法在406 nm处测定上述各溶液的吸光度,计算各树脂对黄芪茎总黄酮的比吸附量、吸附率、比解吸量、解吸率[27]。结果(表1)表明,吸附率与解吸率的乘积大于85%的树脂有3种,分别为 LSA-21、AB-8、D-101,因此选择上述3种树脂进行后续试验,进一步选择更加合适的树脂。
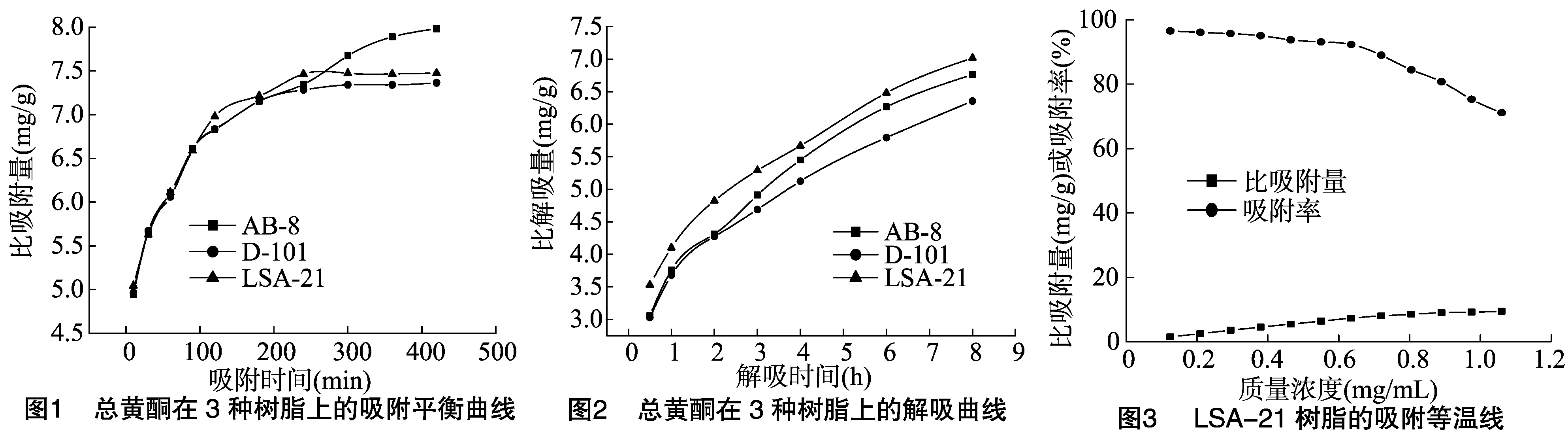
2.4.2 静态平衡吸附特征试验 称取“2.4.1”节试验中筛选出的对黄芪茎总黄酮比吸附量、 比解吸量较好的3种树脂(AB-8、D-101、LSA-21)各4 g于100 mL锥形瓶中,加入50 mL总黄酮质量浓度为0.640 5 mg/mL的黄芪茎提取液,在水浴恒温振荡器中25 ℃振荡,分别于10、30、60、90、120、180、240、300、360、420 min取样测定上清液的总黄酮质量浓度,计算树脂的比吸附量。然后向吸附420 min的树脂中加入50 mL的80%乙醇水溶液,在水浴恒温振荡器中25 ℃振荡0.5、1、2、3、4、6、8 h,吸取解吸液适量,测定解吸液的总黄酮质量浓度,计算树脂的比解吸量[28]。分别以3种树脂(LSA-21、AB-8、D-101)的比吸附量、比解吸量为纵坐标,以吸附时间、解吸时间为横坐标绘制各树脂的静态吸附动力学曲线,结果见图1、图2。
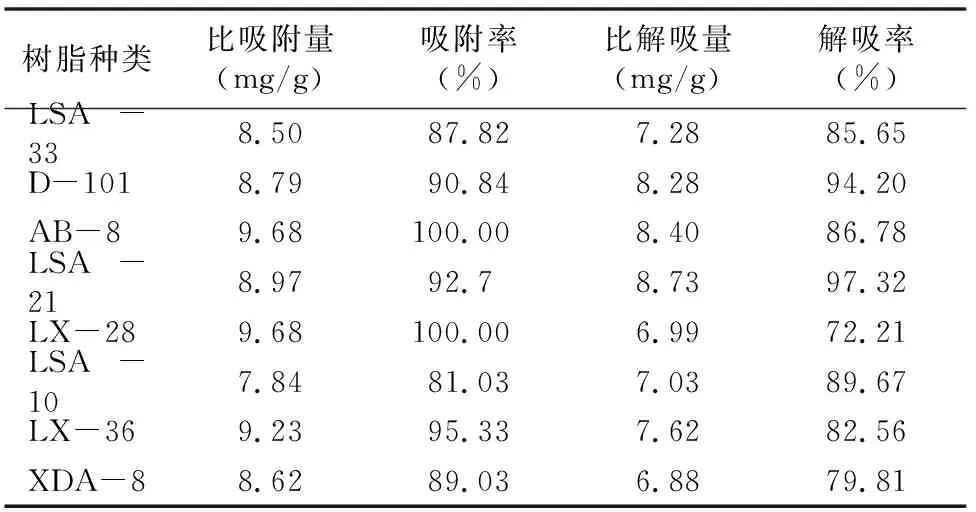
表1 大孔树脂的选择试验结果
由图1可知,AB-8型树脂对黄芪茎总黄酮的比吸附量、吸附率随着吸附时间的延长逐渐升高,在吸附时间为6 h时比吸附量为7.888 mg/g、吸附率为98.51%,LSA-21、D-101型2种树脂对黄芪茎总黄酮的比吸附量、吸附率在0~4 h内均随着吸附时间的延长而增加,4 h后都基本达到吸附平衡,D-101型树脂对黄芪茎总黄酮的比吸附量、吸附率分别为7.283 mg/g、90.95%,LSA-21型树脂对黄芪茎总黄酮的比吸附量、吸附率分别为7.465 mg/g、93.23%,吸附效果依次为AB-8>LSA-21>D-101。对吸附7 h的3种树脂进行解吸,结果见图2,由图2可知,3种树脂对黄芪茎总黄酮的解吸性能存在一定差异,在0~8 h内,3种树脂对黄芪茎总黄酮的比解吸量及解吸率均随着解吸时间的延长而逐渐增加。当解吸时间为8 h时,LSA-21、D-101、AB-8型树脂的比解吸量及解吸率分别为7.017 mg/g、6.355 mg/g、6.762 mg/g,93.89%、86.31%、84.72%。因此综合权衡上述吸附与解吸的各项数据,LSA-21型树脂在这3种树脂中具有比解吸量大、解吸率高等优点,是本试验中最合适纯化黄芪茎总黄酮的树脂。
2.5 树脂的吸附试验
2.5.1 LSA-21型大孔吸附树脂的吸附等温线 称取12份LSA-21型大孔吸附树脂,每份4 g,分别置于100 mL锥形瓶中,各加入50 mL总黄酮质量浓度不同的黄芪茎提取液,在水浴恒温振荡器中25 ℃振荡24 h,吸取上清液适量,测定其总黄酮质量浓度,计算树脂的比吸附量、吸附率[28]。以 LSA-21树脂的比吸附量及吸附率为纵坐标,黄芪茎总黄酮的质量浓度为横坐标绘制吸附等温线,结果见图3。由图3可知,随着黄芪茎总黄酮的质量浓度的增加,比吸附量逐渐增加,但吸附率却逐渐降低, 当黄芪茎总黄酮的质量浓度>0.635 mg/mL 时,比吸附量增加幅度较小,但吸附率的下降幅度增大,因为上样总黄酮的质量浓度太低,树脂的比吸附量较小,不能完全发挥树脂的作用,使树脂严重浪费且生产效率低下,而当总黄酮的质量浓度达到一定程度后,树脂的比吸附量虽然持续增加,但增加趋势减缓,而且吸附率下降幅度增大,所以总黄酮的质量浓度太高,会造成样液的浪费。综合考虑LSA-21树脂吸附黄芪茎总黄酮最大有效上样液的质量浓度为0.635 mg/mL左右,即生药浓度为0.12 g/mL。
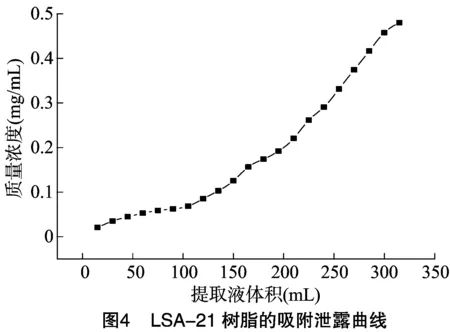
2.5.2 LSA-21型大孔吸附树脂的泄漏曲线 称取LSA-21型大孔吸附树脂15 g,湿法装柱,加入315 mL总黄酮质量浓度为0.639 1 mg/mL的黄芪茎提取液,以1.0 mL/min的流速进行动态吸附,收集流出液,每15 mL为1个流份,共21个,测定每个流份的总黄酮质量浓度。以流份体积为横坐标,总黄酮质量浓度为纵坐标绘制泄漏曲线[29]。以流份的体积为横坐标,流份中的总黄酮质量浓度为纵坐标绘制泄漏曲线,结果见图4。由图4可知,随着黄芪茎提取液上样体积的增加,流出液中的总黄酮质量浓度也逐渐增加,吸附率逐渐降低,当流出液收集到第7个流份(105 mL)的时候,流出液中的总黄酮质量浓度已超过黄芪茎提取液总黄酮质量浓度的10%,而且吸附率下降幅度增大,结果表明此时已达到泄漏点,建议本试验中黄芪茎提取液的上样体积与树脂质量之比(mL ∶g)为7 ∶1,即生药量/树脂(g/g)为0.84。
2.5.3 上样吸附流速的影响 吸取6份总黄酮质量浓度为0.643 0 mg/mL的黄芪茎提取液,每份105 mL,分别加入到6根15 g的树脂柱中,分别以0.5、1.0、1.5、2.0、2.5、3.0 mL/min 的流速进行吸附,收集流出液,记录体积,计算比吸附量、吸附率。由表2可知上样液的吸附流速对树脂的比吸附量、吸附率有影响,随着吸附流速的加快,比吸附量、吸附率均逐渐越低,在吸附速率为0.5~1.5 mL/min 范围内,比吸附量、吸附率变化不明显,吸附流速越慢耗费的时间也就越长,生产周期就越长,为了既保持理想的比吸附量、吸附率又尽量缩短吸附时间,综合考虑将上样液吸附流速确定为1.5 mL/min。
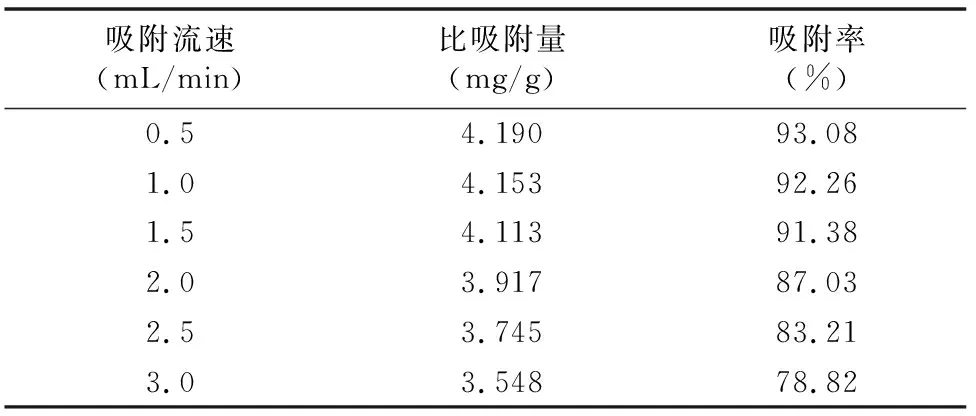
表2 上样吸附流速的试验数据
2.5.4 黄芪茎提取液pH值的影响 吸取7份总黄酮质量浓度为0.635 7 mg/mL的黄芪茎提取液,每份105 mL,分别调pH值为2.0、3.0、4.0、5.0、6.0、7.0、8.0,然后加入到7根15 g的树脂柱中,以1.0~1.5 mL/min的流速进行吸附,收集流出液,记录体积,计算比吸附量、吸附率。由表3可知,黄芪茎提取液pH值在2~6范围内,随着pH值的升高,树脂的比吸附量、吸附率缓慢降低,变化相对较小,而当pH值大于6之后,随着pH值的继续升高,树脂的比吸附量、吸附率明显降低,变化较大。可能因为黄芪茎提取液中的黄酮类物质属于弱酸性化合物,酸性化合物在酸性溶液中易吸附,所以在pH值在2~6范围内吸附效果比较理想,而提取液的pH值为5.5~6,所以样品液pH值不需调节,后续试验直接以初始提取液进行。
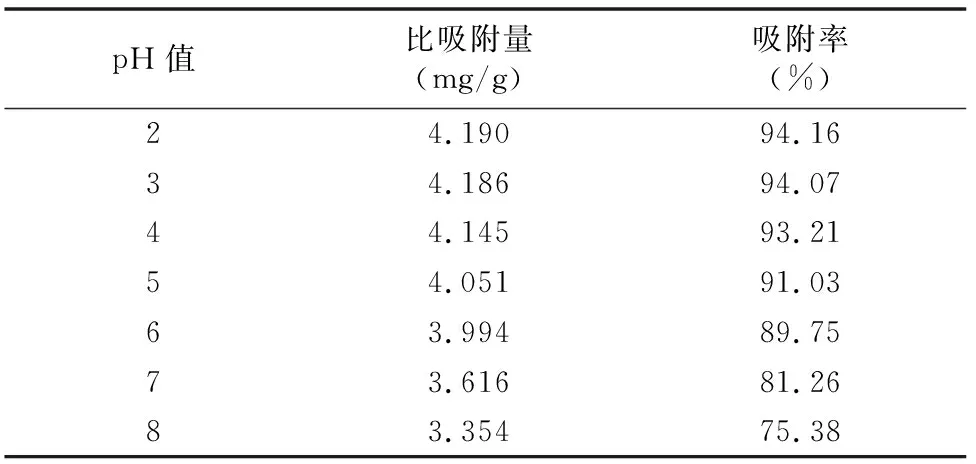
表3 黄芪茎提取液pH值的试验数据
2.6 树脂的解吸试验
2.6.1 解吸液乙醇体积分数的影响 吸取6份总黄酮质量浓度为0.638 1 mg/mL的黄芪茎提取液,每份105 mL,分别加入到6根15 g的树脂柱中,控制吸附流速为1.0~1.5 mL/min 进行吸附,收集流出液,记录体积,计算比吸附量、吸附率。然后分别用0%、10%、30%、50%、70%、90%乙醇水溶液50 mL进行解吸,计算比解吸量、解吸率。试验结果(表4)表明,随着乙醇体积分数的增加,树脂的比解吸量、解吸率呈现先逐渐升高的趋势,当乙醇体积分数为90%时,比解吸量、解吸率最大,达到2.583 mg/g、64.69%。可能是由于黄芪茎中的黄酮类成分水溶性较小、而脂溶性较大,所以出现了随着乙醇体积分数的升高,树脂的比解吸量、解吸率逐渐升高的现象。
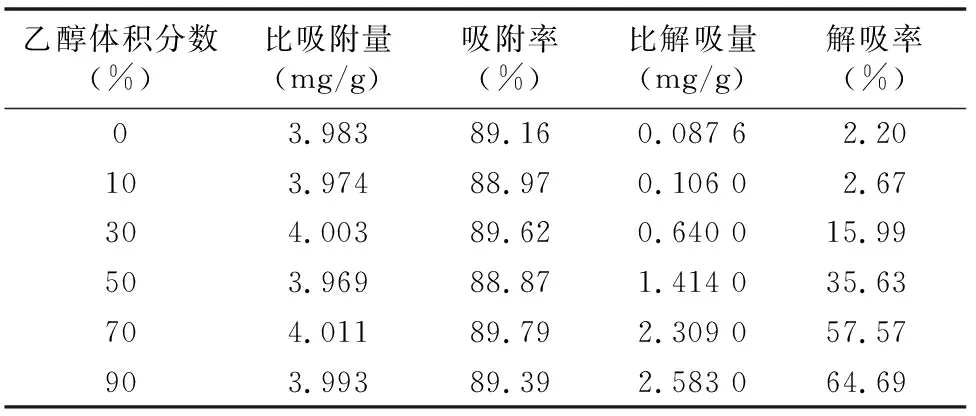
表4 乙醇体积分数的试验数据
2.6.2 解吸液解吸流速的影响 吸取6份总黄酮质量浓度为0.645 2 mg/mL的黄芪茎提取液,每份105 mL,分别加入到6根15 g的树脂柱中,按“2.5.4”节方法进行吸附,计算比吸附量、吸附率。然后用90%乙醇水溶液分别以0.5、1.0、1.5、2.0、2.5、3.0 mL/min的流速进行解吸,计算比解吸量、解吸率。由表5可知,随着解吸流速的增加,树脂的比解吸量、解吸率逐渐降低。因为解吸流速过快,解吸性能较差,解吸不完全。但是解吸流速过慢,解吸耗费的时间也就越长,则会使生产周期延长,增加生产成本。而本次试验结果表明解吸流速在0.5~1.0 mL/min范围内时总黄酮的比解吸量、解吸率变化不大,但当解吸流速 >1.0 mL/min 时总黄酮的比解吸量、解吸率明显下降。所以将解吸流速确定为 1.0 mL/min,既能使树脂的比解吸量、解吸率比较理想,又尽量缩短了生产周期。
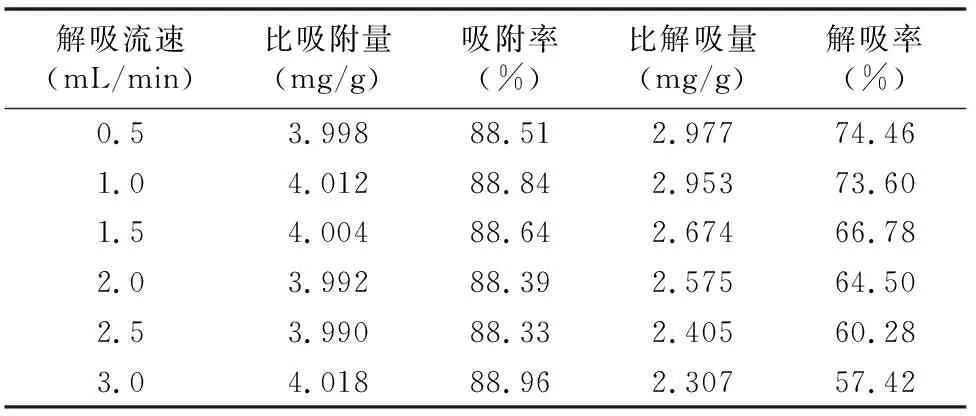
表5 解吸流速的试验数据
2.6.3 解吸液pH值的影响 吸取6份总黄酮质量浓度为0.647 3 mg/mL的黄芪茎提取液,每份105 mL,分别加入到6根15 g的树脂柱中,按“2.5.4”节方法进行吸附,计算比吸附量、吸附率。然后分别用pH值为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0的90%乙醇水溶液以1.0 mL/min的流速进行解吸,计算比解吸量、解吸率。由表6可知,随着解吸液pH值的升高,树脂的比解吸量及解吸率逐渐增大,当pH值大于8之后,随着pH值的继续升高,树脂的比解吸量及解吸率变化较小。可能因为黄芪茎提取液中的黄酮类物质属于弱酸性化合物,所以更容易被碱性的解吸液洗脱。所以将解吸液调至pH值为8,以获得较高的比解吸量及解吸率。
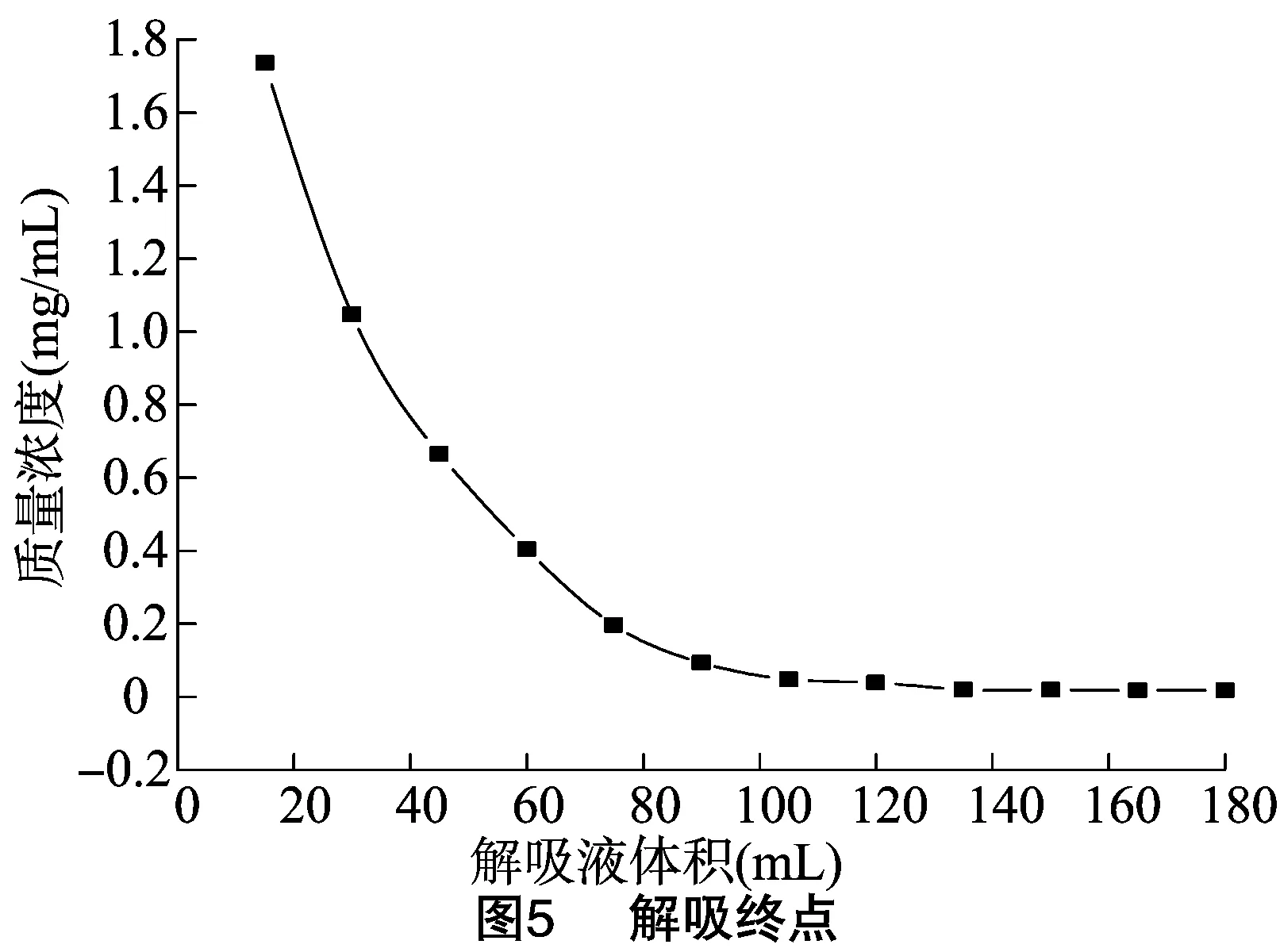
2.6.4 解吸终点的考察 吸取总黄酮质量浓度为 0.637 7 mg/mL 的黄芪茎提取液105 mL,加入到15 g的树脂柱中,按“2.5.4”节方法进行吸附,计算比吸附量、吸附率。然后用90%乙醇水溶液以1.0mL/min的流速进行解吸,每15 mL为1个流份,共收集12个流份,测定每份解吸液中总黄酮的质量浓度,以解吸液中总黄酮质量浓度为纵坐标,解吸液体积为横坐标作图,确定解吸终点。在该项试验中,黄芪茎总黄酮的比吸附量为4.013 mg/g、吸附率为89.90%。以解吸液体积为横坐标,以每份解吸液中总黄酮的质量浓度为纵坐标绘制趋势图,结果见图5。由图5可知随着解吸液体积的增加,解吸液中的总黄酮质量浓度逐渐降低,当收集到第5个流份时,比解吸量、解吸率分别为4.049 mg/g、90.70%,当收集到第8个流份时,比解吸量、解吸率分别为4.229 mg/g、94.74%,而且第8个流份以后解吸液中总黄酮质量浓度变化较小。考虑到解吸液体积越大生产成本也就越高,综合考虑建议本试验中解吸终点为75 mL,即解吸液体积与树脂质量之比(mL ∶g)为5 ∶1。
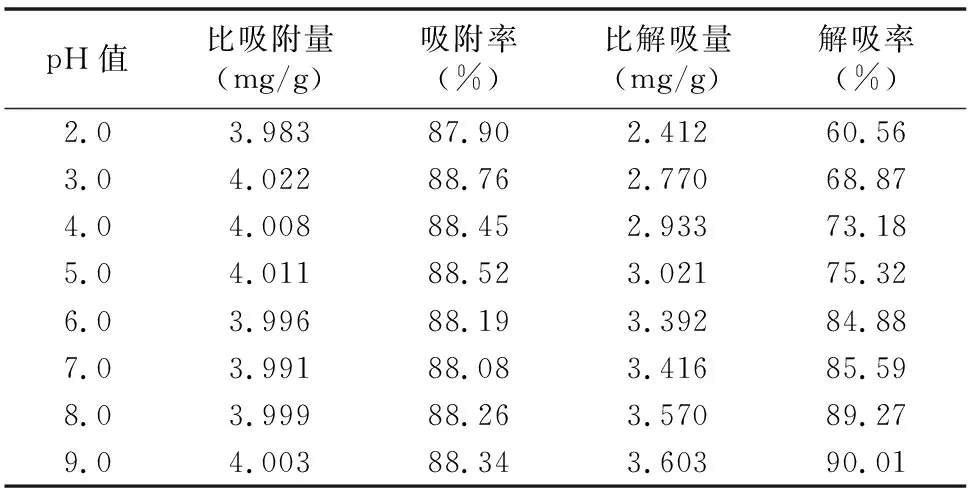
表6 解吸液pH值的试验数据
2.7 工艺稳定性验证试验及黄芪茎脱脂对纯化的影响
称取3份已预处理的LSA-21型树脂各30 g,湿法装柱,分别加入黄芪茎提取液210 mL,按“2.5.4”节方法进行吸附,计算比吸附量、吸附率。然后用3.41 BV的pH值为8.0的90%乙醇水溶液以1.0 mL/min的流速进行解吸。分别吸取90 mL黄芪茎提取液、解吸液,水浴浓缩,放入干燥箱中于 60 ℃ 干燥至恒质量。称取干燥至恒质量的黄芪茎干浸膏0.16 g,精确称定,加60%乙醇20 mL,超声溶解,过滤,滤液置于50 mL容量瓶中,加60%乙醇定容,作为供试品溶液,备用。吸取供试品溶液适量于25 mL容量瓶中,按“2.1”节含量测定方法测定干浸膏中总黄酮的质量。
称取粉碎的黄芪茎适量,加入到圆底烧瓶中,按料液比(g ∶mL)1 ∶5加入石油醚(60~90 ℃),水浴加热回流2次,每次1 h,过滤,将脱脂后的黄芪茎放于干燥箱中于60 ℃烘干。称取脱脂后的干燥黄芪茎,按“2.3”节方法制备黄芪茎提取液,然后按照最佳工艺条件进行吸附-解吸,分别计算比吸附量、吸附率、比解吸量、解吸率及黄芪茎干浸膏中总黄酮的质量。
由表7可知,经LSA-21型大孔吸附树脂处理黄芪茎提取液后,黄芪茎总黄酮的比吸附量平均为4.012 mg/g、吸附率平均为88.77%,比解吸量平均为3.645 mg/g、解吸率平均为0.85%。干浸膏中总黄酮含量由4.82%提高到11.04%,总黄酮的富集倍数为2.29倍。由表7数据同时可知,将黄芪茎用石油醚脱脂后,可以使树脂对黄芪茎总黄酮的比吸附量、比解吸量及干浸膏中总黄酮含量略有提高,但吸附率及解吸率没有变化。其中干浸膏中总黄酮含量由平均11.04%提高到12.81%。可能因为用石油醚脱脂处理后,除去了黄芪茎中的叶绿素等脂溶性物质,结果使提取液中的总黄酮质量浓度有所提高,从而使干浸膏中总黄酮含量略有提高。
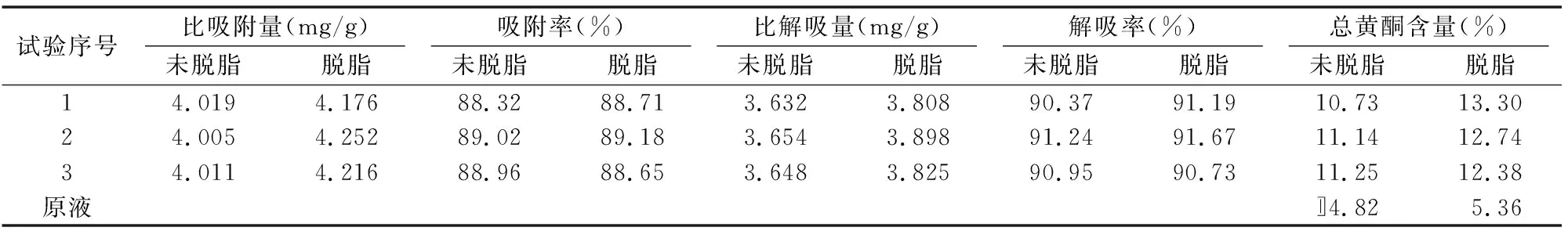
表7 工艺验证试验结果
2.8 乙酸乙酯萃取试验
将“2.7”节所得的黄芪茎干浸膏混合,测定其总黄酮的含量,然后用已经干燥过的滤纸包好,将滤纸包放在索氏抽提器内,按料液比1 ∶40(g ∶mL)加入乙酸乙酯,回流抽提4 h,水浴浓缩回收乙酸乙酯,稠膏放入干燥箱中于60 ℃干燥至恒质量,然后按“2.7”节方法测定,计算乙酸乙酯萃取干浸膏中总黄酮的质量。试验结果表明“2.7”节所得的黄芪茎干浸膏的总黄酮含量为12.05%,经乙酸乙酯萃取后干浸膏中的总黄酮含量提高到24.37%。
2.9 体外抗氧化活性试验
2.9.1 清除ABTS阳离子自由基试验 ABTS阳离子自由基水溶液于734 nm波长处有特征吸收峰,当在其溶液中加入抗氧化剂时,ABTS阳离子自由基被清除,溶液吸光度变小,可以得出供试品对ABTS阳离子自由基的清除效果,该方法常用于表征天然产物体外抗氧化活性。称取干燥的黄芪茎总黄酮(“2.8”节产物)、芸香苷、维生素C适量,以50%乙醇为溶剂,配制成质量浓度分别为0.1、0.2、0.3、0.4、0.5、0.6 mg/mL 的供试品溶液。吸取不同质量浓度的供试品溶液各0.1 mL,分别置于10 mL具塞试管中,按文献[30]操作,在734 nm处测其吸光度D空白、D。按照下式计算黄芪茎总黄酮、芸香苷、维生素C对ABTS阳离子自由基的清除率[30]。
ABTS阳离子自由基清除率=[(D空白-D)/D空白]×100%。
式中:D空白为ABTS自由基阳离子工作液在波长734 nm处的吸光度;D为供试品溶液与ABTS自由基阳离子工作液反应后的吸光度。
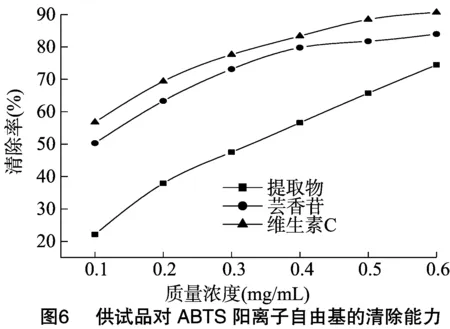
以质量浓度为横坐标,清除率为纵坐标作图,得到各供试品质量浓度与ABTS阳离子自由基清除率的关系,试验结果见图6。由图6可知,随着各供试品质量浓度的增加,对ABTS阳离子自由基的清除率均逐渐升高,维生素C的清除率最高,黄芪茎总黄酮的清除率最低,当质量浓度为 0.6 mg/mL 时,黄芪茎总黄酮、芸香苷、维生素C对ABTS阳离子自由基的清除率分别为74.48%、84.09%、90.07%。
2.9.2 清除亚硝酸盐试验 在一定的条件下,亚硝酸钠与对氨基苯磺酸及盐酸萘乙二胺反应生成的红色络合物在 538 nm 波长处有特征吸收峰。在其他条件相同的情况下,可以通过在538 nm处吸光度的大小反映供试品清除亚硝酸盐能力的高低。吸取“2.9.1”节试验中不同质量浓度的供试品溶液各 1.0 mL, 置于10 mL具塞试管中, 分别加 10 μg/mLNaNO2溶液2.5 mL,在37 ℃恒温水浴中反应30 min,取出后立即加入0.5 mL 0.4%对氨基苯磺酸溶液,混匀,静置15 min后加入0.2%盐酸萘乙二胺溶液0.25 mL,加入蒸馏水7 mL,混匀,静置15 min。50%乙醇作空白,于538 nm波长处测定吸光度Di[31]。其他条件不变,不加供试品溶液,按照上步试验,于538 nm波长处测定吸光度D0。按照下式计算黄芪茎总黄酮、芸香苷、维生素C对亚硝酸盐的清除率:
亚硝酸盐清除率=[(D0-Di+Dj)/D0]×100%。
式中:Di为加入供试品溶液的吸光度;Dj为供试品溶液的本底值;D0为不加供试品溶液的对照值。
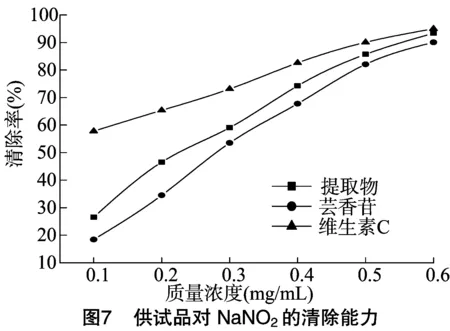
以质量浓度为横坐标、清除率为纵坐标作图,得到各样品质量浓度与亚硝酸钠清除率的关系。由图7可知,随着各供试品质量浓度的升高,对亚硝酸盐的清除率均逐渐上升,当质量浓度达到0.6 mg/mL时黄芪茎总黄酮、芸香苷、维生素C对亚硝酸盐的清除率分别达到93.29%、90.09%、95.03%,其清除能力维生素C>黄芪茎总黄酮>芸香苷,但总体而言三者对亚硝酸盐的清除能力相差不明显。
3 结论与讨论
本试验以总黄酮的比吸附量、吸附率和比解吸量、解吸率为考察指标,对大孔吸附树脂纯化黄芪茎总黄酮的工艺条件进行了探索,比较了ADS-17、XDA-8、LSA-21、LSA-10、AB-8、LX-36、D-101、LSA-33等8种大孔吸附树脂对黄芪茎总黄酮的分离纯化效果,结果表明,LSA-21型大孔吸附树脂比较适合纯化黄芪茎中的黄酮类化合物,它对黄芪茎总黄酮的比吸附量平均为4.012 mg/g、吸附率平均为88.77%,比解吸量平均为3.645 mg/g、解吸率平均为0.85%。通过静态、动态吸附和解吸试验,考察了黄芪茎总黄酮在LSA-21型树脂上的吸附特性,确定LSA-21型树脂纯化黄芪茎总黄酮的工艺条件为:提取液控制其生药浓度为0.12 g/mL;黄芪茎提取液的上样体积与树脂质量之比(mL ∶g)为7 ∶1,即生药量/树脂(g/g)为0.84;吸附流速控制为1.5 mL/min;解吸液为90%乙醇水溶液;解吸流速控制为1.0 mL/min;解吸液pH值为8;解吸液体积与树脂质量之比(mL ∶g)为5 ∶1。在上述纯化工艺条件下,黄芪茎提取液经LSA-21型大孔吸附树脂纯化后,黄芪茎干浸膏中总黄酮含量由4.82%提高到11.04%,总黄酮含量提高了约1.29倍,黄芪茎采用石油醚脱脂后,黄芪茎干浸膏中总黄酮含量可以提高到12.81%,乙酸乙酯萃取后黄芪茎干浸膏中总黄酮含量由12.05%提高到24.37%。体外抗氧化活性的试验结果表明:黄芪茎总黄酮对亚硝酸盐、ABTS阳离子自由基均具有清除活性,而且均随着其质量浓度的增加,清除活性均明显增强。上述试验结果为黄芪茎总黄酮在食品、饮料、制药等领域的应用提供了工作基础。
:
[1]杨金泉,何海波. 黄芪的药理作用研究进展[J]. 医学理论与实践,2010,23(2):148-150.
[2]王 平,梁逸曾. HPLC-DAD-MS研究黄芪的化学成分[J]. 中草药,2011,42(2):226-229.
[3]邱勇波,刘 锦,武 飞. 黄芪化学成分及药理作用研究进展[J]. 中国疗养医学,2011,20(5):435-436.
[4]高 蔷,高文远,满淑丽. 黄芪中有效成分药理活性的研究进展[J]. 中国中药杂志,2012,37(21):3203-3205.
[5]仝 欣. 黄芪主要活性成分的药理作用[J]. 时珍国医国药,2011,22(5):1246-1249.
[6]陈建真,吕圭源,叶 磊,等. 黄芪黄酮的化学成分与药理作用研究进展[J]. 医药导报,2009,28(10):1314-1316.
[7]刘小花,崔 芳,张梦婷,等. HPLC法同时测定黄芪中的5种黄酮类成分的含量——一种新的应用于药学实验分析方法[J]. 实验技术与管理,2016,33(2):24-27.
[8]王 波,周 围,刘小花,等. 基于超高效合相色谱对黄芪中5种主要黄酮类化合物的快速检测[J]. 分析化学,2016,44(5):731-739.
[9]Itidel C,Chokri M,Mohamed B,et al.Antioxidant activity,total phenolic and flavonoid content variation among Tunisian natural populations ofRhustripartita(Ucria) Grande andRhuspentaphyllaDesf.[J]. Industrial Crops and Products,2013,51:171-177.
[10]Saint T,Thitima L,Nuanchawee W,et al.Eriosemachinense:a rich source of antimicrobial and antioxidant flavonoids[J]. Phytochemistry,2013,96(12):353-359.
[11]Xu Q,Shen Y Y,Wang H F,et al. Application of response surface methodology to optimise extraction of flavonoids from fructus sophorae[J]. Food Chemistry,2013.138(4):2122-2129.
[12]冯欣欣,于文会,柏慧敏,等. 沙棘黄酮抗衰老作用及对大鼠非特异性免疫功能的影响研究[J]. 中兽医医药杂志,2015,34(5):5-9.
[13]刘军海,李志洲,王俊宏,等. 桂花残渣中总黄酮的提取及抗氧化作用研究[J]. 中国饲料,2015,(10):24-28.
[14]毕志明,余庆涛,李 萍,等. 蒙古黄芪地上部分的黄酮类成分[J]. 中国天然药物,2007,5(4):263-264.
[15]Lin L Z,He X G,Michael L,et al. Liquid chromatogphy-electrospry ionization mass spectrometry study of the flavonoids of the rootsAstragalusmonoholicusandA.membranaceus[J]. J Chromatogr(A),2000,876(1/2):87-95.
[16]SharmaP,Singh R P. Evaluation of antioxidant activity in foods with special reference to TEAC method[J]. American Journal of Food Technology,2013,8(2):83-101.
[17]Rop O,Ercisli S,Mlcek J. Antioxidant and radical scavenging activities in fruits of 6 sea buckthorn (HippophaerhamnoidesL.) cultivars[J]. Turkish Journal of Agriculture and Forestry,2014,38(2):224-232.
[18]Spitaler M M,Graier F.Vascular targets of redox signaling in diabetes mellitus[J]. Diabetologia,2002,45(4):476-494.
[19]Gorogawa S,Kajimoto Y,Umayahara Y.Probucol preserves pancreatic beta-cell function through reduction of oxidative stress in type 2 diabetes[J]. Diabetes Res Clin Pract. 2002,57(1):1-10.
[20]Hu H L,Forsey R J,Blades T J.Antioxidant may contribute in the fight against aging:aninvitromodel[J]. Mech Ageing DeV,2000,121(1/2/3):217-230.
[21]王凤霞,李清艳,张洪德. 黄芪茎叶粉对雏鸡生长性能及免疫器官指数的影响[J]. 中国家禽,2009,31(9):53-54.
[22]杨 喆,万 山,张乔会,等. 大孔树脂纯化山杏核壳总黄酮的工艺优化[J]. 食品科学,2015,36(10):38-42.
[23]陈 晶,李 琪,黄春萍,等. 枇杷花总黄酮、总三萜的大孔树脂制备工艺[J]. 食品科学,2015,36(18):58-63.
[24]王晓林,钟方丽,薛健飞,等. 微波协同酶法提取刺玫叶总黄酮工艺研究[J]. 西北林学院学报,2015,30(4):246.
[25]钟方丽,王晓林,王志敏,等. 大孔吸附树脂法纯化玉竹总黄酮工艺研究[J]. 食品与机械,2013,29(1):131-134.
[26]王晓林,薛健飞,陈 帅,等. 大孔树脂法纯化锦灯笼宿萼总黄酮的工艺[J]. 食品科学,2014,35(14):58-61.
[27]甘芝霖,倪元颖,郭 悦,等. 大孔树脂分离纯化玫瑰果多酚及其抗氧化性[J]. 农业工程学报,2015,31(24):298-304.
[28]王晓林,金龙哲,钟方丽,等. 聚酰胺纯化刺玫果总黄酮的工艺研究[J]. 华中师范大学学报(自然科学版),2017,51(2):189-194.
[29]易海燕,何桂霞,欧阳文,等. 大孔吸附树脂分离纯化藤茶总黄酮的研究[J]. 中草药,2011,42(1):74-77.
[30]卢圣楼,符家珍,刘 红,等. 神秘果叶多酚的超声波提取工艺及其抗氧化能力[J]. 林产化学与工业,2014,34(5):145-151.
[31]李长虹,秦小梅,张璐璐,等. 枇杷核挥发油化学成分及体外抗氧化活性研究[J]. 华中师范大学学报(自然科学版),2014,48(1):58-61.
