应用环磷酰胺构建断奶仔猪免疫抑制模型
2018-05-30钟金凤伍维高吴支要汤小朋
钟金凤, 伍维高, 吴支要, 汤小朋
(1.湖南环境生物职业技术学院,湖南衡阳 421005; 2.湖南农业大学,湖南长沙 410000)
近年来,随着生猪养殖的飞速发展,猪场仔猪的免疫抑制性疾病频频发生。这类疾病致使仔猪群处于免疫抑制状态,不仅导致猪群疫苗免疫接种失败,而且阻碍仔猪正常生长,给生猪生产带来重大经济损失。为进一步研究这类免疫抑制性疾病,构建稳定的仔猪免疫抑制模型模拟生产中免疫低下现象显得尤为关键。
环磷酰胺(cyclophosphamide,简称CTX),全称P-[N,N-双(β-氯乙基)]-1-氧-3-氮-2-磷杂环己烷-P-氧化物,是一种非特异性体液和细胞免疫毒性抑制剂[1],是众多的构建免疫抑制模型的药物之一。因其作用机制复杂,用环磷酰胺构建免疫抑制模型时,没有统一的标准。纵观文献,主要有3种指导方案,第一种是连续多次施药,如冯焱等用0、40、80、160 mg/kg的剂量连续3 d腹腔注射1日龄的雏鸡构建模型[2];Harada等以15 mg/kg的剂量连续 5 d 腹腔内注射的方式构建猪的免疫抑制模型[3]。第二种是间隔多次施药,如Huyan等采用50~200 mg/kg分2次注射,一次在第1天,另一次在第4天[4]。第三种施药方式是单次用药,Derbyshire采用100 mg/kg的剂量对5周龄无特定病原体仔猪腹腔注射构建免疫抑制模型[5]。文献表明采用以上方式均能成功构建免疫抑制模型,但在实际生产中,多次施药颇费人力物力,对动物应激大。如文献所述,单次用药效果理想,建议用单次用药替代多次用药,但未有文献对此问题进行详细研究。为此,本研究以断奶仔猪为研究对象,拟采用等剂量的环磷酰胺单次用药和连续用药方式来观察免疫抑制效果,为构建免疫抑制模型提供理论依据。
1 材料与方法
1.1 试验动物与试剂
于2015年12月在湖南环境生物职业技术学院养殖场进行试验。选取健康、体质量一致的杜×长×大三元杂交仔猪35日龄断奶仔猪40头,随机分为A、B、C、D 4组,A组为对照组;B组环磷酰胺使用剂量为60 mg/kg,连续3 d注射;C组剂量为 90 mg/kg,从试验第2天起,连续2 d注射;D组剂量为 180 mg/kg,试验第3天一次注射完毕。对照组和试验组未注射环磷酰胺时,注射等剂量生理盐水,自由饮水和采食,试验进行21 d。试验所需环磷酰胺为江苏恒瑞医药股份有限公司制造,批号14030525。红细胞裂解液、FITC、PE-Cy5、PE标记的鼠抗羊的CD3、CD4、CD8抗体为eBioscience公司产品。
1.2 试验日粮
基础日粮参照NRC[6]仔猪营养需要配制成粉料,其具体配方及营养水平见表1。

表1 基础日粮配方及营养水平(风干基础,%)
注:预混料为1 kg全价料提供:维生素A 2 200 IU,维生素D3200 IU,维生素E 16 mg,维生素K 1 mg,胆碱200 mg,泛酸6 mg,维生素B22 mg,叶酸0.3 mg,烟酸25 mg,维生素B11.6 mg,维生素B66 mg,生物素0.08 mg,维生素B120.01 mg,Cu 6 mg,Fe 100 mg,Zn 100 mg,Mn 20 mg,I 0.14 mg,Se 0.3 mg。消化能根据原料组成计算所得,其余为实测值。
1.3 饲养管理
试验仔猪采用群饲,饲喂干粉料,3次/d,时间为 08:00、14:00、18:00,每次以吃饱略剩料为宜,自由饮水。其他饲养管理和免疫程序按常规进行。
1.4 生长性能的测定
分别于试验开始和结束当天的清晨进行空腹称质量,计算平均日增质量;平均日采食量及料质量比;记录腹泻情况(每日在10:00和18:00观察2次猪粪便情况,每次30 min,以粪便黏不成形和含水量≥70%视为腹泻)。
1.5 白细胞和淋巴细胞计数
环磷酰胺注射完毕后的7、14、21 d,于清晨用EDTA无菌真空采血管从仔猪前腔静脉采血2 mL,采用血细胞分析仪进行血细胞检测。
1.6 流式细胞术测定淋巴细胞
100 μL EDTA抗凝血全血加入10 μL单克隆抗体(FITC-CD3,PE-Cy5-CD4,PE-CD8),室温下避光孵育20 min,加入红细胞裂解液10 min后,于1 500 r/min速度下离心 5 min 后弃上清,加入1 mL磷酸缓冲液后离心,弃上清,细胞重悬于含有1%多聚甲醛的磷酸缓冲液中,用流式细胞仪计数。用标准的滤波器组合在488 nm波长的氩离子激光照射细胞,每个样品共计10 000个淋巴细胞。
1.7 数据处理与分析
利用SPSS 16.0统计软件中的One-Way ANOVA程序进行方差分析,用Duncan’s法进行多重比较。试验结果采用“平均值±标准误”表示。
2 结果与分析
2.1 生长情况的一般观察
注射环磷酰胺的仔猪(B、C、D组)表现出嗜睡、乏力、不愿活动、被毛竖立、无光泽,且在注射药物后第2~4天均有此类表现,第5~7天症状加重,第8~10天最为明显,然后逐渐变好,至无异常表现。试验组出现不同程度的腹泻,其中B组有2头仔猪因水样便出现脱水,继发感染伴高温,分别于试验进行14 d死亡,其余仔猪腹泻自愈。
2.2 环磷酰胺对仔猪生长性能的影响
环磷酰胺对断奶仔猪生长性能的影响见表2。B、C、D组的第21天体质量、平均日增质量、料质量比显著低于对照A组(P<0.05),B、C、D组间差异不显著(P>0.05)。平均日采食量各组间差异不显著(P<0.05)。
2.3 环磷酰胺对仔猪外周血白细胞数量的影响
环磷酰胺对仔猪外周血白细胞数量的影响,见表3。试验B、C、D组7 d时的白细胞显著低于对照A组(P<0.05),B组显著低于C组、D组(P<0.05)。14 d时,B组、D组显著低于A组、C组,B组、D组间无差异(P>0.05)。21 d时,各组间无差异(P>0.05)。
2.4 环磷酰胺对仔猪外周血淋巴细胞数量的影响
环磷酰胺对仔猪外周血淋巴细胞数量的影响,见表4。7 d 时,B、C、D组显著低于A组(P<0.05),B组又显著低于C组、D组(P<0.05);14 d时,A组、B组、D组显著低于C组(P<0.05),A组、B组、D组间差异不显著(P>0.05);21 d时,A组、B组、C组显著高于D组(P<0.05),A组、B组、C组间差异不显著(P>0.05)。
2.5 环磷酰胺对仔猪外周血淋巴细胞亚群的影响
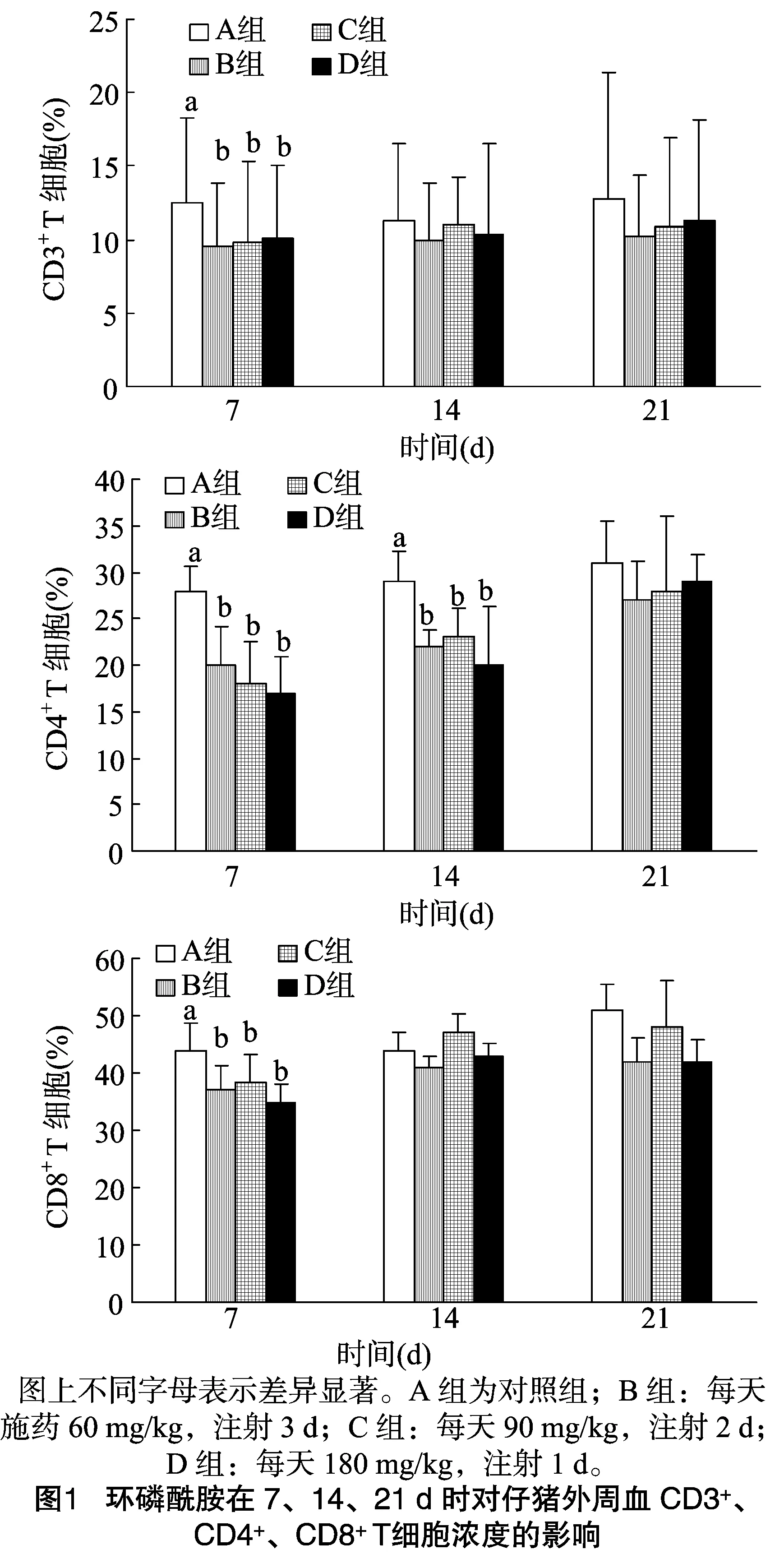
环磷酰胺对仔猪外周血CD3+、CD4+、CD8+T细胞的影响,见图1。随着环磷酰胺的注射,仔猪CD3+、CD4+、CD8+T细胞在注射后7 d试验B、C、D组显著低于对照A组(P<0.05),B组、C组、D组间差异不显著(P>0.05);14 d仔猪CD4+T细胞中,B组、C组、D组比A组显著降低(P<0.05);B组、C组、D组间差异不显著(P>0.05)。21 d A组、B组、C组、D组间差异均不显著(P>0.05),试验各组CD3+、CD4+、CD8+T细胞有所恢复。
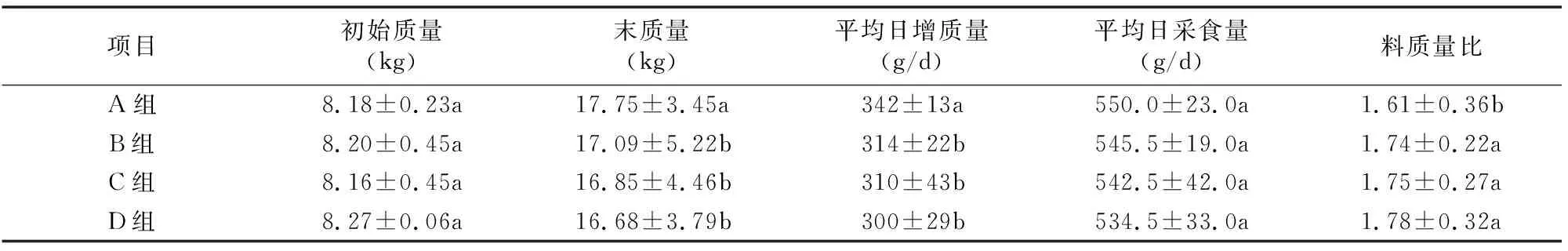
表2 环磷酰胺对仔猪生长性能的影响
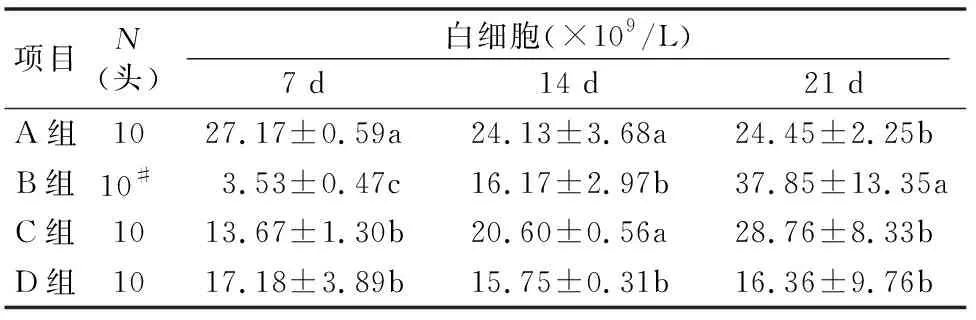
表3 环磷酰胺对仔猪白细胞的影响
注:#表示B组在21 d时只有8头。下表同。
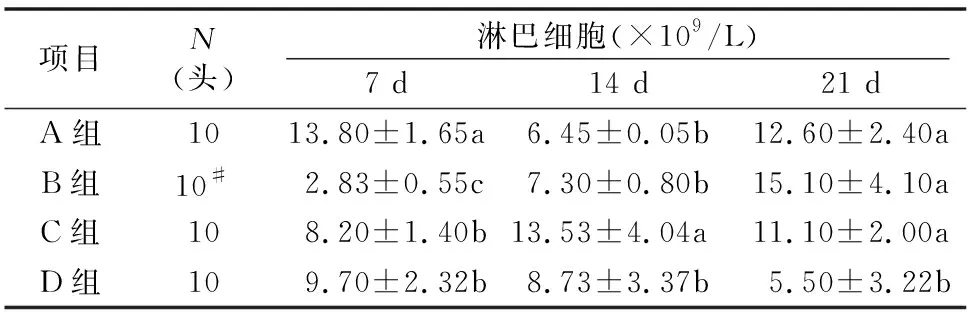
表4 环磷酰胺对仔猪淋巴细胞的影响
3 讨论
3.1 环磷酰胺对断奶仔猪被毛的影响
本研究肌肉注射环磷酰胺后3 d便观察到试验动物被毛轻微竖立,光泽度欠佳,停药后得以逐渐恢复。Novotná等研究表明环磷酰胺用药后3 d,鸡毛囊真皮乳头和基质细胞之间的暗带呈现零乱皱褶状,皱褶处附着致密的沉着物,沉着物内侧充满小突起[7]。真皮乳头细胞周围的胶原纤维排列紊乱,异染色质沿核膜边缘集结,粗面内质网增多,毛球基质细胞间隙变小,甚至消失,相邻细胞有桥粒连接,细胞核张力丝杂乱排列。如果采集试验仔猪的皮肤和被毛,在显微镜下观察其毛囊结构和鳞片排列情况,试验结果将更加全面。
3.2 环磷酰胺对断奶仔猪生长性能的影响
本研究发现,注射环磷酰胺组的料肉比和平均日增质量比对照组低,这与Han等的研究结果[8]有一致性。这与环磷酰胺对肠道上皮细胞的损伤有关,仔猪消化道各段从内向外可分为4层,即黏膜层、黏膜下层、肌层、浆膜层,最内层为黏膜层,黏膜层主要由上皮细胞和分散其间的杯状细胞组成,是吸收营养物质的主要部位。黏膜上皮细胞间紧密连接,但不断更新,其细胞周转在所有组织中最高,大约3~10 d可从隐窝向绒毛移行,到达肠绒毛顶端并脱落,随粪便排出体外,属快速增殖组织。环磷酰胺分解物——去甲氮芥可引起组蛋白H2A的变异体H2A.X 和 P53的磷酸化, 引起DNA受损[9]。
机体中快速生长组织的DNA和蛋白质更新较快,因此受损严重[10],所以对胃肠道的消化和吸收功能影响甚大。
3.3 环磷酰胺对仔猪外周血白细胞、淋巴细胞数量的影响
本研究发现,环磷酰胺可降低仔猪外周血白细胞和淋巴细胞,在7 d时表现尤甚。Harada等用环磷酰胺腹腔注射约克猪后,外周血白细胞和淋巴细胞在2~12 d显著低于对照组[3],本研究结果与之存在一致性。呈现此现象可能与成髓细胞有丝分裂活动受抑制和淋巴细胞尤其是B淋巴细胞有丝分裂静止有关[11];本研究中另一个值得注意的现象,即B、C组白细胞在21 d反弹性升高,显著高于对照组,B、C组的淋巴细胞也存在类似的表现,即B、C组下降至最低处,然后反弹高于正常值,而D组的白细胞和淋巴细胞均缓慢上升,这与徐宏贵等的研究结果[12]有类似之处。这可能是由于少量多次的注射方式对造血功能损伤及抑制程度轻,对GO期造血干细胞杀灭作用弱,致使骨髓内残存的造血干细胞迅速代偿性增殖,促使淋巴细胞和白细胞数量迅速增加,并释放到外周血中。而一次性大剂量注射环磷酰胺严重破坏了骨髓造血干细胞代谢池,使之代偿能力受损,故回升缓慢[13]。
由此可见,小剂量多次注射对外周血淋巴细胞和白细胞的影响有较大幅度影响,而单次大剂量注射则影响平稳。
3.4 环磷酰胺对外周血T细胞亚群的影响
为进一步考察环磷酰胺对断奶仔猪免疫抑制机理,本研究采用流式细胞术检测外周血的CD3+、CD4+、CD8+T细胞百分含量,以探寻环磷酰胺对T细胞的影响。
CD3+是外周血中代表成熟T淋巴细胞最好标志物之一,CD4+是调节机体免疫功能最重要的枢纽细胞;CD8+亚群为免疫反应中的直接杀伤性细胞,CD3+、CD4+、CD8+细胞百分含量直接反应机体的免疫机能。本试验研究结果表明,试验各组CD3+、CD4+、CD8+在试验7 d时显著降低,与杨宪勇、李霞等的研究结果[14-15]一致,这可能是环磷酰胺通过死亡受体信号转导通路Fas/Fas L介导细胞凋亡,引起成熟T细胞数目减少。第二种可能是通过Bax/Bcl-2(B淋巴细胞瘤-2相关X蛋白/B淋巴细胞瘤-2)介导的细胞凋亡,细胞脂肪变性与氧应激使Bcl-2相关X蛋白(bcl-2 assaciated x protein,Bax)合成增多且转移至线粒体外膜形成同源二聚体,引起线粒体PT孔打开,释放细胞色素C,诱发细胞凋亡;而分布于线粒体外膜的Bcl-2可与Bax结合,避免Bax同源二聚体形成,抑制PT孔开放,体现抗凋亡作用。CTX能显著增加成年雄性Wistar大鼠心脏组织BaxmRNA表达水平(P<0.05),而降低抗凋亡基因Bcl-2 mRNA表达(P<0.05)[16]。单剂量150 mg/kg CTX作用活体小鼠,第2天红细胞生成受到影响,凋亡增大,细胞密度减少[17]。也可能是环磷酰胺依赖能抑制一种周期素依赖性激酶4(CDK4),导致细胞停滞在G1期[10],具体原因有待进一步研究。总之,环磷酰胺可抑制T细胞的成熟、增殖与分化。
4 小结
一定剂量的环磷酰胺可导致仔猪生长性能降低,改变免疫细胞浓度,就本试验而言,少量多次(60 mg/kg 3 d和 90 mg/kg 2 d)和1次大剂量(180 mg/kg)能改变机体白细胞和淋巴细胞浓度,抑制T细胞的成熟、增殖与分化,具有免疫抑制作用,能构成免疫抑制模型。由于一次大剂量(180 mg/kg)操作简便,且免疫抑制效果稳定,推荐使用。
:
[1]钟金凤,方热军. 环磷酰胺免疫抑制机制及在动物模型上的应用[J]. 中国免疫学杂志,2016(10):1541-1546.
[2]冯 焱,赵恒寿,刘佳斌,等. 环磷酰胺对肉仔鸡免疫机能的影响[J]. 饲料博览(技术版),2007,19(10):31-34.
[3]Harada K,Muramatsu M,Suzuki S,et al. Evaluation on the pathogenicity ofErysipelothrixtonsillarumfor pigs by immunosuppression with cyclophosphamide or dexamethasone[J]. Research in Veterinary Science,2011,90(1):20-22.
[4]Huyan X H,Lin Y P,Gao T,et al. Immunosuppressive effect of cyclophosphamide on white blood cells and lymphocyte subpopulations from peripheral blood of Balb/c mice[J]. International Immunopharmacology,2011,11(9):1293-1297.
[5]Derbyshire J B. The effect of immunosuppression with cyclophosphamide on an experimental porcine enterovirus infection in piglets[J]. Canadian Journal of Comparative Medicine,1983,47(2):235-237.
[6]NRC. Nutrient requirements of swine[M]. 11th ed. Washington D C:National Academy Press,2012:40-47.
[7]Novotná B,Jelínek R. Mutagenic and teratogenic effects of cyclophosphamide on the chick embryo:chromosomal aberrations and cell proliferation in affected and unaffected tissues[J]. Teratogenesis,Carcinogenesis,and Mutagenesis,1990,10(4):341-350.
[8]Han J,Liu Y L,Fan W,et al. DietaryL-arginine supplementation alleviates immunosuppression induced by cyclophosphamide in weaned pigs[J]. Amino Acids,2009,37(4):643-651.
[9]Kumar D,Tewari-Singh N,Agarwal C,et al. Nitrogen mustard exposure of murine skin induces DNA damage,oxidative stress and activation of MAPK/Akt-AP1 pathway leading to induction of inflammatory and proteolytic mediators[J]. Toxicology Letters,2015,235(3):161-171.
[10]Lee J,Lim K T. Protection against cyclophosphamide-induced myelosuppression by ZPDC glycoprotein (24 ku)[J]. Immunological Investigations,2013,42(1):61-80.
[11]Mackie E J. Immunosuppressive effects of cyclophosphamide in pigs[J]. American Journal of Veterinary Research,1981,42(2):189-194.
[12]徐宏贵,方建培,黄绍良,等. 环磷酰胺对小鼠骨髓造血干/祖细胞作用及机制研究[J]. 中国小儿血液与肿瘤杂志,2007,12(3):106-110.
[13]马增春,谭洪玲,肖成荣,等. 环磷酰胺损伤小鼠骨髓造血的机制[C]. 全国药物毒理学会议,2007:332-333.
[14]杨宪勇. 应用环磷酰胺构建C57BL/6J小鼠免疫抑制模型[J]. 中国组织工程研究,2012,40(16):7486-7489.
[15]李 霞,李殿俊,富东旭. 免疫抑制剂对小鼠胸腺及外周血、脾脏T淋巴细胞亚群的影响[J]. 哈尔滨医科大学学报,2005,39(4):325-326,330.
[16]Asiri Y A. Probucol attenuates cyclophosphamide-induced oxidative apoptosis,p53 and Bax signal expression in rat cardiac tissues[J]. Oxidative Medicine and Cellular Longevity,2010,3(5):308-316.
[17]Juaristi J A,Aguirre M V,Todaro J S,et al. EPO receptor,Bax and Bcl-x(L) expressions in murine erythropoiesis after cyclophosphamide treatment[J]. Toxicology,2007,231(2/3):188-199.
