猪弓形虫感染的血清肽谱诊断法建立及初步应用
2018-05-30郝福星左伟勇
郝福星, 左伟勇, 刘 莉,2
(1.江苏农牧科技职业学院/江苏省兽用生物制药高技术研究重点实验室,江苏泰州 225300; 2.扬州大学兽医学院,江苏扬州 225009)
弓形虫病是由刚地弓形虫(Toxoplasmagondii)引起的一种人兽共患寄生虫病,宿主种类十分广泛[1]。猫科动物是弓形虫的终末宿主[2],在猫体内弓形虫进行有性生殖产生卵囊,卵囊随猫的粪便排出体外,并发育成具有感染性的孢子化卵囊,后者能够感染人和大多数的温血动物。人因与动物接触、误食了受弓形虫卵囊污染的水源、土壤或食物(肉、蛋),会引起弓形虫感染[3]。据文献报道,人和动物感染呈世界范围内分布,人群的平均感染率25%~50%,多呈隐性感染,推算全世界约1/4的人感染弓形虫[4];感染弓形虫的动物种类很多,如家畜、家禽、鼠以及鱼类,可引起猪、牛、羊、犬、鸡等畜禽发病,可引起大批发病,死亡率高,给畜牧业生产造成严重经济损失[5-7]。而猪作为人类最主要的肉产品来源之一,检测其弓形虫感染状况,在公共卫生与食品安全方面意义重大[7]。因此,开展猪弓形虫病的研究工作,对畜牧业发展和人类健康具有重要的经济价值和社会意义。
弓形虫感染的诊断主要包括病原学检测、免疫学诊断及分子生物学诊断技术[8]。病原学检测方法有直接涂片与组织切片染色法,该法可对弓形虫急性感染进行确诊,但存在费时费力的缺点,对弓形虫隐性感染的检测效能不强;动物接种试验和细胞培养法能够直接确认病原体存在,但敏感性低、耗时、易漏诊且难以应用于实际操作。以间接血凝试验(IHA)与酶联免疫吸附试验(ELISA)为主的免疫学诊断方法[9]具有特异性强、敏感性高、操作简便等优点,是弓形虫病流行病学调查和诊断最常用的方法,但有报道显示,临床诊断中也存在假阳性,需要与其他诊断方法综合判定[10]。以PCR为主的分子生物学诊断技术[11]具有灵敏度高的特点,但是因检测样本(如外周血)复杂与PCR技术本身等原因也存在假阳性高、准确性较差等缺点。因此,迫切需要建立一种准确性好、快速灵敏的检测方法。
笔者利用MALDI-TOF质谱结合ClinProTool分析在小鼠动物模型上已能成功对弓形虫感染进行判定[12]。有文献显示,该方法在包括血吸虫感染、肿瘤、神经系统疾病诊断中也有较广泛的应用[13],具有高通量、灵敏度高、可重复性好及样本需求量少等优势,本研究拟建立一种快速准确诊断猪弓形虫感染的方法,对江苏泰州部分地区猪场的弓形虫感染情况做一调查,为当地猪的养殖与防病提供重要的参考。
1 材料与方法
1.1 受试动物与试剂
江苏省泰州市辖区(海陵、高港、姜堰)小型猪场(<100头猪)育肥猪,共采集3个猪场,每个猪场采集50头。
弓形虫间接血凝试验冻干抗原(IHA抗原,批号:20151011);标准阳性血清、标准阴性血清、稀释液(批号:20151011),均购自中国农业科学院兰州兽医研究所。MB-WCX磁珠纯化试剂盒(美国Bruker Daltonic公司),丙酮、甲醇、异丙醇、乙腈、三氟乙酸、甲酸等均为色谱纯级。基质:HCCA(α-氰-4-羟肉桂酸),300 mg/L,溶于乙醇 ∶丙酮=2 ∶1,新鲜配制。
1.2 血清采集与分离
每头猪行耳静脉采血2~2.5 mL,将采集的新鲜血液,加入1.5 mL无菌EP管中,即刻置于4 ℃冰箱保存,待30 min后以12 000 r/min、4 ℃离心10 min,分离血清冷冻于-80 ℃冰箱待测。
1.3 弓形虫IHA诊断方法
按照试剂说明书进行操作,即于96孔有机玻璃板加入75 μL稀释液,每个待检血清样品加稀释液4孔,取25 μL血清加入第一孔,混匀后吸取25 μL加入第二孔,以此类推,进行倍比稀释。待检血清加完后,每孔加入25 μL诊断液,将反应板放至微量振荡器上振荡1~2 min,静置于22~37 ℃恒温箱中作用2~3 h后观察结果。每批次均需设阳性对照与阴性对照。
1.4 血清肽质谱检测法
根据磁珠纯化血清多肽试剂盒标准操作规程,将10 μL样本结合液与10 μL磁珠试剂混合,与血清样本10 μL混匀并室温静置5 min;将磁珠进行富集并弃上清,清洗磁珠后加洗脱液(ES)5 μL与磁珠混匀,室温静置5 min后置磁珠富集器并弃上清,最后加5 μL稳定液(SS)至离心管并混匀,取 1 μL 与基质10 μL完全混合,制成混悬液,取1 μL混悬液点靶,室温干燥后上机检测,设置MALDI-TOF-MS仪器参数,选择LP-Clinprot.pa方法,靶MTP_polished steel 384,激光能量在40%左右,检测分子量范围为m/z800~12 000;应用flexanalysis与Clin ProTools软件对采集图谱进行分析,应用MASCOT数据库对差异多肽峰进行初步搜库鉴定。
2 结果与分析
2.1 血清间接血凝试验结果
根据IHA阳性结果标准,在阳性对照血清效价不低于 1 ∶1 024,阴性对照孔血清除第1孔允许有前滞现象“+”外,其余各孔及对照孔均为“?”的前提下,对被检血清进行判定,被检血清抗体效价达到或超过1 ∶64为阳性。结果显示,本研究采集的泰州市辖区(海陵、高港、姜堰)3个小型猪场的150头份血清样本中阳性血清为25份,阳性率为16.67%(表1)。
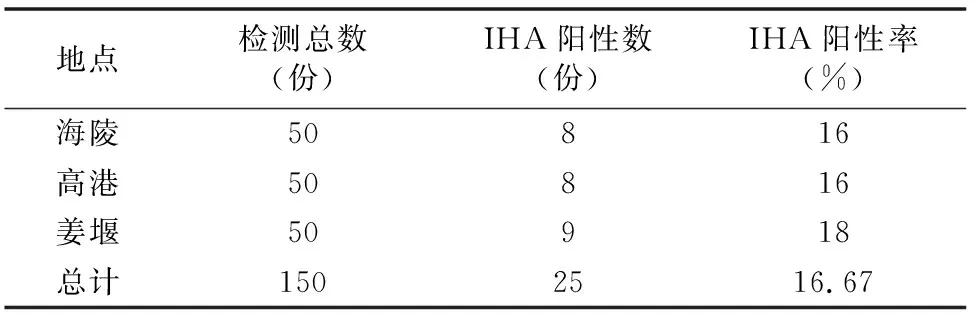
表1 泰州部分地区猪弓形虫感染情况调查(IHA法)
2.2 血清多肽指纹图谱分析
将25份IHA阳性血清与125份阴性血清分别归为感染组与对照组,利用磁珠纯化血清多肽,并与基质混匀后点靶进行质谱检测。结果显示,与阴性对照组相比,IHA阳性组猪血清中在m/z1 608.59、1 971.84、5 004.01、4 617.49、7 808.23的5个多肽峰的表达显著上调,而m/z1 233.01、8 007.66、2 356.37、3 735.65的4个峰呈显著下调(表2)。
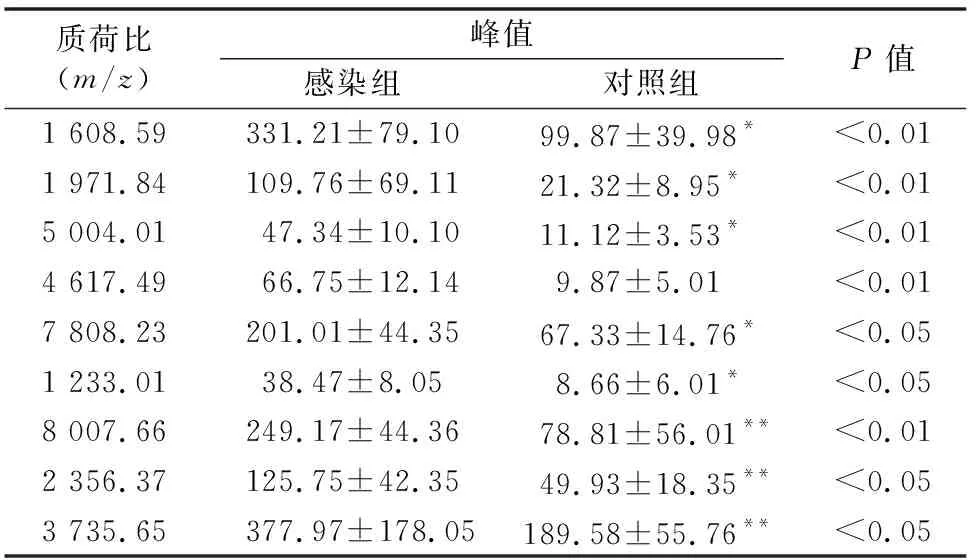
表2 猪弓形虫感染组与对照组血清差异表达多肽(ClinProTool法)
注:“*”表达上调,“**”表达下调。
2.3 弓形虫检测方法的建立与验证
将血清多肽指纹图谱导入Clin ProTools软件,并将IHA阳性血清与阴性血清进行分组,寻找并依据组间谱图差异,建立猪的弓形虫感染诊断方法,为验证诊断方法的敏感性与特异性,将阳性与阴性血清指纹图谱导入,质谱可自动化判定,结果显示,25份IHA阳性血清可以成功被质谱诊断模型判定为弓形虫感染,敏感性达100%,而125份阴性血清中有119份可被判定为未感染,准确性达95.2%(119/125),另6份不能判定。
3 结论与讨论
猪弓形虫病呈世界范围流行,我国分布十分广泛,食入猫粪便中的卵囊、通过损伤的黏膜与皮肤、母猪孕期经胎盘感染仔猪,均为本病的感染途径[14]。规模化、现代化的养殖方式虽可以避免传统粗放养殖中的寄生虫感染情况,如疥螨和蛔虫等感染率得以大大降低,但畜牧场外部环境、猪群内部引进和繁殖等一系列环节的存在,使得弓形虫仍然有较高的感染机会,甚至呈暴发流行[15],而弓形虫作为人兽共患寄生虫病,禽、犬、猫等多种动物均可携带[16],对公共卫生威胁更大,有必要对该病进行重点防控。有报道显示,部分猪场发病率可高达60%以上[17],病死率可高达64%。随着养殖水平提高,该病在我国多呈隐性感染,一旦疏于防范,有可能造成弓形虫病的流行和暴发,因此,对规模化养殖猪场尤其要加强该病的监测。相比传统的检测方法,血清多肽指纹图谱检测法具有高通量、检测效率高的优势,且在实验小鼠[18]、家兔[19]等动物已成功建立了寄生虫病的诊断方法,在猪的弓形虫感染诊断中,还较少见报道。
MALDI-TOF质谱结合Clin ProTools软件分析,可以将弓形虫感染与未感染猪血清中的多肽进行区别,并以血清差异表达多肽建立诊断方法,对该方法的验证结果显示,与传统的IHA方法一致,可以用于猪感染弓形虫的诊断与早期筛查。本研究采用的质谱检测法,可以在30~60 min内实现384个样本的检测,具有高通量、快速、自动化程度高等特点,且血清样本需求量为传统IHA实验的1/20,很大程度上减少受试猪的失血量。对血清差异表达多肽的检测与MASCOT搜库分析显示,与笔者之前的研究比较,m/z1 971.84、5 004.01 同样出现在弓形虫感染的小鼠与本研究选取的IHA阳性猪血清中,经二级质谱鉴定,该2种多肽分子可能为弓形虫表面膜蛋白的片段,有望成为弓形虫感染动物的指征性分子。ClinProTools分析显示,利用猪血清中9个差异性多肽峰建立诊断方法,其敏感性与准确性较高,该方法以多个差异多肽作为判断指标,其准确性要优于单一指标,且血清多肽检测方法是建立在群体基础上,更好地规避了个体差异,在同组血清样本中能够最大限度地体现共性,可重复性强。因此,该方法有望成为判定猪弓形虫感染状况的辅助筛查手段。
:
[1]Szabo E K,Finney C A M.Toxoplasmagondii:one organism,multiple models[J]. Trends in Parasitology,2016,33(2):113-127.
[2]Yin Q,El-Ashram S,Liu X Y,et al. Early detection ofToxoplasmagondii-infected cats by interferon-gamma release assay[J]. Exp Parasitol,2015,157:145-149.
[3]Chen M X,Ai L,Chen J H,et al. DNA microarray detection of 18 important human blood protozoan species[J]. PLoS Negl Trop Dis,2016,10(12):e0005160.
[4]张燕萍,宋任浩. 孕妇弓形虫感染妊娠结局及危险因素调查[J]. 中国血吸虫病防治杂志,2014(2):221-223.
[5]卓国荣,周红蕾,张 斌,等. 泰州地区犬血清弓形虫抗体间接血凝与胶体金试纸对比调查研究[J]. 江苏农业科学,2013,41(7):211-212.
[6]Mose J M,Kagira J M,Karanja S M. Detection of naturalToxoplasmagondiiinfection in chicken in thika region of Kenya using nested polymerase chain reaction[J]. BioMed Research International,2016,2016 (5):1-5.
[7]Guo M,Buchanan R L,Dubey J P,et al. Qualitative assessment forToxoplasmagondiiexposure risk associated with meat products in the United States[J]. J Food Prot,2015,78(12):2207-2219.
[8]Satbige A S,Vijaya Bharathi M,Ganesan P I,et al. Detection ofToxoplasmagondiiin small ruminants in Chennai using PCR and modified direct agglutination test[J]. J Parasit Dis,2016,40(4):1466-1469.
[9]Zhuo X,Huang B,Luo J,et al. Development and application of loop-mediated isothermal amplification assays based on ITS-1 for rapid detection ofToxoplasmagondiiin pork[J]. Vet Parasitol,2015,208(3/4):246-249.
[10]Li F,Wang S P,Wang C J,et al. Seroprevalence ofToxoplasmagondiiin goats in Hunan Province,China[J]. Parasite,2016,23:44.
[11]Satbige A S,Bharathi M V,Ganesan P I,et al. Detection ofToxoplasmagondiiin small ruminants in Chennai using PCR and modified direct agglutination test[J]. J Parasit Dis,2016,40(4):1466-1469.
[12]郝福星,左伟勇,刘 莉. ClinProTool结合质谱分析弓形虫急性感染小鼠血清多肽[J]. 江苏农业科学,2015,43(9):240-241.
[13]Savino R,Paduano S,Preiano M,et al. The proteomics big challenge for biomarkers and new drug-targets discovery[J]. Int J Mol Sci,2012,13(11):13926-13948.
[14]孔 猛,白 昀,冯志新,等. 弓形虫NT株猪体人工发病实验研究[J]. 中国人兽共患病学报,2010,26(11):1016-1020.
[15]Dzib-Paredes G F,Rosado-Aguilar J A,Acosta-Viana K Y,et al. Seroprevalence and parasite load ofToxoplasmagondiiin Mexican hairless pig (Susscrofa) tissues from the Southeast of Mexico[J]. Vet Parasitol,2016,229(15):45-49.
[16]卓国荣,狄和双,卢 炜,等. 不同检测方法分析泰州地区猫血清中弓形虫抗体[J]. 江苏农业科学,2013,41(10):190-191.
[17]向忠菊,段永兰,岳新军,等. 安徽部分地区猪弓形虫病的血清学调查研究[J]. 湖南农业科学,2011,1(17):134-135,138.
[18]Huang Y,Li W,Liu K,et al. Detection of sentinel mice using ClinProTool algorithm established by acuteSchistosomiasisjaponicamice[J]. Parasitol Res,2016,115(11):4173-4181.
[19]Huang Y,Yang G,Kurian D,et al. Proteomic patterns as biomarkers for the early detection ofSchistosomiasisjaponicain a rabbit model[J]. International Journal of Mass Spectrometry,2011,299(2/3):191-195.
