外源Ca2+对茄穴盘苗贮运质量的影响
2018-05-30张彩霞王星剑陈祖枝王文婷黄碧阳郑诚乐
张彩霞, 王星剑, 徐 磊, 陈祖枝, 王文婷, 胡 欣, 卢 婷, 黄碧阳, 郑诚乐
(1.福建农林大学园艺学院,福建福州 350002; 2.福建省福安市农业局,福建福安 355000)
穴盘育苗是利用穴盘作育苗容器,采用草炭、蛭石等轻基质材料作育苗基质,1穴1粒,一次性成苗的现代化育苗方式[1]。目前,我国有2/3的蔬菜采用育苗移栽的方式栽培,而工厂化育苗主要以穴盘育苗为主[1-4]。因此,穴盘苗的运输成为一个不可缺少的环节,如何避免运输途中低温、弱光及高温等胁迫对穴盘苗造成损伤,这对穴盘苗的贮藏运输技术提出了更高要求。有研究表明,在幼苗期适量施用一定浓度的脱落酸(abscisic acid,简称ABA)、糖类物质、一氧化氮(NO)等外源物可有效缓解逆境胁迫对植株造成的伤害,增强植株抗逆境能力,有利于种苗后期的生长恢复。通过施用外源物质改善作物对逆境的适应性,促进其产量和品质的形成,是省力、省时而又高效的途径之一。近年来研究发现,在低温、弱光、干旱、盐胁迫、重金属毒害等多种逆境条件下,钙能够有效调节植物的生长、发育、抗逆等生理反应[5-6]。本研究以茄为试验材料,研究贮运前叶面喷施Ca2+对贮运过程中茄穴盘苗生长、相关代谢物质及定植后生长恢复能力的影响,以期为外源矿物质的科学利用提供依据。
1 材料与方法
1.1 试验材料
长卵黑茄品种秀娘,由农友种苗(中国)有限公司提供;外源Ca2+、吐温-20(CAS号:9005-64-5),由国药集团化学试剂有限公司提供。
1.2 试验方法
1.2.1 外源Ca2+的喷施 试验于2016年3-5月在福建农林大学园艺学院设施温室和蔬菜生理生化实验室进行。将茄种进行常规温汤浸种催芽,待大部分种子露白,播种到50孔的穴盘中,育苗基质为草炭 ∶珍珠岩 ∶蛭石按体积比 3 ∶1 ∶1 配制;将播种好的穴盘置于光照、温度、湿度适宜的温室中,随机排列,待子叶展平,每4 d浇灌1次1/2日本山崎茄营养液;穴盘苗长到4叶1心后的第1、3天09:00和 21:00,分别对穴盘苗喷施含0.01%吐温-20 Ca2+浓度分别为0、2、7、12、17、22 mmol/L的溶液,编号依次为CK、G11、G22、G33、G44、G55,喷壶平放喷施,每次每穴盘喷施溶液 80 mL,以叶面均匀布满液珠但不流下为宜。每个处理2个穴盘,重复3次。
1.2.2 贮运模拟 喷施Ca2+处理结束第2天07:00,将穴盘苗移到冷库内模拟贮运过程,贮运环境温度为15±1 ℃,湿度为70%~90%,无光照;每天07:00、19:00随机调换各重复在冷库中的位置,并进行轻微上下晃动以达到模拟贮运的目的;分别于模拟贮运后0、2、4、6 d的07:00测定相关形态及生理生化指标,每个处理随机取样,重复3次。
1.2.3 定植后的恢复 分别把贮运0、2、4、6 d的茄穴盘苗移栽到10 cm×10 cm的营养钵中,基质为体积比为3 ∶1 ∶1配制的草炭、珍珠岩、蛭石;缓苗1 d后,置于人工气候室中培养,光照度为120 μmol/(m2·s),光照时间为12 h,白天温度为28 ℃,夜间为20 ℃,湿度为(65±5)%,每2 d浇灌50 mL 1/2 日本山崎茄营养液;每天15:30测定植株的心叶长度,8 d后测定相关形态指标。每个处理15株,重复3次。
1.3 测定内容及方法
同一处理中随机选取长势一致的幼苗5株,测定茎粗、株高、地下部与地上部干质量,重复3次。计算壮苗指数[7-8],其公式为
壮苗指数=(茎粗/株高+地下部干质量/地上部干质量)×全株干质量。
分别采用考马斯亮兰法、蒽酮比色法、酸性茚三酮比色法、硫代巴比妥酸法、浸提法测定可溶性蛋白、可溶性糖、脯氨酸、丙二醛(malondialdehyde,简称MDA)、叶绿素的含量[8-10];采用电导法鉴定其抗逆性[10]。测定心叶长度,计算心叶绝对生长速度(mm/d)[11],其公式为:
心叶绝对生长速度=(定植后8 d的平均心叶长度-定植时平均心叶长度)/定植天数。
1.4 数据统计分析
采用Excel 2003软件对数据进行统计、作图;采用DPS软件对数据进行Duncan’s新复极差法差异显著性分析。
钟鼎创投合伙人尹军平则给出了更为具体的辨别方案,以提升并购整合成功的概率。“第一是在选择潜在标的时,重点考察财务真实性,职业化水平、规范化难度。第二是先参股磨合一段时间,再考虑进行收购。第三是优先考虑优秀VC、PE投资过的项目。”
2 结果与分析
2.1 外源Ca2+对茄穴盘苗贮运过程中壮苗指数的影响
由图1可知,贮运0 d时,处理G22的壮苗指显著高于CK,较CK高51.02%,其他浓度处理与CK差异不显著;贮运2 d时,外源Ca2+处理的茄穴盘苗壮苗指数均显著大于CK,其中处理G33、G22相对较高;贮运4、6 d时,处理G33的壮苗指数达到最大值,与CK相比差异显著;CK处理的壮苗指数随贮运时间的增加整体呈减少趋势,贮运2、4、6 d时CK的壮苗指数比贮运0 d时分别减小0.040、0.025、0.046;贮运2、4、6 d时,处理G33的壮苗指数比贮运0 d时分别增加0.029、-0.013、0.032,说明外源Ca2+12 mmol/L 处理对贮运过程中的茄穴盘苗有一定的壮苗效果,而其他Ca2+处理随贮运时间的延长均导致茄壮苗指数下降。
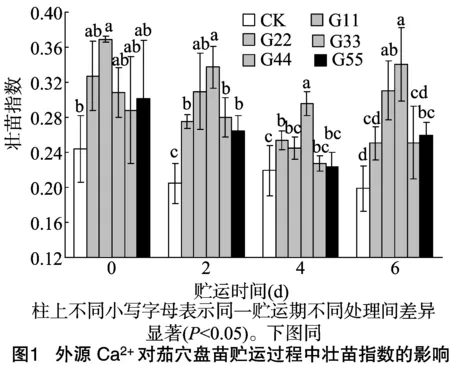
2.2 外源Ca2+对茄穴盘苗贮运过程中相关代谢物质的影响
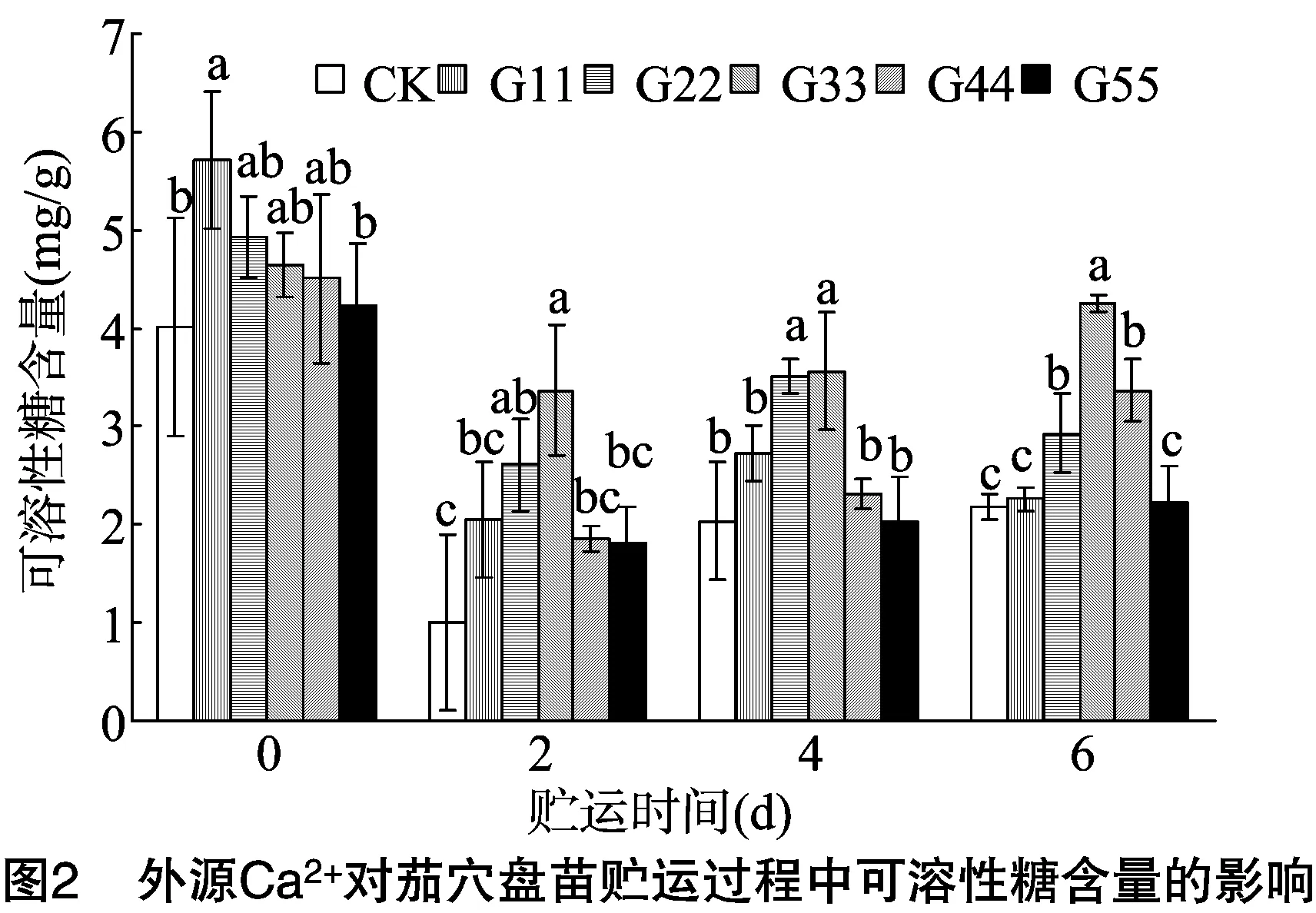
2.2.1 可溶性糖含量 由图2可知,随着贮运时间的延长,Ca2+处理的茄穴盘苗可溶性糖含量明显下降;贮运0 d时,处理G11的可溶性糖含量显著高于CK,较CK增加42.56%;在不同贮运期,处理G55的可溶性糖含量与CK差异不显著;贮运2、4 d时,处理G22、G33的可溶性糖含量相对高,与CK相比差异显著;贮运6 d时,处理G33的可溶性糖含量相对最高,其次为处理G44、G22,均显著高于CK;贮运6 d时,CK处理的可溶性糖含量较贮运0 d时下降45.75%,而处理G33的可溶性糖含量较贮运0 d时下降8.55%,CK处理的可溶性糖含量下降幅度是处理G33的5.35倍,有明显下降。这说明贮运可抑制植物体内能量物质的合成,导致可溶性糖含量的积累降低, 而喷施外源Ca2+可起到促进叶片可溶性糖合成的效果,其中,以处理G33相对较好,G22次之。
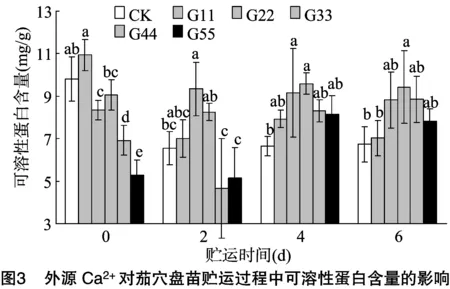
2.2.2 可溶性蛋白含量 由图3可知,贮运0、2 d时,处理G44、G55(高浓度Ca2+处理)的茄穴盘苗其可溶性蛋白含量明显低于CK,贮运4、6 d时可溶性蛋白含量明显上升,与CK差异不显著,说明高浓度Ca2+处理早期可抑制可溶性蛋白的积累,但这种抑制是可逆的,4 d后可恢复;处理G33茄穴盘苗的可溶性蛋白含量在贮运4、6 d时显著高于CK,分别较CK高44.21%、40.06%。
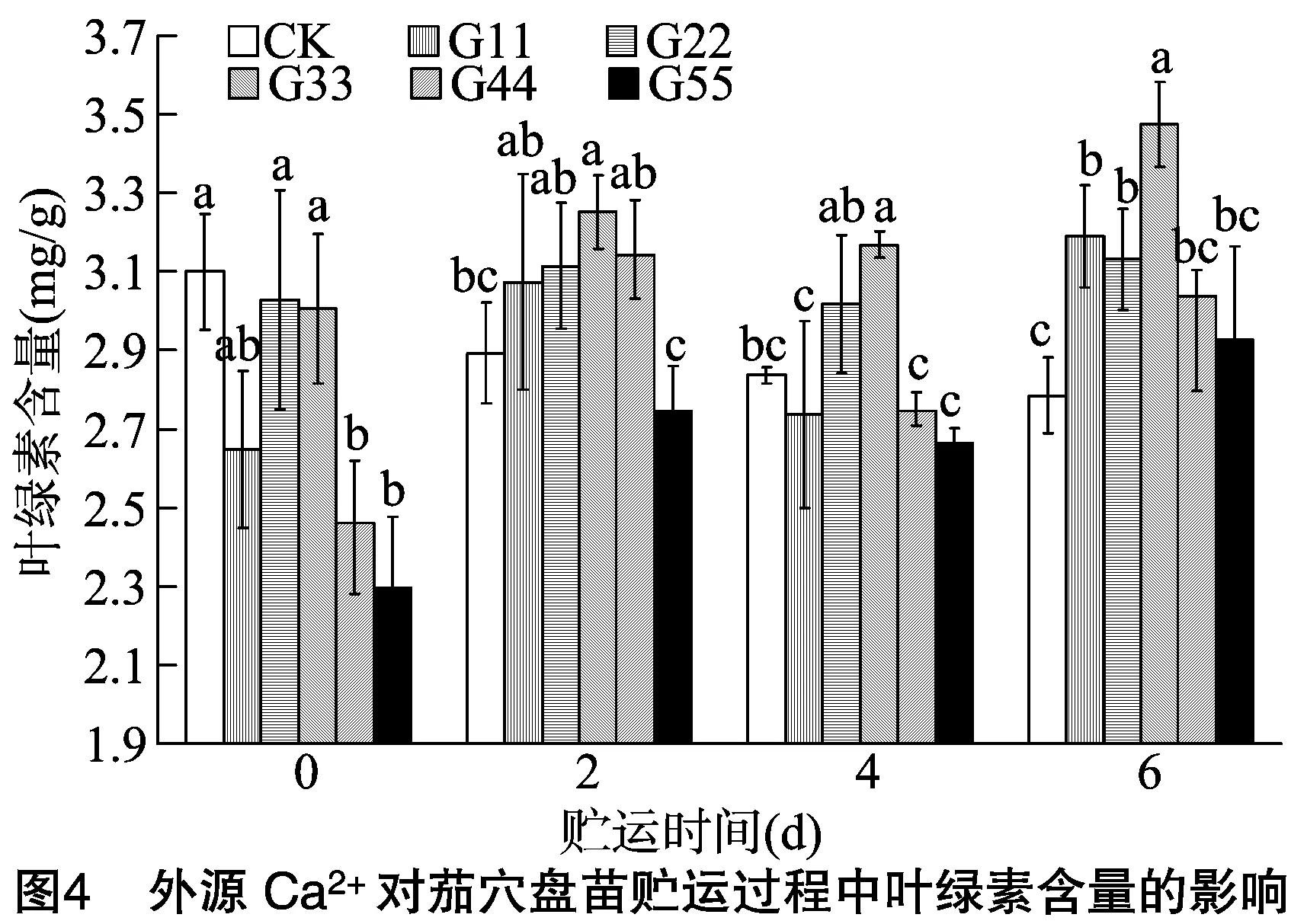
2.2.3 叶绿素含量 由图4可知,在贮运过程中CK的叶绿素含量呈下降趋势,贮运2、4、6 d时的叶绿素含量分别比贮运 0 d 时下降0.21、0.26、0.31 mg/g;贮运2、4 d时,处理G33的叶绿素含量达到最大值,较CK分别高12.42%、11.66%,显著高于CK;贮运6 d时,处理G11、G22、G33的叶绿素含量显著高于CK,其中,处理G33的叶绿素含量最高,为 3.473 9 mg/g,显著高于其他处理。
2.3 外源Ca2+对茄穴盘苗贮运过程中质膜透性的影响
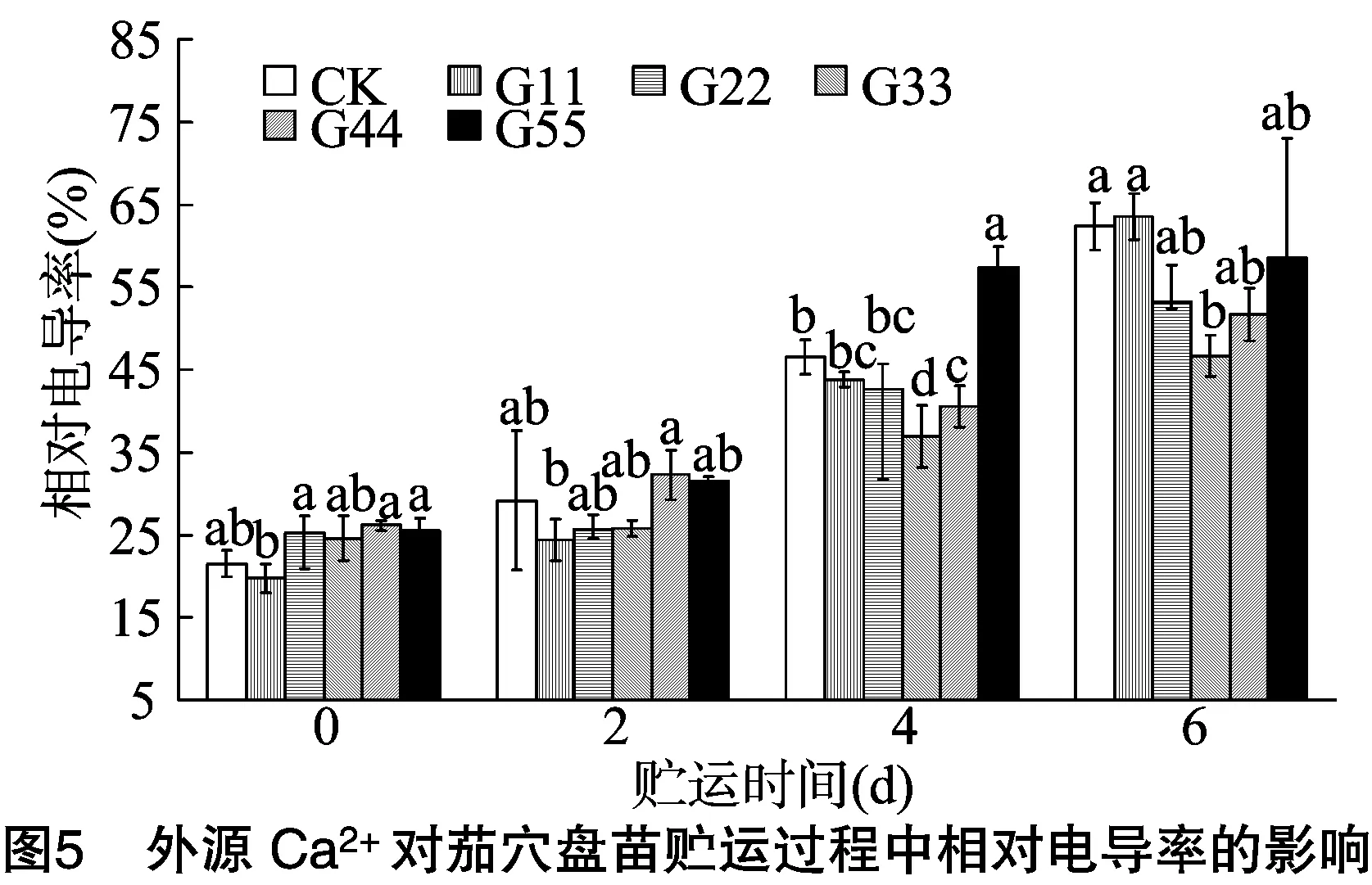
2.3.1 相对电导率 相对电导率是衡量生物膜受破坏程度高低的一个比较直观且重要的指标。由图5可知,在贮运逆境胁迫影响下,穴盘苗叶片的细胞膜透性受到破坏,导致叶片的相对电导率随贮运时间的延长而逐渐增加,CK处理贮运至6 d时,穴盘苗叶片相对电导率较贮运0 d时增加 190.44%;贮运0、2 d时,外源Ca2+处理的相对电导率与CK相比差异不显著;贮运4 d时,处理G33的相对电导率相对最低,其次为处理G44,分别较CK降低20.70%、13.00%,均显著低于CK处理;贮运6 d时,处理G33的相对电导率显著低于CK,其他Ca2+浓度处理与CK差异不显著。这说明一定浓度外源Ca2+处理能明显减缓贮运过程中叶片细胞膜透性的增大,对保持细胞膜渗透性有积极作用。
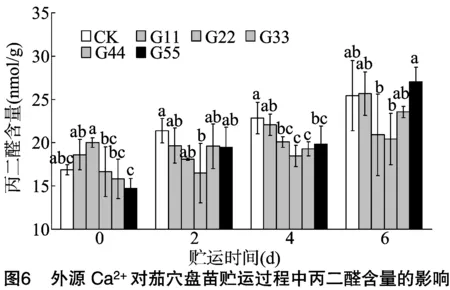
2.3.2 丙二醛含量 MDA是植物生物膜系统过氧化的产物,其含量高低可以反映膜系统受破坏的程度。由图6可知,各处理MDA含量的动态变化与叶片相对电导率基本一致;贮运2、4、6 d时CK的MDA含量分别比贮运0 d增加4.50、5.97、8.57 nmol/g,MDA含量增幅明显;贮运0 d时,外源Ca2+处理的MDA含量与CK相比差异不显著;贮运2 d时,处理G33的MDA含量显著低于CK,较CK低22.85%;贮运4 d时,除处理G11外,其他外源Ca2+处理的MDA含量均显著低于CK,而相互之间差异不显著;贮运6 d时,处理G33、G22的MDA含量明显低于CK,分别较CK下降19.68%、17.77%。这说明一定浓度的外源Ca2+处理,可明显降低贮运过程中叶片MDA的积累,其中,G33处理效果相对最好,其次为处理G22。
2.4 外源Ca2+对茄穴盘苗定植后生长的影响
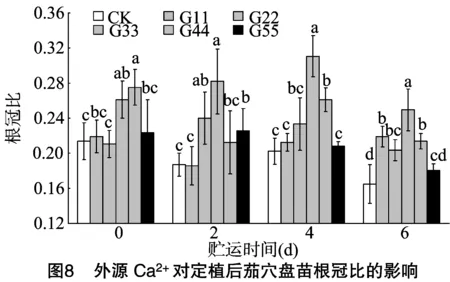
2.4.1 根冠比 由图8可知,外源Ca2+处理的茄穴盘苗,贮运0 d后定植其根冠比以处理G44的相对最大,其次为处理G33,分别较CK增加28.67%、22.17%,均显著高于CK,而其他处理与CK相比差异不显著。随着贮运时间的延长,各处理的根冠比呈先升后降趋势;同一贮运时间,随着外源Ca2+处理浓度的增加,根冠比整体呈先增加后减小趋势;贮运2、4、6 d时,处理G33的根冠比显著大于CK,分别是CK的1.51、1.54、1.51倍,其次为处理G44、处理G22,说明外源Ca2+处理的穴盘苗在定植后对地下部生长有一定的促进作用。
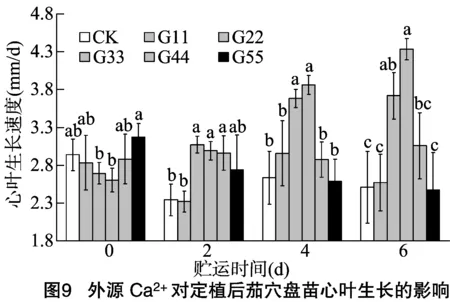
2.4.2 心叶生长速度 定植后幼苗的心叶生长状态,可以在某种程度上反映植株的生长恢复能力。由图9可知,贮运0 d时,外源Ca2+处理的茄穴盘苗其心叶生长速度与CK相比差异不显著;随着贮运时间的延长,CK处理的茄苗心叶生长速度明显下降,贮运2、4、6 后的茄苗其心叶生长速度较贮运0 d时分别下降20.35%、10.38%、14.63%,说明贮运会影响茄穴盘苗定植后的心叶生长,且随着贮运时间的延长,这种影响程度逐渐加深;贮运2 d时,处理G22、G33、G44的心叶生长速度相对较快,显著快于CK,而相互间差异不显著;贮运4、6 d 后定植的茄穴盘苗,处理G22、G33的心叶生长速度均显著快于CK,而相互间差异不显著,其中,处理G33的心叶生长速度相对最快,贮运4、6 d后定植的茄穴盘苗其心叶生长速度分别是CK的1.47、1.73倍。这说明贮运前一定浓度的外源Ca2+处理对穴盘苗定植后心叶生长有不同程度的促进作用。
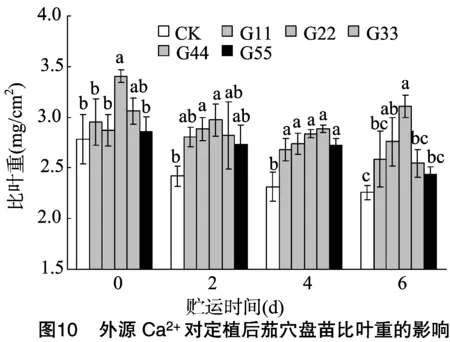
2.4.3 比叶重 由图10可知,在不同贮运期内,处理G22、G33定植后幼苗的比叶重基本保持稳定,其他处理的比叶重随着贮运时间的延长多呈减小趋势;贮运0 d时,处理G33的比叶重显著高于CK,较CK增加22.35%,其他浓度处理与CK相比差异不显著;贮运2 d时,处理G22、G33的比叶重相对较大,分别比CK增加19.25%、22.96%,且显著高于CK;贮运6 d时,处理G33的比叶重相对最大,是CK的1.38倍,其次为处理G22,均与CK有显著性差异。
3 结论与讨论
Ca2+是生物体内传递逆境胁迫信号的第二信使,逆境引起的胁迫可诱发细胞中Ca2+浓度增加,从而激活细胞内与抗逆境胁迫相关基因的表达,进而引起植株的抗逆反应[12]。胡文海等研究表明,低温弱光胁迫可抑制番茄和西瓜幼苗的正常生长,幼苗有明显的徒长现象,比叶重下降、色素含量降低,且随着胁迫时间的延长,幼苗劣变程度加重[13-14]。本试验研究表明,贮运6 d时,不喷施Ca2+(CK)处理的壮苗指数、可溶性糖含量、可溶性蛋白含量、叶绿素含量分别比贮运0 d时下降18.67%、45.75%、31.33%、10.15%,而喷施外源Ca2+能使贮运过程中苗的代谢物质维持在一个相对稳定的水平,且拥有较高的壮苗指数,其中,以喷施外源Ca2+12 mmol/L(处理G33)为佳。
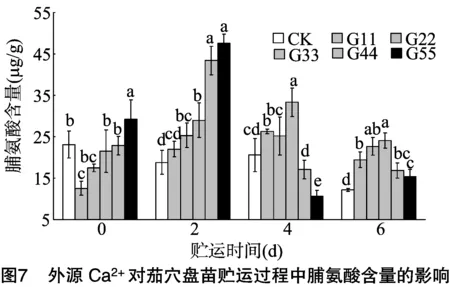
邢燕等研究发现,低温、弱光逆境下西瓜和黄瓜幼苗的细胞膜系统会受到破坏,与逆境呈负相关的膜透性、丙二醛含量会明显上升,渗透调节物质出现降低现象[15-16]。本试验研究表明,贮运6 d时,CK处理的叶片相对电导率、MDA含量分别较贮运0 d时增加190.44%、50.76%;脯氨酸的相对积累量随贮运时间的延长有明显的下降,这与邢燕等的研究结果[15-16]一致,说明贮运的极端环境会影响幼苗细胞膜系统的正常结构和功能,降低了植株抵抗逆境的能力。张琳等在对番茄幼苗耐低温、杏扁雌蕊抗寒性的研究时发现,外源Ca2+处理可显著降低胁迫下MDA含量和膜脂过氧化程度,其幼苗可溶性蛋白、可溶性糖含量增加,抗寒性增强[17-18]。本试验结果表明,一定浓度的外源Ca2+处理对维持贮运过程中细胞膜透性有积极的作用,12 mmol/L Ca2+(G33处理)的茄穴盘苗在贮运6 d时,其相对电导率、MDA含量分别比CK低25.18%、19.68%,脯氨酸含量是CK的 1.98 倍,这与张琳等的研究结果[17-18]基本一致,说明一定浓度的外源Ca2+处理可维持贮运过程中细胞膜系统结构和功能的完整性,提高了植物的抗氧化酶活性,对维持正常的植物生长代谢有积极的促进作用。
李益清等研究表明,外源Ca2+处理可显著降低低温、弱光胁迫对番茄、青花菜幼苗造成的伤害,促进幼苗的生长,提高逆境胁迫后幼苗的生长恢复能力[19-20]。本试验结果表明,在后期茄苗生长恢复中喷施外源Ca2+的茄苗其根冠比、心叶生长速度、比叶重明显大于CK,且随着贮运时间的延长,其差异越明显,说明Ca2+处理能够有效提高茄苗定植后生长恢复能力,使贮运过程中逆境胁迫对穴盘苗造成的不利影响降到最低,保持了较高的商品性,其中,以喷施外源Ca2+12 mmol/L 相对最好。
综上所述,外源Ca2+处理能有效缓解贮运过程中低温、弱光胁迫对穴盘苗的伤害,提高了穴盘苗耐贮运能力及定植后的生长恢复能力,其中,以喷施外源12 mmol/L Ca2+的效果相对为佳,茄穴盘苗的贮运质量相对最好,适合推广应用。
:
[1]胡文娟,曲英华. 我国蔬菜穴盘育苗的研究现状分析[J]. 农业工程技术(温室园艺),2006(1):30-31.
[2]别之龙,黄丹枫. 工厂化育苗原理与技术[M]. 北京:中国农业出版社,2008:80-82.
[3]袁华玲,张金云,张学义,等. 蔬菜穴盘工厂化育苗技术及发展策略[J]. 安徽农业科学,2003,31(6):977-979.
[4]张俊杰,张西群,彭发智,等. 蔬菜工厂化播种育苗技术及应用前景[J]. 河北农业科学,2013,17(4):20-23.
[5]Evans N H,Mcainsh M R,Hetherington A M,et al. ROS perception inArabidopsisthaliana:the ozone-induced calcium response[J]. The Plant Journal,2005,41(4):615-626.
[6]闫 童. 根区临界低温下钙与抑制剂对黄瓜幼苗生理生化特性的影响[D]. 泰安:山东农业大学,2006.
[7]黄淑华,徐福利,王渭玲,等. 丹参壮苗指数及其模拟模型[J]. 应用生态学报,2012,23(10):2779-2785.
[8]韩素芹,王秀峰,魏 珉,等. 甜椒穴盘苗壮苗指数及其与苗期性状的相关性研究[J]. 山东农业大学学报(自然科学版),2004,35(2):187-190,195.
[9]王学奎. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2006.
[10]高俊峰. 植物生理实验指导[M]. 北京:高等教育出版社,2006.
[11]潘小兵,田永强,李娟起,等. 不同贮藏温度对青花菜穴盘苗质量的影响[J]. 中国蔬菜,2015(5):23-27.
[12]Hepler P K,Wayne R O. Calcium and plant deveopment[J]. Annual Review of Plant Physiology,1985,36:397-439.
[13]胡文海,喻景权. 低温弱光对番茄植株生长发育及生理功能的影响[J]. 中国生态农业学报,2003,11(3):55-57.
[14]李爱民,张永泰,熊 飞,等. 低温弱光对西瓜幼苗生理特性的影响[J]. 扬州大学学报(农业与生命科学版),2012,33(2):78-82,94.
[15]邢 燕,徐志红,徐永阳,等. 西瓜苗期耐低温弱光性鉴定指标初探[J]. 中国瓜菜,2012,25(6):31-33.
[16]郄丽娟,齐铁权,苏俊坡,等. 低温弱光对不同砧木嫁接黄瓜幼苗生理特性的影响[J]. 西南大学学报(自然科学版),2008,30(10):68-72.
[17]张 琳,王甲辰,左 强,等. 外源钙对低温胁迫下番茄幼苗生化指标及膜伤害的研究[J]. 北方园艺,2011(12):24-26.
[18]刘铁铮,王献革,索相敏,等. 外源钙及钙离子抑制剂对杏扁雌蕊抗寒性的影响[J]. 吉林农业科学,2015,40(5):90-92,101.
[19]李益清,李天来. 外源钙及钙抑制剂对番茄耐弱光特性的调控作用[J]. 西北农业学报,2011,20(8):121-126.
[20]唐 征,荆赞革,张小玲,等. 外源Ca2+对青花菜幼苗低温弱光胁迫的缓解作用[J]. 贵州农业科学,2012,40(3):35-37.
