芝麻立枯病生防菌G10菌株生防特性分析
2018-05-30王俊芳
张 颖, 王俊芳
(河南大学生命科学学院,河南开封 475004)
由立枯丝核菌(Rhizoctoniasolani)引起的芝麻立枯病是一种严重的土传病害,广泛分布于各芝麻种植区[1]。目前,由于缺乏抗病芝麻品种,生产上主要通过施用化学杀菌剂控制该病害,导致药剂残留、病原菌产生抗药性、环境污染、芝麻种植成本提高与品质下降等状况发生[2],采用环保的生物防治技术替代传统的化学方法防治芝麻病害是目前芝麻种植中亟待解决的问题。
枯草芽孢杆菌(Bacillussubtilis)是一类广泛分布于自然环境中的革兰氏阳性细菌,大多数对植株、人、畜无害,且不污染环境,这类细菌因其能产生多种抑菌物质,且能形成耐热、耐酸碱和抗逆性强的芽孢,从而作为植物病害生防菌得到广泛的研究和应用[3-5]。在笔者前期研究工作中,从健康芝麻苗根部分离到1株对芝麻立枯病有显著防治效果的内生细菌,该菌株编号为G10,经鉴定为枯草芽孢杆菌[6]。为明确G10菌株在植物病害生物防治中的应用潜力,本研究分别测定pH值、温度、盐离子、紫外线等对其代谢产物抑菌效果的影响,以期为该菌生防制剂的研发提供科学依据。
1 材料与方法
1.1 供试材料及培养基
枯草芽孢杆菌G10菌株、立枯丝核菌菌株均由河南大学微生物实验室提供;G10菌株培养采用KBM培养基(2.00%蛋白胨、1.00%甘油、0.15% K2HPO4、0.15% MgSO4·7H2O、2.00%琼脂,121 ℃灭菌20 min)[7];立枯丝核菌培养采用马铃薯葡萄糖琼脂(PDA)培养基(200 g马铃薯、20 g葡萄糖、20 g琼脂、1 000 mL自来水)[8];生物膜测定使用LB培养基(1.0%蛋白胨、0.5%酵母提取物、1.0% NaCl、2.0%琼脂)和Landy培养基(2.00%葡萄糖、0.50%谷氨酸、0.50 g MgSO4、0.50 g KCl、1.00 g KH2PO4、0.15 mg Fe2SO4·6H2O、5.00 mg MnSO4·H2O、10.16 mg CuSO4·5 H2O,1 000 mL蒸馏水)。
1.2 试验方法
1.2.1 G10菌株代谢产物对立枯丝核菌生长半抑制有效浓度(EC50)的估算 将活化后的G10菌株培养物转接于KBM液体培养基中,每瓶培养基装液量为30 mL,于30 ℃、200 r/min 振荡培养48 h;将培养液离心,收集上清液,过滤,将无菌发酵液与温度不低于45 ℃的固体PDA培养基混合,分别配制成发酵液浓度为2%、5%、10%、20%、30%、40%等的培养基。将配制好的培养基倒平板,将活化后的立枯丝核菌打成6 mm菌饼,转接于平板中央;以不添加发酵液的PDA培养基为对照,30 ℃培养24 h,统计G10菌株代谢产物对立枯丝核菌的抑制率,公式如下:
抑菌率=[(对照菌落直径-处理菌落直径)/对照菌落直径]×100%。
1.2.2 G10菌株代谢产物浓缩液的制备及不同pH值对其抑制立枯丝核菌的影响 G10菌株无菌发酵液制备方法同“1.2.1”节,利用旋转蒸发仪将无菌上清液浓缩50%,将培养48 h后的生防菌代谢产物浓缩液分装入不同的管中,分别用乳酸和NaOH溶液调节浓缩液的pH值,使其pH值分别为1、2、3、4、5、10、11、12、13,4 ℃保存备用。
将活化的立枯丝核菌平板培养物打成菌饼,将菌饼置于PDA平板中央,在距离平板中央2 cm处对称放置4个牛津杯,分别取150 μL以上不同pH值的浓缩液,注入杯中;设只接立枯丝核菌的平板为空白对照1,相应pH值的无菌KBM液体培养基为空白对照2。30 ℃培养24 h,统计G10菌株代谢产物对立枯丝核菌的抑制率。对照2的抑菌率=[(对照1菌落直径-对照2菌落直径)/对照1菌落直径]×100%;生防菌发酵液抑菌率=[(对照2菌落直径-处理菌落直径)/对照2菌落直径]×100%。
1.2.3 不同温度处理后G10菌株代谢产物对立枯丝核菌的抑制作用 将“1.2.2”节中代谢产物浓缩液分装入不同的管中,将各管分别放入温度为-20、40、50、60、70、80、90、100 ℃的水浴锅中处理20 min;测定处理后的代谢产物对立枯丝核菌的抑制作用,方法同“1.2.2”节。以浓缩液不处理的板为对照,计算抑菌率,方法同“1.2.1”节。
1.2.4 不同盐离子条件下G10菌株代谢产物的抑菌作用 分别配制1 mol/L的CaCl2、NaCl、KCl、MgSO4、AlCl3、CuSO4溶液,将“1.2.2”节中代谢产物浓缩液分装入不同的管中,分别加入适量上述各盐溶液,使各管中的盐离子浓度为 20 mmol/L。测定处理后代谢产物的抑菌作用,方法同“1.2.2”节。以浓缩液不处理的板为对照,计算抑菌率,方法同“1.2.1”节。
1.2.5 不同紫外线剂量条件下G10菌株代谢产物对立枯丝核菌的抑制作用 将“1.2.2”节中浓缩液以5 mL/皿装入无菌培养皿内,3次重复,在20 W紫外灯下分别照射5、10、15、20、25、30 min,测定浓缩液的抑菌作用,方法同“1.2.2”节。以浓缩液不处理的板为对照,计算抑菌率,方法同“1.2.2”节。
1.2.6 G10菌株生物膜形成能力的测定
1.2.6.1 定性测定生物膜形成 将活化后的生防菌转接于装有30 mL KBM液体培养基的250 mL三角瓶中,在30 ℃、200 r/min摇床上振荡培养,培养至对数期。将对数期的生防菌菌悬液以10%的接种量分别转接于含有2 mL LB培养基和Landy培养基的5 mL玻璃试管中(直径为0.8 cm),23 ℃静置培养6 d,观察菌体在试管内的生长情况,定性测定生物膜的形成情况[9]。
1.2.6.2 结晶紫显色法测定生物膜的形成 取“1.2.6.1”节中长有生物膜的试管,小心吸出2 mL管中培养液,注意保持管壁生物膜的完好。滴加3 mL浓度为0.1%的结晶紫溶液,常温染色20 min。然后去除染液,加蒸馏水脱色3次。向管中加入2.5 mL乙醇、丙酮混合溶解液(乙醇、丙酮的体积比为8 ∶2),待生物膜溶解后,以溶解液作为对照,利用分光光度计测定570 nm处的吸光度(D570 nm)。重复10次。
1.3 数据分析
对试验数据进行方差分析、显著性检验和新复极差法多重比较。
2 结果与分析
2.1 生防菌代谢产物对立枯丝核菌的抑制作用
利用平板培养法检测不同浓度条件下G10菌株代谢产物对立枯丝核菌的抑制作用。由表1可知,随着代谢产物浓度的升高,抑菌率逐渐提高,不同浓度代谢产物的抑菌率差异显著(P<0.05)。
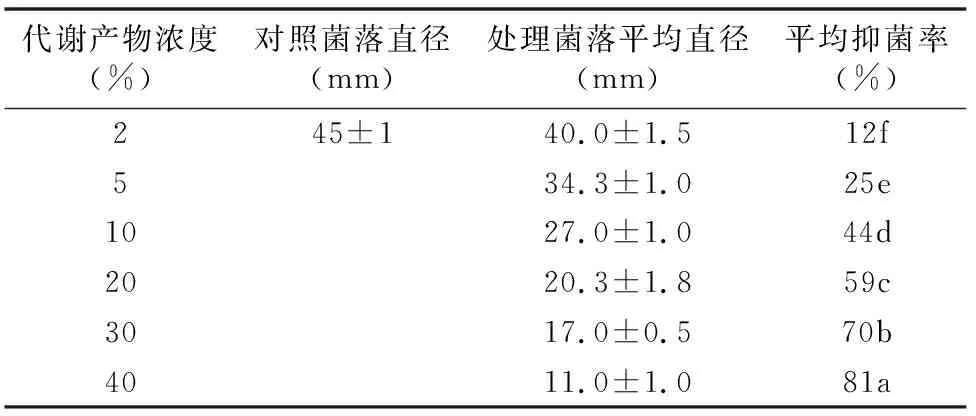
表1 不同浓度G10菌株代谢产物对立枯丝核菌的抑制作用
注:数据后不同小写字母表示差异显著(P<0.05)。
利用表1中数据进行线性回归分析,估算代谢产物的半抑制有效浓度,以抑制率作为横坐标X,并对抑菌率进行概率坐标转换,查表得转换数据(X′),以代谢产物浓度作为纵坐标Y,并对代谢产物浓度进行对数转换(Y′)。由图1可知,通过线性回归分析得回归方程Y′=0.646 0X′+1.103 3,r2=0.990 8。EC50处的抑制率为50%,相应的X′=0,Y′=12.68,在这种处理条件下,G10代谢产物对立枯丝核菌的半抑制有效浓度为12.68%。
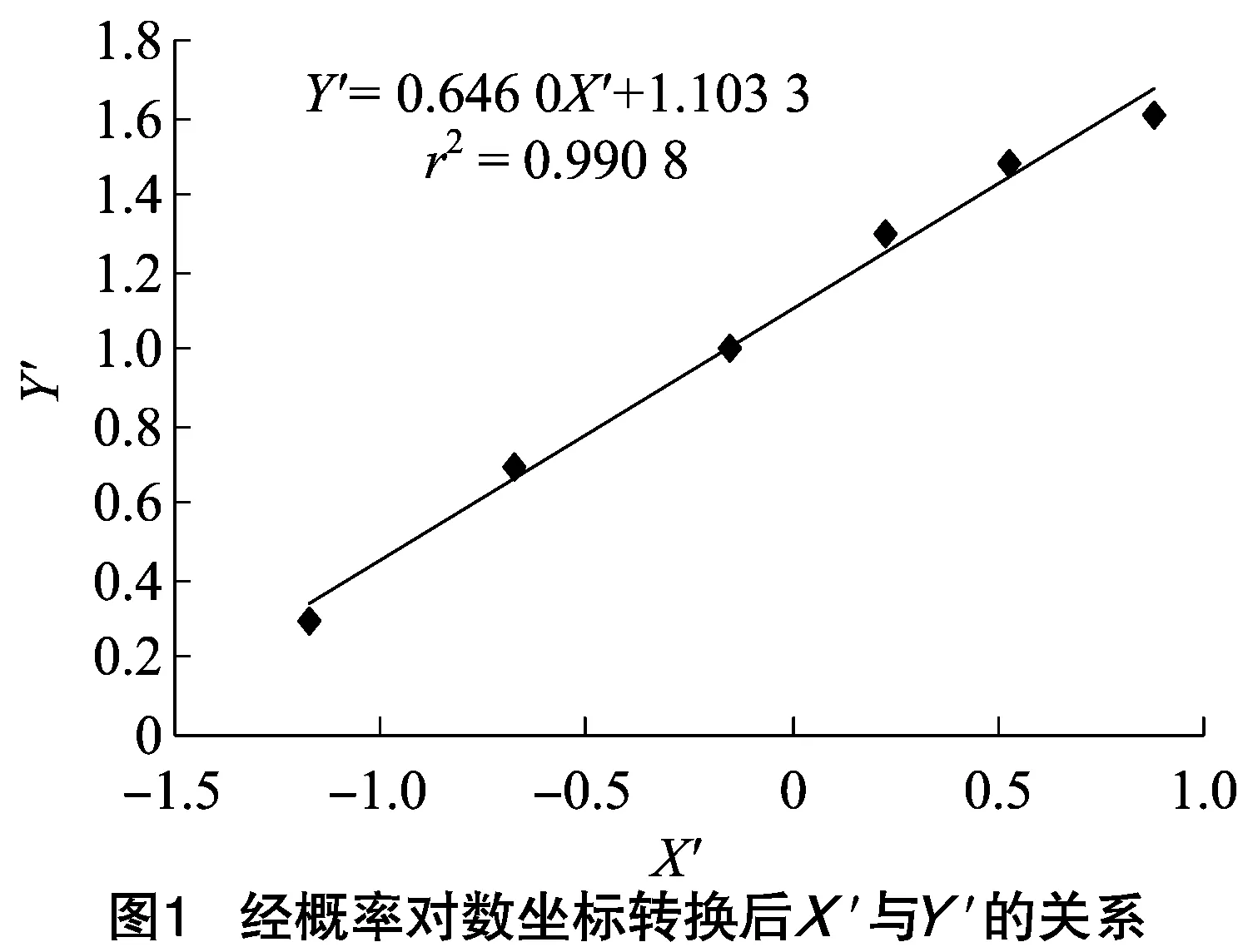
2.2 不同pH值条件下G10菌株代谢产物的抑菌作用
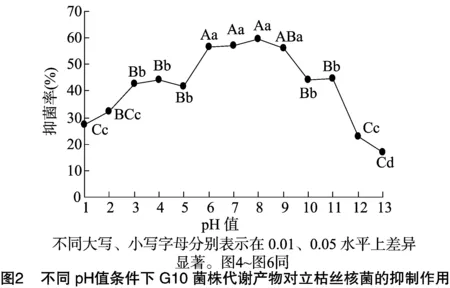
利用平板对峙培养法检测不同pH值条件下浓缩50%的G10菌株代谢产物及相应pH值条件下KBM培养基对立枯丝核菌的抑制作用。由图2可知,该菌代谢产物在pH值为 6~9 范围内稳定,发挥正常的抑菌作用;在pH值≤5及pH值≥10的条件下,其代谢产物的抑菌率逐渐下降。pH值为 6~9 时与pH值为10~13、1~4时的抑菌率,pH值为10~11、3~5时与pH值为12~13、1~2时的抑菌率差异达显著水平(P<0.05)。pH值为12时与pH值为13时的抑菌率差异显著(P<0.05)。
由图3可知,在pH值为4~10范围内立枯丝核菌可以正常生长;在pH值≤3及pH值≥11时,KBM培养基抑制立枯丝核菌的生长。
2.3 温度对G10菌株代谢产物抑菌作用的影响
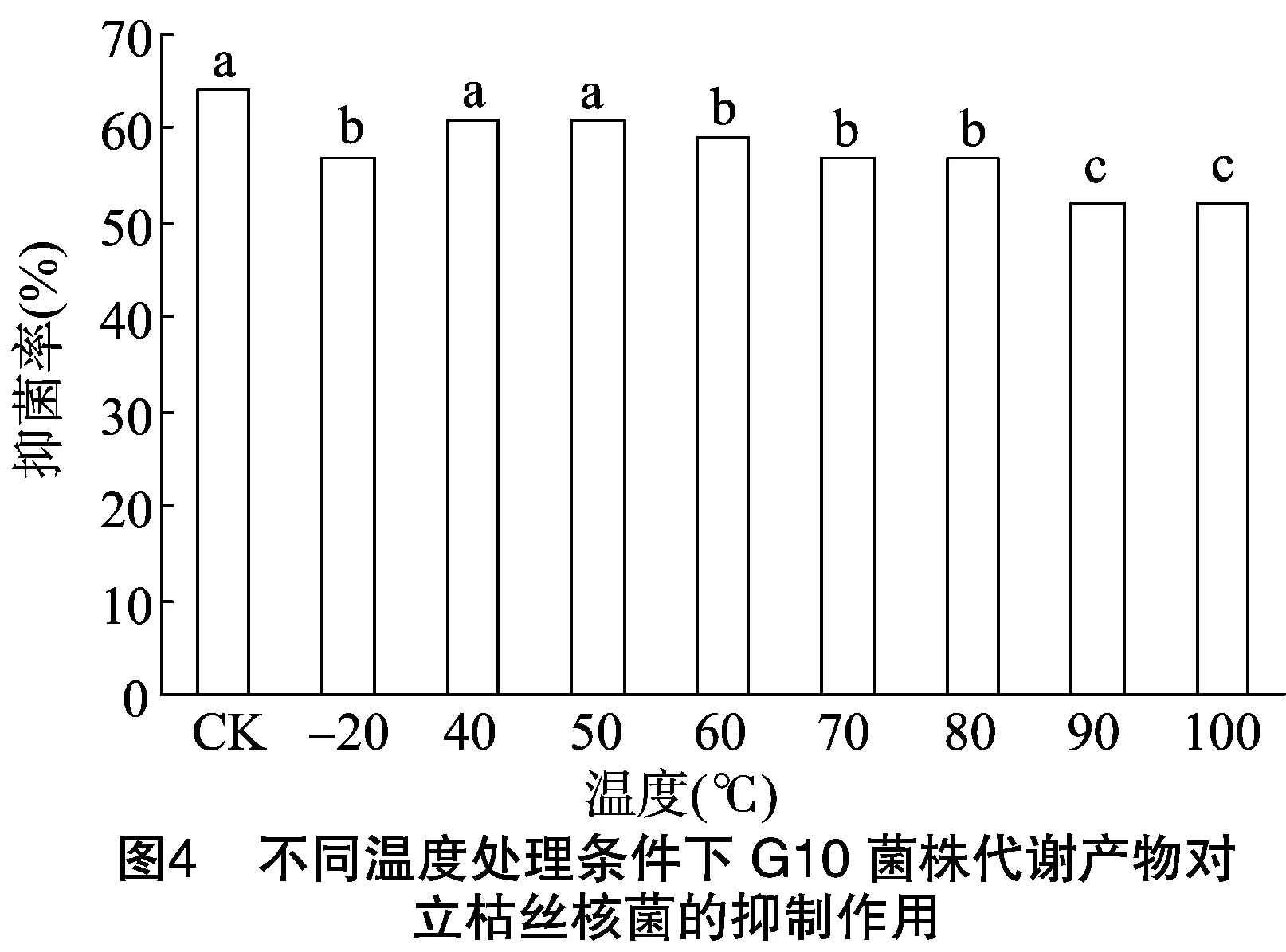
经不同温度处理G10菌株代谢产物浓缩物,用对峙培养法测定其代谢产物对立枯丝核菌的抑制作用。由图4可知,经40、50 ℃处理,G10菌株代谢产物的抑菌率与对照无显著差异,其他温度处理的G10菌株代谢产物的抑菌率与对照均差异显著(P<0.05); 80 ℃与90、100 ℃ 处理的G10菌株代谢产物的抑菌率差异显著。

2.4 不同盐离子对G10菌株代谢产物抑菌作用的影响
采用对峙培养法检测生防菌代谢产物在不同盐离子条件下对立枯丝核菌的抑制能力。由图5可知,对照与添加盐离子处理的发酵液的抑菌率差异极显著(P<0.01);添加NaCl、KCl、CaCl2、AlCl3与添加MgSO4、CuSO4的发酵液的抑菌率差异显著(P<0.05);添加NaCl、KCl、CaCl2、AlCl3的发酵液之间的抑菌率差异不显著,添加MgSO4、CuSO4的发酵液的抑菌率差异不显著。
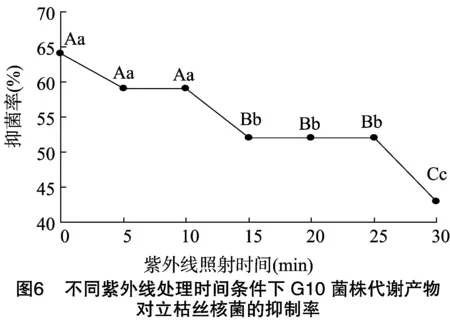
2.5 紫外线对G10菌株代谢产物抑菌作用的影响
生防菌代谢产物经不同时间的紫外线照射后,用牛津杯法测定G10菌株代谢产物对立枯丝核菌的抑制作用。由图6可知,对照与紫外线处理5、10 min与其他处理的发酵液抑菌率差异极显著(P<0.01);紫外线处理15、20、25 min与处理30 min的抑菌率差异极显著(P<0.01)。对照与紫外线处理5、10 min之间的抑菌率差异不显著; 紫外线处理15、20 min与处理25 min的抑菌率差异不显著。

2.6 G10菌株生物膜形成能力测定
测定内生菌形成生物膜的能力,将G10菌株分别接入LB和Landy液体培养基中进行培养。由图7可知,2管均形成生物膜,左管为LB培养基培养,右管为Landy培养基培养,其中Landy培养基内的生物膜相对较厚。利用结晶紫显色法测定G10菌株形成生物膜的能力,结果显示利用LB培养基培养时,该菌株形成的生物膜D570 nm平均值为1.125,利用Landy培养基培养时,D570 nm平均值为1.632。说明菌体在普通培养基内培养即可形成明显的生物膜,但不同营养条件下菌体产生生物膜的能力不同。

3 讨论与结论
利用平板培养法检测不同浓度条件下G10菌株代谢产物对立枯丝核菌的抑制作用,结果显示,随着G10菌株发酵液浓度的提高,抑菌率逐渐提高,不同浓度发酵液抑菌率差异显著(P<0.05);对试验数据进行线性回归分析,估算出G10代谢产物对立枯丝核菌的EC50为12.68%;G10菌株代谢产物在pH值为6~9范围内稳定,发挥正常的抑菌作用;在pH值 ≤5及pH值≥10时, 其代谢产物的抑菌率逐渐下降。该
菌代谢产物在40~50 ℃温度范围内抑菌率差异不显著,高于60 ℃时代谢产物抑菌率显著下降(P<0.05);研究显示几种盐离子对代谢产物的抑菌率均有一定的负作用;紫外线照射处理10 min内该菌代谢产物抑菌性能稳定,紫外线照射处理时间大于15 min时抑菌率逐渐下降。利用LB培养基培养时,菌株G10形成的生物膜D570 nm平均值为1.125,利用Landy培养基培养时,D570 nm平均值为1.632。有研究显示,生防菌生物膜的形成能力与其防效呈正相关[9-10]。内生细菌G10菌株为芽孢杆菌,利用其产芽孢的优势,相对耐受不良环境的能力强,结合以往关于该菌对芝麻立枯病生防的研究,该菌在芝麻苗根部定殖能力强,温室试验防效为80%,田间小区试验防效为61%;该菌株有作为生防制剂的开发潜力。
:
[1]Wahid O A R A. Resistance of some sesame(SesamumindicumL.)collections against root rot disease(RhizoctoniasolaniKühn)under field conditions[J]. Journal of Plant Protection Research,2007,47(3):321-327.
[2]Amaresan N,Jayakumar V,Kumar K,et al. Isolation and characterization of plant growth promoting endophytic bacteria and their effect on tomato (Lycopersiconesculentum) and chilli (Capsicumannuum) seedling growth[J]. Annals of Microbiology,2012,62(2):805-810.
[3]王 刚,沈永红,王俊芳,等. 蜡样芽孢杆菌B3-7菌株对小麦全蚀病菌的抑制作用[J]. 河南大学学报(自然科学版),2005,35(1):62-64.
[4]Qian S,Lu H,Meng P,et al. Effect of inulin on efficient production and regulatory biosynthesis of bacillomycin D inBacillussubtilisfmbJ[J]. Bioresource Technology,2015,179:260-267.
[5]Ryan R P,Germaine K,Franks A,et al. Bacterial endophytes:recent developments and applications[J]. FEMS Microbiology Letters,2008,278(1):1-9.
[6]王俊芳,王 淼,郭妍伟,等. 芝麻内生细菌G10菌株对芝麻立枯病的生防作用[J]. 北方园艺,2011(1):166-168.
[7]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001:120.
[8]沈 萍,陈向东. 微生物学实验[M]. 4版.北京:高等教育出版社,2007:142.
[9]Dogsa I,Oslizlo A,Stefanic P,et al. Social interactions and biofilm formation inBacillussubtilis[J]. Food Technology and Biotechnology,2014,52(2):149-157.
[10]Yang P,Sun Z X,Liu S Y,et al. Combining antagonistic endophytic bacteria in different growth stages of cotton for control ofVerticilliumwilt[J]. Crop Protection,2013,47(5):17-23.
