异质性万古霉素中介金黄色葡萄球菌的流行病学及其感染的临床特征
2018-05-30赵罗乐黄文祥李佳俊秦圆圆徐雅姝
赵罗乐, 黄文祥, 李佳俊, 秦圆圆, 徐雅姝
万古霉素一直作为治疗耐甲氧西林金黄色葡萄球菌(MRSA)的首选药物,但近年来有报道万古霉素对金黄色葡萄球菌的MIC值逐年上升,异质性万古霉素中介金黄色葡萄球菌(hVISA)的存在可能是其原因之一[1-2]。1997年,日本发现了第1株hVISA[3]。虽然万古霉素耐药金黄色葡萄球菌(VRSA)仍鲜见报道[4-5],但万古霉素中介金黄色葡萄球菌(VISA)和hVISA却越来越常见,给糖肽类药物的临床应用带来了巨大挑战。如今大量对于hVISA的研究都认为hVISA引起的菌血症持续时间长于普通MRSA感染,且更容易发生心内膜炎和骨髓炎,从而致患者住院时间延长、万古霉素治疗失败等问题[6-7]。但是否hVISA感染会使病死率增加还存在异议。本研究目的在于了解重庆医科大学附属第一医院hVISA流行状况,并分析其流行与临床特征之间的关系。
1 材料与方法
1.1 材料
1.1.1 菌株来源 本研究105株金黄色葡萄球菌均来自我院2012-2015年临床标本,按照保存菌种顺序编号。质控菌株为金黄色葡萄球菌ATCC 29213由本实验室保存,hVISA标准菌株Mu3和VISA标准菌株Mu50由王辉教授馈赠。
1.1.2 主要试剂和仪器 脑心浸液肉汤(BHI)和脑心浸液琼脂粉(BHIA)、胰蛋白胨大豆肉汤(TSB)购于青岛日水生物技术有限公司。盐酸万古霉素购于美仑生物技术有限公司,均于有效期内使用。仪器为法国生物梅里埃公司生产的螺旋涂布仪。
1.2 方法
采用回顾性分析研究方法,收集105例确认为金黄色葡萄球菌感染患者的临床资料,对其临床特征进行调查分析。
1.2.1 菌株鉴定 所有实验菌株触酶(+),血浆凝固酶(+),并采用VITEK 2-Compact全自动细菌鉴定仪进行生化鉴定并保存。根据美国临床与实验室标准化协会(CLSI)2016年版采用琼脂稀释法将对青霉素及头孢西丁耐药的金黄色葡萄球菌定义为MRSA。
1.2.2 VISA及hVISA初筛 采用琼脂稀释法对金黄色葡萄球菌进行初筛,以CLSI 2016年版规定判读:金黄色葡萄球菌对万古霉素MIC≤2 mg/L为敏感(VSSA),≥16 mg/L为耐药(VRSA),4~8 mg/L为中介(VISA)。
1.2.3 hVISA确认试验 采用目前国际上公认的金标准菌群曲线下面积(PAP-AUC)法对所有菌株进行筛检,将浓度为0.5麦氏浊度的菌液连续稀释为10-3和10-6浓度,并用螺旋涂布仪将3种浓度的菌液均接种于含不同浓度万古霉素(0.5、1、2、2.5、4和8 mg/L)的脑心浸液琼脂平皿上,在35 ℃孵箱中培养48 h后进行细菌计数。用Graphpad Prism软件绘制菌落log对数值对万古霉素浓度曲线并计算曲线下面积(AUC)。将同一批次中待测菌株AUC与阳性标准株Mu3的AUC进行比较,AUC待测菌株/AUCMu3<0.9判读为VSSA,0.9≤AUC待测菌株/AUCMu3<1.3则判读为 hVISA,AUC待测菌株/AUCMu3≥1.3 判读为 VISA[8]。
1.2.4 统计方法 年龄、住院时间等非正态分布资料采用秩和检验;临床转归、流行病学等计数资料采用卡方检验,采用SPSS 20.0软件进行统计学处理,以P<0.05为差异有统计学意义。
2 结果
2.1 筛检结果
2.1.1 琼脂稀释法检测结果 在所有实验菌株中,MRSA61株(占58.1%)。万古霉素对61株MRSA MIC值分布统计情况见图1。
2.1.2 hVISA筛检结果 PAP-AUC法从105株金黄色葡萄球菌中总共筛检出hVISA19株,占18.1%,其MIC值均在敏感范围(MIC≤2 mg/L,其中12株为1 mg/L,7株为2 mg/L);61株MRSA中hVISA的检出率为18.0%。PAP-AUC法从105株菌株中共检出VISA10株,检出率为9.5%。
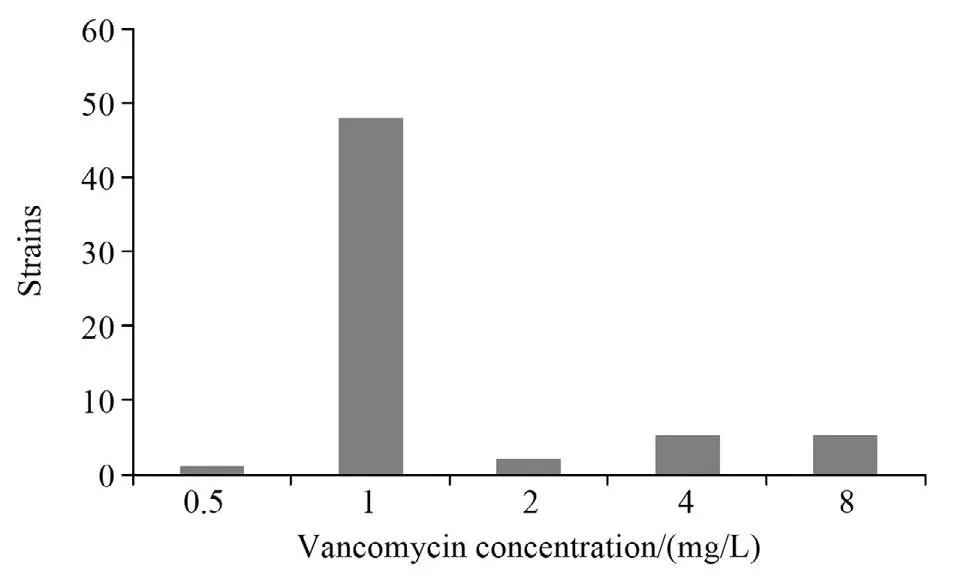
图1 万古霉素对61株MRSA MIC值分布图Figure 1 Distribution of vancomycin MIC values against 61 MRSA strains
2.2 临床特点
2.2.1 hVISA的临床特征 19例hVISA感染的患者中位年龄为61岁,其中13例(68.4%)为男性;9例(47.4%)有基础疾病;11例(57.9%)有合并症。菌株大多来自血培养(6株31.6%)和伤口分泌物(6株31.6%);19株hVISA中MRSA 11株(57.9%);19例hVISA感染的患者中来自社区感染的有11例(57.9%),来自医院感染的8例(42.1%)。19株hVISA菌株对应的患者临床特征见表1。
2.2.2 VISA的临床特征 10例VISA感染的患者中位年龄为62岁,其中7例(70.0%)为男性;5例(50.0%)有基础疾病;8例(80.0%)有合并症;1例死亡。标本来自血培养3份(30.0%)和痰液4份(40.0%);10株VISA中MRSA 8株(80.0%)。10例VISA感染患者中来自社区感染4例(40.0%),来自医院感染6例(60.0%)。10株VISA对应的患者临床特征见表1。
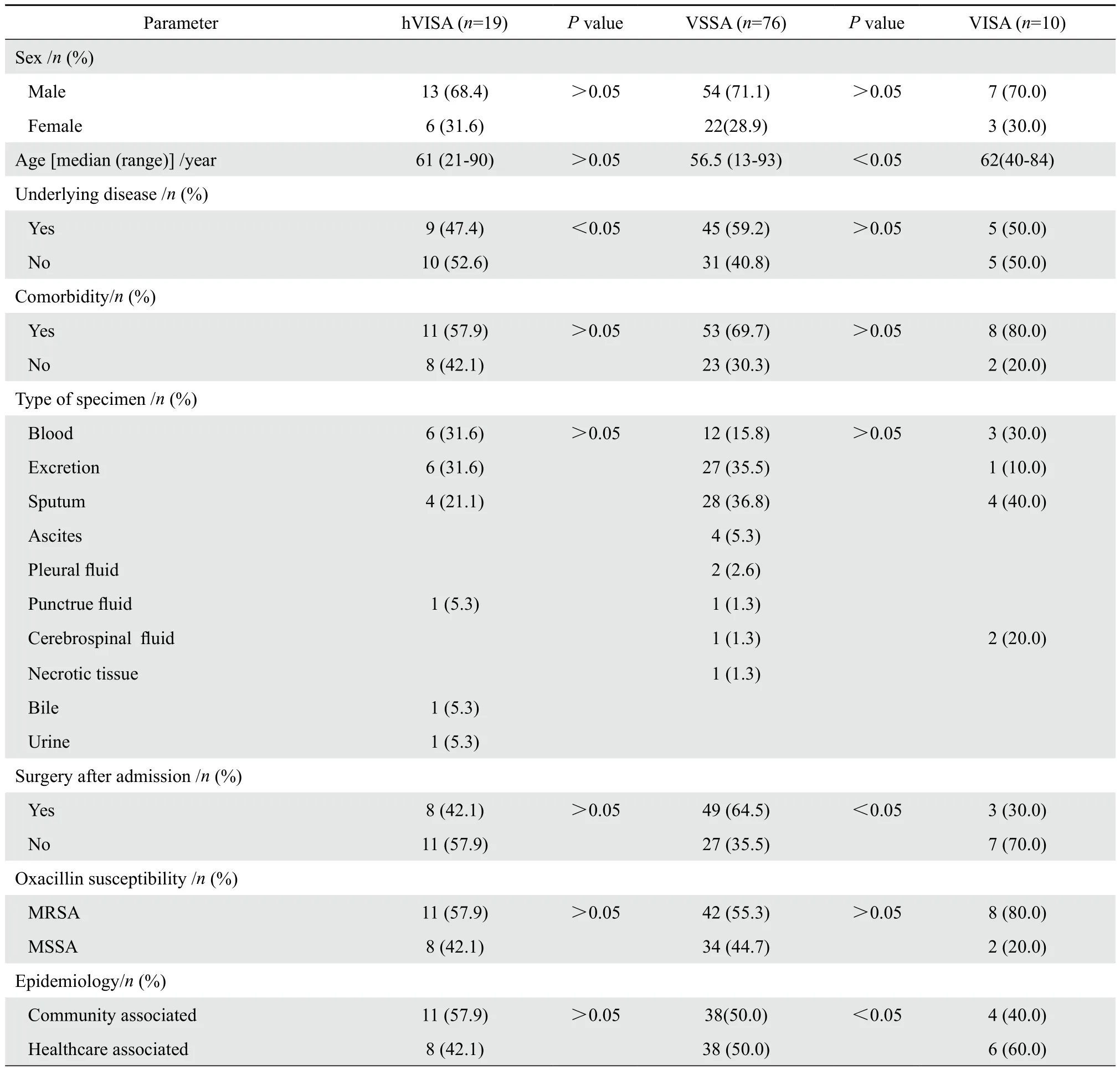
表1 105例金黄色葡萄球菌感染患者的临床资料Table 1 Clinical characteristics of 105 cases of Staphylococcus aureus infection
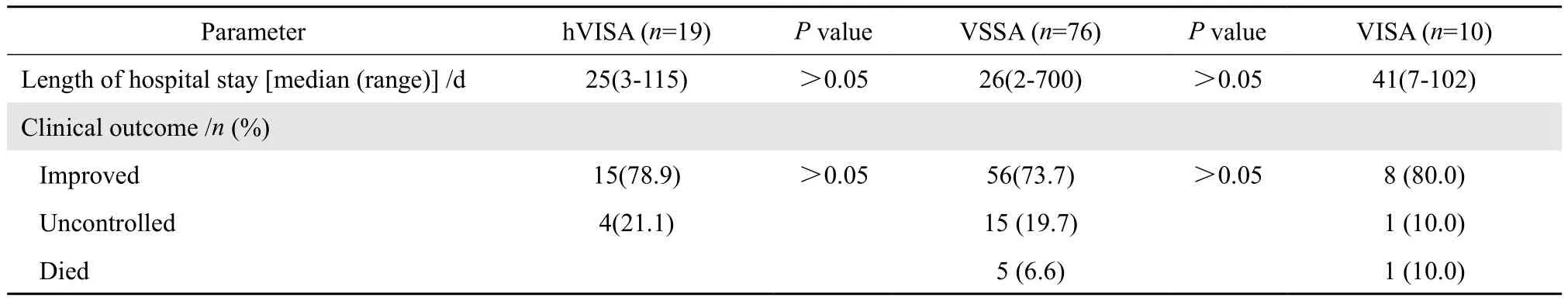
表1(续)Table 1(continued)
2.2.3 菌株流行特征 105例金黄色葡萄球菌感染患者中46例来自于重庆主城区,59例来自于周边区县。105例中医院感染52例,其中MRSA感染36例,医院感染中MRSA检出率为69.2%;社区感染53例,其中MRSA感染25例,社区感染中MRSA检出率为47.2%;医院感染中MRSA检出率大于社区感染中MRSA的检出率,且差异有统计学意义(P<0.05)。社区感染中hVISA 11株,检出率为20.8%,医院感染中hVISA 8株,检出率为15.4%,两者差异无统计学意义(P>0.05)。61株MRSA中hVISA 11株,检出率为18.0%,44株MSSA中hVISA 8株,检出率为18.2%,两者差异无统计学意义(P>0.05)。
2.2.4 临床转归及住院时间 采用卡方检验分析发现hVISA与非hVISA感染患者临床转归差异无统计学意义(P>0.05);VISA与非VISA感染患者临床转归差异也无统计学意义(P>0.05)。采用秩和检验分析发现hVISA与非hVISA感染患者住院时间差异无统计学意义(P>0.05);VISA与非VISA感染患者住院时间差异也无统计学意义(P>0.05)。
3 讨论
近年来,由于万古霉素的大量使用致金黄色葡萄球菌对万古霉素的敏感率逐渐下降,hVISA的检出率逐年增多。hVISA和VISA已在多个国家广泛流行,但各个国家各种标本的检出率不尽相同。美国hVISA检出率0.3%~15.0%[9-10],日本一项报告表明MRSA中hVISA的检出率为16.5%[11]。中国局部地区也有过相关报道,但各个地区报道差异也较大。2004年一项报告中国某地hVISA检出率为14.3%[12],我国台湾研究显示在MRSA中hVISA的检出率为10.0%,VISA的检出率为2.7%[13]。本研究共纳入105株菌株,通过PAP-AUC法检出hVISA19株,阳性率为18.1%;检出VISA10株,检出率为9.5%。另外,标准的琼脂稀释法检出MRSA 61株,检出率58.1%;MRSA中hVISA的检出率为18.0%,VISA的检出率为13.1%,均略高于中国其他地区检出水平。且以往报道的hVISA多来自于医院感染中的MRSA,而本次研究发现我院社区感染中hVISA的检出率以及MSSA中的检出率也同样较高,这使得本院万古霉素的临床应用面临更大的挑战。
本次研究发现万古霉素对MRSA的MIC值大多仍处于敏感范围。虽然近年并没有进一步发现万古霉素MIC值漂移的报道,但万古霉素MIC值与VISA和hVISA流行情况的关系还没有完全阐明。一项研究发现在51岁以上年龄组中hVISA检出率逐年下降,而该组万古霉素血药峰谷水平较hVISA高检出率组均有上升,这表明菌株暴露在低水平的万古霉素浓度下会产生耐药亚群[14]。老年患者更容易产生hVISA感染和万古霉素MIC值≥2 mg/L,可能是因为老年患者存在更多暴露于医疗机构的次数,以及先前的万古霉素治疗使得暴露于低水平的万古霉素的机会较多。在一项体外模型中也发现给予MRSA菌株的MIC值同等浓度的万古霉素和略高浓度的万古霉素时会诱导hVISA和VISA的产生,并导致万古霉素MIC值增高[15]。因此,如果在治疗时加大万古霉素剂量,使得万古霉素血药浓度升高,可能会减少万古霉素治疗失败的可能性,也可能会进一步减少hVISA的产生。但这还需更多相关研究加以说明。
Horne等[16]研究结果显示hVISA组与MRSA组治愈率无统计学差异。我国台湾一项研究通过比较MRSA中低万古霉素MIC值的VSSA(<1.5 mg/ L)、高万古霉素MIC值的VSSA(>1.5 mg/ L)和高万古霉素MIC值的hVISA三组患者的临床转归,发现在对万古霉素敏感的患者中,万古霉素MIC值较高的患者有更高的30 d病死率。因此,虽然hVISA可以引起菌血症持续时间延长等,但并不能解释高万古霉素MIC值的患者拥有高死亡率的原因[17]。本研究通过对临床资料分析发现hVISA和VISA组与普通阴性株组在住院时间和临床转归上差异均无统计学意义(P>0.05)。一些研究表明金黄色葡萄球菌在获得万古霉素耐药的同时会伴随其适应性、传染性及毒力的下降,这或许可以解释hVISA感染并未引起患者病死率增加的原因[18]。但这个结果仅用于解释本研究,这可能是由于研究规模较小,标本来源于血流感染的例数较少,且患者感染情况大多较轻,如果加大样本量不排除可能发现病死率增加等问题。因此,将来的研究需要考虑大量的PAP-AUC分析来说明。
现已有专家开始探索用于治疗这类万古霉素敏感性下降的金黄色葡萄球菌感染,如利奈唑胺、达托霉素、特地唑胺、特拉万星等[19-20],但临床疗效证据的不足、安全性的风险、价格昂贵、国内无药等问题还有待解决,万古霉素仍然是治疗MRSA感染的“最终选择”。采用适当剂量万古霉素联合其他药物治疗仍然是相对经济、安全的选择。而对万古霉素敏感性下降的金黄色葡萄球菌尤其是hVISA的不断出现将为临床治疗金黄色葡萄球菌感染带来极大困扰。本地区hVISA和VISA检出率均较高,更应该加强临床万古霉素使用的管理,做好万古霉素治疗感染时血药浓度监测。
本研究仍存在一些不足,首先,本研究仅纳入本院105株菌株,标本量不够大可能会影响结果。之后可以进一步收集重庆各个地区三甲及基层医院的各种标本,扩大标本量和地区范围。因PAPAUC法作为现在hVISA筛检的“金标准”操作起来比较费时费力,很难在医院常规实验室展开,也急需找到一种能快速有效检测hVISA和VISA的新方法。近期研究表明通过基质辅助激光解吸电离飞行时间质谱的方法可以成功检测hVISA和VISA,且准确性相对较高[21]。但其特异度、灵敏度及是否能够真正应用于临床还需大量数据和进一步研究来说明。其次,本次收集的临床资料中不包括对万古霉素的血药浓度监测,因为临床上并非每个应用了万古霉素的患者均进行了该项监测,但研究表明细菌扑灭的决定因素之一是万古霉素的峰谷水平而并非MIC值[22]。所以监测万古霉素浓度对MRSA及hVISA临床疗效的研究有重大意义。
[1] KLEVENS RM, MORRISON MA, NADLE J, et al. Invasive methicillin resistantStaphylococcus aureusinfections in the United States[J]. JAMA, 2007, 298(15):1763-1771.
[2] SAKOULAS G,MOELLERING RC JR. Incrasing antibiotic resistance among methicillin-resistantStaphylococcus aureusstrains[J]. Clin infect Dis, 2008, 46(Suppl 5): s360-s367.
[3] HIRAMATSU K, ARITAKA N, HANAKI H, et al.Dissemination in Japanese hospitals of strains ofStaphylococcus aureusheterogeneously resistant to vancomycin[J]. Lancet,1997,350(9092):1670-1673.
[4] LIMBAGO BM, KALLEN AJ, ZHU W,et al. Report of the 13th vancomycin-resistantStaphylococcus aureusisolate from the United States[J]. Clin Microbiol, 2014, 52(3):998-1002.
[5] FRIAES A, RESINA C, MANUEL V, et al. Epidemiological survey of the first case of vancomycin-resistantStaphylococcus aureusinfection in Europe[J]. Epidemiol Infect, 2015, 143(4):745-748.
[6] MAOR Y, HAGIN M, BELAUSOV N, et al. Clinical features of heteroresistant vancomycin-intermediateStaphylococcus aureusbacteremia versus those of methicillin-resistantS. aureusbacteremia[J]. J Infect Dis,2009,199(5):619-624.
[7] HOWDEN BP, WARD PB, CHARLES PG, et al. Treatment outcomes for serious infections caused by methicillinresistantStaphylococcus aureuswith reduced vancomycin susceptibility[J]. Clin Infect Dis,2004,38(4):521-528.
[8] WOOTTON M, HOWE RA, HILLMAN R, et al. Amodified population analysis profile (PAP) method to detect heteroresistance to vancomycin inStaphylococcus aureusin a UK hospital[J]. J Antimicrob Chemother,2001,47(4):399-403.
[9] SATOLA SW,FARLEY MM,ANDERSON KF,et al. Comparison of detection methods for heteroresistant vancomycin-intermediateStaphylococcus aureus, with the population analysis profile method as the reference method[J]. J Clin Microbiol,2011,49(1):177-183.
[10] RICHTER SS,SATOLA SW,CRISPELL EK,et al.Detection ofStaphylococcus aureusisolates with heterogeneous intermediate-level resistance to vancomycin in the United States[J]. J Clin Microbiol,2011, 49(12):4203-4207.
[11] HANAKI H, CUI L, IKEDA-DANTSUJI Y, et al. Antibiotic susceptibility survey of blood-borne MRSA isolates in Japan from 2008 through 2011[J]. J Infect Chemother, 2014, 20(9):527-534.
[12] 马筱玲,王敬华,李华,等. 异质性万古霉素耐药葡萄球菌分离及生物学特征性观察[J]. 中华微生物学和免疫学杂志,2004,24(7):583-586
[13] HUANG SH, CHEN YC, CHUANG YC,et al. Prevalence of vancomycin-intermediateStaphylococcus aureus(VISA) and heterogenous VISA among methicillin-resistantS. aureuswith high vancomycin minimal inhibitory concentrations in Taiwan:A multicenter surveillance study,2012-2013[J]. J Microbiol Immunol Infect,2016,49(5):701-707.
[14] KHATIB R,SHARMA M, JOHNSON LB, et al. Decreasing prevalence of isolates with vancomycin heteroresistance and vancomycin minimum inhibitory concentrations≥2mg/L in methicillin-resistantStaphylococcus aureusover 11 years:potential impact of vancomycin treatment guidelins[J]. Diagn Microbiol Infect Dis, 2015,82(3):245-248
[15] KHATIB R, JOSE J, JOHNSON LB, et al. An optimal method for generating stable vancomycin heteroresistance and intermediate susceptibility in methicillin resistantStaphylococcus aureusblood isolates under in-vitro vancomycin pressure[J]. J Microbiol Infect Dis, 2015, 2(4):129-134.
[16] HORNE KC, HOWDEN BP, GRABSCH EA, et al.Prospective comparison of the clinical impacts of heterogeneous vancomycin-intermediate methicillin-resistantStaphylococcus aureus(MRSA) and vancomycin-susceptible MRSA[J].Antimicrob Agents Chemother, 2009,53(8):3447-3452.
[17] WANG JL,LAI CH,LIN HH, et al. High vancomycin minimum inhibitory concentrations with heteroresistant ancomycin-intermediateStaphylococcus aureusin meticillinresistantS. aureusbacteraemia patients[J]. Int J Antimicrob Agents, 2013, 42(5):390-394.
[18] GAO W, CAMERON DR, DAVIES JK, et al. The RpoB H481Y rifampicin resistance mutation and an active stringent response reduce virulence and increase resistance to innate immune responses inStaphylococcus aureus[J]. J Infect Dis,2012, 207(6):929-939.
[19] SZABÓ J. hVISA/VISA : diagnostic and therapeutic problems[J]. Expert Rev Anti Infect Ther, 2009,7(1):1-3.
[20] RODVOLD KA, MCCONEGHY KW. Methicillin-resistantStaphylococcus aureustherapy : past, present, and future[J].Clin infec Dis,2014,58(Suppl 1):s20-s27.
[21] MATHER CA, WERTH BJ, SIVAGNANAM S,et al. Rapid Detection of vancomycin-intermediateStaphylococcus aureusby matrix-assisted laser desorption ionization–time of flight mass spectrometry[J]. J Clin Microbiol,2016,54(4):883-890.
[22] FORSTNER C, DUNGL C, TOBUDIC S, et al. Predictors of clinical and microbiological treatment failure in patients with methicillin-resistantStaphylococcus aureus(MRSA)bacteraemia: a retrospective cohort study in a region with low MRSA prevalence[J]. Clin Microbiol Infect, 2013, 19(7):E291-E297.
