硫酸化焙烧氧化锰矿浸出锰的循环工艺
2018-05-30张泽强孙桦林张汉泉李冬莲何东升
张泽强,孙桦林,张汉泉,李冬莲,何东升
硫酸化焙烧氧化锰矿浸出锰的循环工艺
张泽强,孙桦林,张汉泉,李冬莲,何东升
(武汉工程大学 兴发矿业学院,湖北 武汉,430073)
为降低氧化锰矿处理成本,有效利用电解金属锰产生的废酸,采用硫酸铵循环利用工艺,进行氧化锰矿硫酸化焙烧—浸出试验。研究结果表明:硫酸钠对氧化锰矿硫酸化焙烧及硫酸铵分解有较好的促进作用。当焙烧温度为500 ℃时,锰浸出率较高,而三氧化二铁很难转化为可溶性硫酸亚铁,浸出液中铁杂质含量低,锰选择性浸出效果较好。在适宜的焙烧和浸出工艺条件下,通过硫酸化焙烧和浸出,锰浸出率可达89.93%,NH4+回收率可达98.62%,SO42−回收率可到88.22%。
氧化锰;硫酸化焙烧;热力学分析;循环利用
中国锰矿资源绝大部分是含锰在25%(质量分数)以下的低品位锰矿,需分选富集后才能有效利用[1−2]。对矿物组分复杂、嵌布粒度微细、共生关系密切的低品位难选锰矿,化学分选是最有效的处理方法[3−4]。尤其是难选氧化锰矿,锰主要以二氧化锰的形式存在,其化学性质稳定,难以直接用酸或碱浸出[5−6]。研究高效的氧化锰矿化学处理工艺,对充分利用氧化锰矿资源具有重要意义。许多研究者已对氧化锰矿的还原浸出工艺进行了探讨,包括用不同还原剂直接进行还原酸浸或先还原焙烧后再用酸浸等[7−11]。还原酸浸法中虽然锰浸出率较高,但选择性较差,铁等杂质也容易随之浸出,既消耗浸出试剂,也增加了浸出液除杂质的负担[12−13]。为此,一些研究者[14−17]尝试以二氧化硫和硫酸铵等作为焙烧试剂,对氧化锰矿进行硫酸化焙烧,使其中的二氧化锰转化为水溶性硫酸锰;再用水浸出烧渣,可得到杂质含量较低的硫酸锰浸出液。用传统的电解技术,可由浸出液直接生产金属锰或电池级二氧化锰。然而,现有氧化锰矿化学处理工艺中化学试剂不能有效循环利用,因而成本较高,难以实际应用[18]。同时,电解金属锰后产出的废酸,通常需要用碱中和处理,不仅废酸无法回收利用,也增加了处理成本[19]。为降低氧化锰矿的化学处理成本,解决电解废酸的利用问题,本文作者提出1种循环利用化学试剂处理难选氧化锰矿的工艺。从热力学的角度,探究氧化锰矿硫酸化焙烧的主要反应过程,并对焙烧浸出锰和循环利用化学试剂的主要工艺参数进行优化。
1 实验
1.1 实验原料
实验用锰矿原料取自广西大新锰矿区,粒径在0.074 mm以下的颗粒质量分数为80.31%,其主要成分化学分析和锰物相分析结果分别如表1和表2所示。

表1 氧化锰矿主要成分化学分析(质量分数)

表2 氧化锰矿锰物相组成
由表1和表2可知:该锰矿的锰质量分数较低,仅为17.89%。其中氧化锰中的锰占93.85%,碳酸盐中的锰占0.84%,属矿石中可以提取的锰。其余硅酸盐中的锰占4.97%,属难以提取的锰。
工艺矿物学研究表明:矿石中锰矿物主要是软锰矿和硬锰矿,结晶程度较差,多呈隐晶质集合体或页片状集合体产出;可见集合体较大粒径为0.300 mm,较小粒径为0.005 mm,一般粒径范围为0.050~ 0.100 mm;铁矿物主要为赤铁矿和褐铁矿,多呈微细状分布在锰矿物集合体中,粒径范围为0.010~ 0.050 mm;其他脉石矿物以石英和长石为主,为酸性造渣组分,还有少量方解石和菱镁石,为碱性耗酸组分。由于锰矿物嵌布粒度细,与杂质矿物共生关系密切,因此,难以用物理方法分选。
1.2 实验原理及热力学分析
TAWIL等[20]的研究表明,以硫酸铵作为硫酸化焙烧试剂,进行氧化锰矿的硫酸化焙烧,实质上也是还原焙烧。硫酸铵在焙烧过程中分解出还原性较强的三氧化硫,而二氧化锰有较强的氧化性,可与三氧化硫发生氧化还原反应,进而被还原转化为水溶性的硫酸锰。添加硫酸钠可以促使硫酸铵分解出氨,不仅有利于氨的循环利用,也有利于氧化锰矿的硫酸化焙烧。焙烧过程涉及的主要化学反应及其热力学计算结果如表3所示[21−23]。
通过以上热力学分析可知,用硫酸铵进行氧化锰矿的硫酸化焙烧,二氧化锰和硫酸钠均可促使硫酸铵分解。硫酸钠作为促进剂的作用机理如下:首先促使硫酸铵分解出氨,并生成焦硫酸钠(见反应4);然后焦硫酸钠再与氧化锰矿反应,使二氧化锰转化为可溶性的硫酸锰,焦硫酸钠则转化成硫酸钠(见反应5);通过这2个反应不断循环,在促使硫酸铵分解出氨的同时,也使二氧化锰转化为硫酸锰。锰矿中钙镁碱性脉石组分的存在,不可避免地会消耗一定量的焙烧试剂。控制焙烧温度低于557 ℃,可以阻止三氧化二铁与硫酸铵反应生成可溶性硫酸亚铁,从而阻止铁的浸出,改善锰的选择性浸出效果。
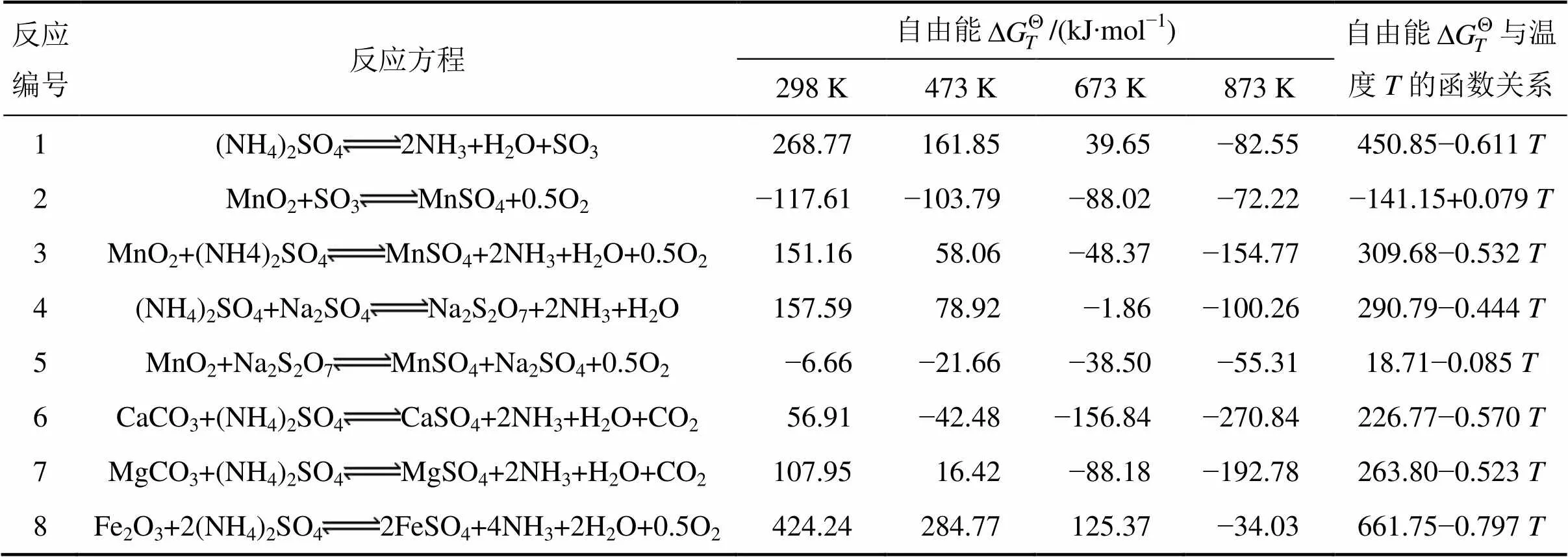
表3 焙烧过程可能发生的反应及自由能
1.3 实验方法
每次实验取50 g锰矿样品,将焙烧试剂与锰矿样品按配料比混合均匀,置于瓷方舟中一并放入管式焙烧炉内,在恒定温度下焙烧一定时间。焙烧过程中管式炉一端密封,另一端依次连接洗气瓶、流量计和抽滤机。洗气瓶内盛有硫酸浓度为0.02 mol/L的吸收液,用于模拟电解废酸液,进行氨的吸收和废酸中和实验。氨通过抽滤机产生的负压引入吸收液中。调整流量计的流量阀可以控制抽气流量。焙烧结束后,将烧渣置于锥形瓶中,按液固质量比4:1加入水,在28 ℃左右搅拌浸出50 min,然后过滤得到浸出液和浸渣。通过测定浸出液和浸渣中的锰、铁质量分数,计算浸出液中锰和铁的浸出率。测定浸出液和吸收液中的NH4+质量分数,计算NH4+回收率。测定浸出液中的SO42−质量分数,计算SO42−回收率。
2 结果及讨论
2.1 焙烧浸出锰实验
焙烧过程控制抽气流量为0.35 L/min,主要考查焙烧温度、焙烧时间、配料比和硫酸钠促进剂对焙烧浸出锰效果的影响。
2.1.1 焙烧温度的影响
焙烧温度对锰浸出率的影响如图1所示。实验条件如下:焙烧试剂为硫酸铵,焙烧时间为100 min,配料比为1.0。由热力学分析可知,硫酸铵与二氧化锰的反应在309 ℃以上可自发进行。但当焙烧温度较低时,二氧化锰转化为硫酸锰的反应动力学速度较慢、转化率不高,锰浸出率较低。随着焙烧温度提高,反应动力学速度加快,锰浸出率逐渐提高。当焙烧温度达到500 ℃时,锰浸出率高达84.26%,而三氧化二铁难与硫酸铵反应生成硫酸亚铁,因而铁浸出率较低,只有11.61%。当焙烧温度超过557 ℃后,由于三氧化二铁与硫酸铵反应活性增强,铁浸出率随之提高,硫酸化焙烧浸出锰的选择性变差,对选择性浸出锰不利。由此可见,要获得较好的选择性浸出锰的效果,焙烧温度控制在500 ℃为宜。

1—Mn;2—Fe。
2.1.2 焙烧时间的影响
焙烧时间对选择性浸出锰的影响如图2所示。实验条件如下:用硫酸铵作焙烧试剂,焙烧温度为 500 ℃,配料比为1.0。由图2可知:随着焙烧时间延长,锰和铁的浸出率都逐渐提高。但由于锰矿中铁主要为三氧化二铁,在500 ℃时难以与硫酸铵反应,可溶性铁较少,因而铁总体浸出率较低,不超过19%。当焙烧时间为100 min时,锰浸出率较高。超过100 min后,锰浸出率开始降低,而铁浸出率有所提高,故适宜的焙烧时间为100 min。

1—Mn;2—Fe。
2.1.3 配料比和促进剂的影响
保持焙烧温度为500 ℃、焙烧时间为100 min,分别以硫酸铵及等摩尔比的硫酸铵与硫酸钠混合试剂作为焙烧试剂,考查配料比和促进剂对锰浸出率的影响,所得结果如图3所示。由图3可知:随着配料比增大,锰浸出率逐渐提高。但配料比达到1.2后,锰浸出率随配料比增大而提高的效果已不明显,故配料比以1.2为宜。硫酸钠促进剂对锰浸出率影响较明显,在同样配料比条件下,加入硫酸钠可使锰浸出率提高5%~12%。
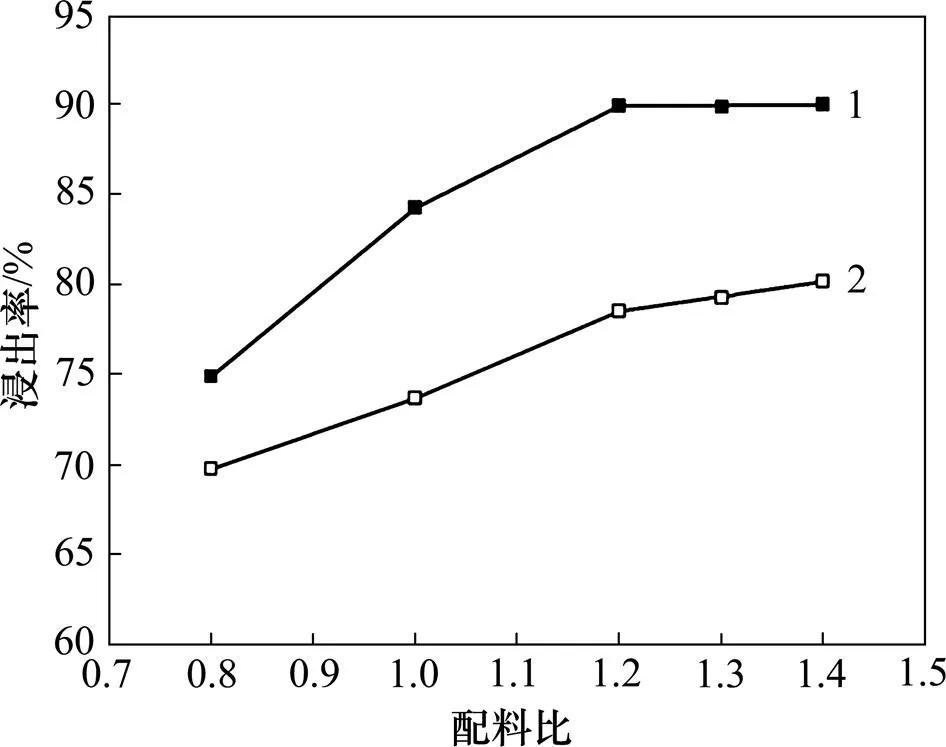
1—加硫酸钠;2—不加硫酸钠。
2.2 NH4+和SO42−回收实验
优化后的硫酸化焙烧工艺条件如下:焙烧试剂为硫酸铵和硫酸钠,焙烧温度为500 ℃,焙烧时间为 100 min,配料比为1.2。对回收NH4+和SO42−进行循环利用的可行性进行实验探讨,所得实验结果如表4所示。在实验过程中,焙烧产生的氨采用两段吸收工艺回收。由表4可知:在硫酸化焙烧过程中,抽气流量对硫酸铵分解及氨吸收有一定影响。当抽气流量为0.25 L/min时,硫酸铵分解不完全,残留在烧渣中的硫酸铵相对较多,因而进入浸出液中的NH4+也较多(达9.62%)。当抽气流量为0.35~0.50 L/min时,硫酸铵分解及氨吸收效果较好,吸收液中NH4+的回收率可达93%以上,NH4+的总回收率在98%以上。当抽气流量达到1.00 L/min时,少量氨会因吸收不完全而损失,因此NH4+的总回收率减小(只有95.33%)。浸出液中SO42−的回收率不高,平均为88.26%。说明当硫酸化焙烧时钙镁碱性脉石组分会消耗部分SO42−,生成难溶于水的硫酸盐残留在烧渣中,影响SO42−的回收和循环利用。

表4 NH4+和SO42−回收结果
2.3 硫酸盐溶析结晶实验
利用硫酸铵和硫酸钠难溶于乙醇的特性,用等摩尔比的硫酸铵和硫酸钠混合,配成不同浓度的硫酸盐溶液,模拟用氨中和电解废酸液得到的尾液,进行从溶液中溶析结晶硫酸铵和硫酸钠的实验。实验过程如下:将一定浓度的硫酸盐溶液,按一定体积比加入到无水乙醇中,搅拌混匀后再静置8 h,然后用过滤的方法将混合液中析出的硫酸盐晶体分离出来。测定混合液中剩余的SO42−质量分数,可计算出硫酸盐的析出率。实验结果表明:结晶温度低,硫酸盐浓度高,无水乙醇较多时,对硫酸盐结晶析出有利。将硫酸盐溶液加入到无水乙醇中的溶析效果比将无水乙醇加入到硫酸盐溶液中的溶析效果要好。在25 ℃,无水乙醇与硫酸盐溶液体积比为1.0的条件下,将不同浓度的硫酸盐溶液加入到无水乙醇中,获得的溶析结晶实验结果如图4所示。由图4可知:当溶液中硫酸盐质量浓度达到300 g/L时,将近90%(质量分数)的硫酸铵和硫酸钠都可结晶析出,循环用于氧化锰矿的硫酸化焙烧。混合液中的乙醇可用焙烧余热蒸馏回收循环使用,水溶液可返回用于从烧渣中浸出锰。
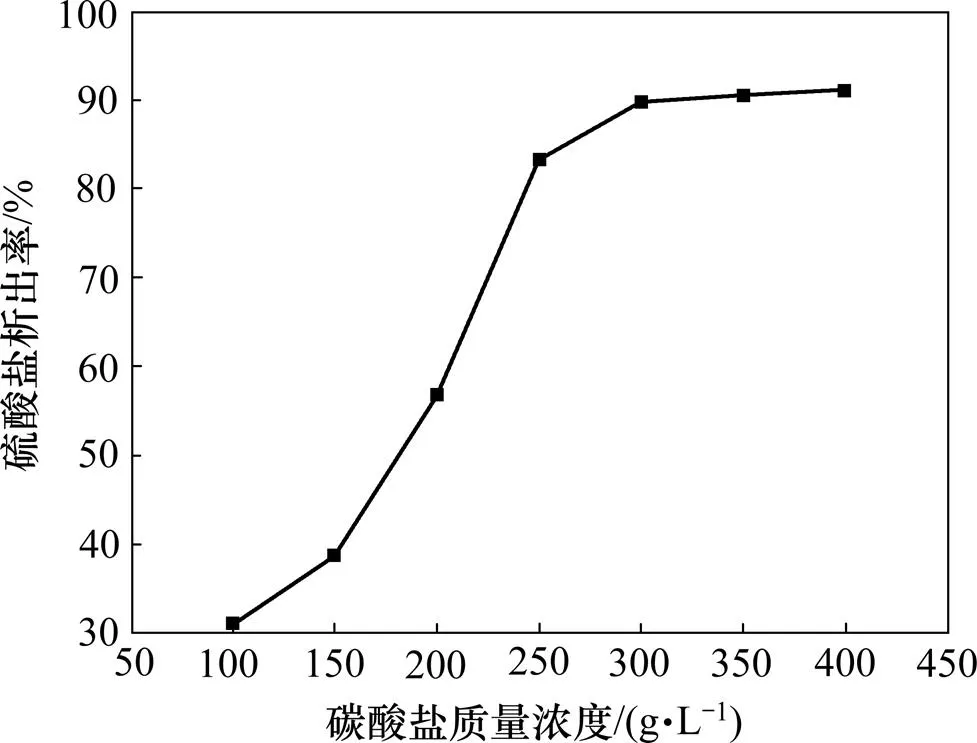
图4 溶析结晶实验结果
3 结论
1) 焙烧温度是影响锰选择性浸出效果的关键因素。控制焙烧温度为500 ℃,不仅锰浸出率较高,而且三氧化二铁难以转化为可溶性硫酸亚铁;在此温度下,锰浸出率可达84.26%,铁浸出率仅为11.61%,锰选择性浸出效果较好。
2) 硫酸钠对氧化锰矿的硫酸化焙烧和硫酸铵分解有较好的促进作用,同样条件下加硫酸钠可使锰浸出率提高5%~12%。
3) 在适宜的焙烧和浸出工艺条件下,通过硫酸化焙烧和浸出,锰的浸出率可以达到89.93%,同时NH4+和SO42−的回收率分别为98.62%和88.22%。据此测算出中和电解废酸液得到的尾液中,硫酸铵和硫酸钠总的质量浓度接近300 g/L,有利于用溶析结晶法析出相应的晶体,循环用于氧化锰矿的硫酸化焙烧。
[1] 张泾生, 周光华. 我国锰矿资源及选矿进展评述[J]. 中国锰业, 2006, 24(1) : 1−4.ZHANG Jingsheng, ZHOU Guanghua. A review of manganese ore resources in China and its processing technology progress[J]. China’s Manganese Industry, 2006, 24(1): 1−4.
[2] 朱志刚. 中国锰矿资源开发利用现状[J]. 中国锰业, 2016, 34(2): 1−3. ZHU Zhigang. Exploitation and utilization of resources of manganese ore[J]. China’s Manganese Industry, 2016, 34(2): 1−3.
[3] 黄琨, 张亚辉, 黎贵亮, 等. 锰矿资源及化学选矿研究现状[J]. 湿法冶金, 2013, 32( 4): 207−212.HUANG Kun, ZHANG Yahui, LI Guiliang, et al. Research situation of manganese resources and chemical processing of Manganese ore[J]. Hydrometallurdy of China, 2013, 32(4): 207−212.
[4] 程飞飞, 管俊芳, 张帆, 等. 锰矿化学选矿的研究现状[J]. 中国锰业, 2015, 33(4): 4−7.CHENG Feifei, GUAN Junfang, ZHANG Fan, et al. A research status of manganese ore chemical processing[J]. China’s Manganese Industry, 2015, 33(4): 4−7.
[5] ALAFARA A B, LATEEF I, FOLAHAN A A, et al. Hydrometallurgical processing of manganese ores: a review[J]. Journal of Minerals and Materials Characterization and Engineering, 2014, 2(3): 230−247.
[6] CHOW N, ENG P, NACU A, et al. The recovery of manganese from low grade resources[R]. Richmond, Canada: Kemetco Research Inc., 2010: 2−7.
[7] 武芳芳, 钟宏, 王帅. 氧化锰矿还原工艺技术研究进展[J]. 应用化工, 2012, 41(8): 1443−1447. WU Fangfang, ZHONG Hong, WANG Shuai. Research progress of manganese oxide ores reduction process[J]. Applied Chemical Industry, 2012, 41(8): 1443−1447.
[8] ALI S, IQBAL Y, FAROOQ U, et al.Leaching of manganese ores using corncob as reductant in H2SO4solution[J].Physicochemical Problems of Mineral Processing, 2016, 52(1): 56−65.
[9] FURLANI G, PAGNANELLI F, TORO L. Reductive acid leaching of manganese dioxide with glucose: identification of oxidation derivatives of glucose[J]. Hydrometallurgy, 2006, 81(3): 234−240.
[10] SONG Jingjing, ZHU Guocai, ZHANG Ping, et al. Reduction of low-grade manganese oxide ore by biomass roasting[J]. Acta Metallurgica Sinica(English letters), 2010, 23(3): 223−229.
[11] LI Changxin, ZHONG Hong, WANG Shuai, et al. Manganese extraction by reduction acid leaching from Low-grade manganese oxide ores using CaS as reductant[J]. Transactions of Nonferrous Metals Society of China, 2015, 25(5): 1677−1684.
[12] ZHANG Yuanbo, ZHAO Yi, YOU Zhixiong, et al. Manganese extraction from high-iron-content manganese oxide ores by selective reduction roasting-acid leaching process using black charcoal as reductant[J]. Journal of Central South University, 2015, 22(7): 2515−2520.
[13] PAKARINEN J, PAATERO E, PAKARINEN J, et al. Recovery of manganese from iron containing sulfate solutions by precipitation[J]. Minerals Engineering, 2011, 24(13): 1421−1429.
[14] YOU Zhixiong, LI Guanghui, ZHANG Yuanbo, et al. Extraction of manganese from iron rich MnO2ores via selective sulfation roasting with SO2followed by water leaching[J]. Hydrometallurgy, 2015, 156(7): 225−231.
[15] 朱国才, 李赋屏, 肖明贵. 采用硫酸铵焙烧方法从低品位碳酸锰矿中富集回收锰[J]. 桂林工学院学报, 2005, 25(4): 534−536. ZHU Guocai, LI Fuping, XIAO Minggui. Process of enriching and recovering Mn by roasting the low-grade manganese carbonate ore with ammonium sulfate[J]. Journal of Guilin University of Technology, 2005, 25(4): 534−536.
[16] SAHOO P K, RAO K S. Sulphation-roasting of low-grade manganese ores-optimisation by factorial design[J]. International Journal of Mineral Processing, 1989, 25(1/2): 147−152.
[17] ZHANG Wensheng, CHENG Chuyong. Manganese metallurgy review. Part I: Leaching of ores/secondary materials and recovery of electrolytic/chemical manganese dioxide[J]. Hydrometallurgy, 2007, 89(3/4): 137−159.
[18] SANTOS O S, CARVALHO C F, SILVA G A, et al. Manganese ore tailing: optimization of acid leaching conditions and recovery of soluble manganese[J]. Journal of Environmental Management, 2015, 147(1): 314−320.
[19] JIAN Qianghe, WEI Chen, GUO Lianggu, et al. Automated processing system of electrolytic manganese wastewater treatment and resource utilization[J].Applied Mechanics and Materials, 2013, 271/272(1):204−207.
[20] TAWIL S Z E, BARAWY K A E, SABA A E. High-grade manganese dioxide from low-grade ores[J]. Journal of the Minerals, Metals & Materials Society, 1989, 41(5): 38−39.
[21] 叶大伦, 胡建华. 实用无机物热力学数据手册[M]. 2版. 北京: 冶金工业出版社, 2002: 26−27. YE Dalun, HU Jianhua. Practical handbook of thermodynamic data of inorganic matter[M]. 2nd ed. Beijing: Metallurgy Industry Press, 2002: 26−27.
[22] 李靖华, 张桂恩, 张继昌. 硫酸氢铵-硫酸钠混合物系统化学储能的热分析研究(一)系统的热力学[J]. 河南师范大学学报(自然科学版), 1992, 20(2): 54−60 .LI Jinghua, ZHANG Guien, ZHANG Jichang. Thermoanalytical investigation of NH4HSO4-Na2SO4system for chemical storage of energy 1. Thermodynamic of the system[J]. Journal of Henan Normal University(Natural Science), 1992,20(2): 54−60 .
[23] 李华昌, 符斌. 实用化学手册[M].北京:化学工业出版社, 2006: 222−234.LI Huachang, FU Bin. Practical chemistry handbook[M]. Beijing: Chemical Industry Press, 2006: 222−234.
(编辑 伍锦花)
Cyclic process for leaching manganese by sulfation roasting of manganese oxide ore
ZHANG Zeqiang, SUN Hualin, ZHANG Hanquan, LI Donglian, HE Dongsheng
(School of Xingfa Mining Engineering, Wuhan Institute of Technology, Wuhan 430073, China)
In order to reduce the treatment cost of manganese oxide ore and utilize waste acid from electrolysis process of manganese effectively, sulfation roasting and leaching experiments of manganese ore were carried out using cyclic process of ammonium sulfate. The results show that sodium sulfate plays a positive role in promoting sulfation roasting of manganese oxide ore and decomposition of ammonium sulfate. When roasting temperature reaches 550 ℃, leaching rate of manganese is high and it is very difficult to convert Ferric oxide into soluble Ferrous sulfate, resulting in low content of iron in leaching solution and good selective leaching result of manganese. Under appropriate sulfation roasting and leaching conditions, leaching rate of manganese and recovery of NH4+and SO42−reaches 89.93%, 98.62% and 88.22% respectively.
manganese oxide; sulfation roasting; thermodynamics analysis; recycling
10.11817/j.issn.1672-7207.2018.05.002
TF046.2
A
1672−7207(2018)05−1031−06
2017−05−10;
2017−06−22
国家自然科学基金资助项目(51374156) (Project(51374156) supported by the National Natural Science Foundation of China)
张泽强,博士,教授,从事矿物加工理论与技术研究;E-mail: 490062732@qq.com
