21份引进BMR饲草高粱萌发期苗期耐旱耐盐性评价
2018-05-28郝培彤李玉龙栾瑞涛王建丽王显国
郝培彤,李玉龙,栾瑞涛,王建丽,王显国
(1.中国农业大学草业科学系,北京 100193; 2.通辽星圣农业有限公司,内蒙古 霍林郭勒 029200;3.黑龙江省农业科学院,黑龙江 哈尔滨 624400)
饲草高粱作为优质饲草具有耐旱、耐贫瘠、耐盐碱等多种优良特点,然而木质化程度高、消化率低是制约其饲喂效果不佳的主要因素之一。褐色中脉(brown midrib,BMR)突变体最早在玉米(Zeamays)研究中被报道[1],随后经人工诱导在高粱(Sorghumbicolor)[2]中获得,褐色中脉指植株生长到4~6个扩展叶后,叶片中脉和茎髓有褐色色素沉着,随成熟褐色沉着逐渐淡化,植株茎秆表皮呈浅褐色,髓呈红褐色。BMR饲草高粱比普通饲草高粱木质素含量低40%~60%,能显著提高消化率[3]。目前国内外对BMR高粱的研究主要集中在农艺性状[4]、饲用价值[5-6]、遗传分析[7-8]、生物燃料潜能[9]及抗逆性筛选[10]等方面。
高粱萌发期耐盐性的鉴定浓度依供试材料不同而不同,有研究表明高粱最适耐盐浓度为100~205 mmol·L-1NaCl[11-12],耐旱性鉴定可用不同浓度的PEG-6000进行[13],但研究材料多为甜高粱、杂交高粱、地方种质材料等,而以BMR高粱为研究对象进行耐旱、耐盐性系统评价的研究较少,且萌发期和苗期的耐旱、耐盐性并不完全相同,所以系统研究BMR高粱的萌发期、苗期耐旱、耐盐性尤为重要。本研究选用的21份BMR饲草高粱不育系材料均为国内首次引进,通过隶属函数值法综合评价耐旱耐盐性,为上述引进材料在我国饲草高粱育种实践中的高效利用提供依据。
1 材料和方法
1.1 试验材料
供试的21份种质材料引自美国,均为BMR饲草高粱不育系[14],试验材料BMP446、BMP447、BMP448、BMP449、BMP450、BMP451、BMP452、BMP453、BMP454、BMP455、BMP456、BMP12、BMP14、BMP15、BMP16、BMP17、BMP18、BMP19、BMP20、BMP21均来自密西西比州立大学,Tift98bmrB1来自美国农业部农业研究局GEORGIA试验站,按顺序依次编号为1-21。
1.2 试验设计
1.2.1萌发期耐旱性、耐盐性评价 选成熟、饱满、均匀一致的种子,用0.5%次氯酸钠消毒10 min,蒸馏水冲洗3次。随机选8份材料在0(CK)、150、200、300、400 mmol·L-1NaCl及5%、10%、15%、20% PEG-6000进行预试验,分析得到在300 mmol·L-1NaCl、20% PEG胁迫下各材料间差异最显著,因此正式试验盐胁迫用300 mmol·L-1NaCl,干旱胁迫为20% PEG-6000溶液。纸上发芽法每皿100粒,每皿加相应盐溶液或PEG溶液10 mL,对照加10 mL蒸馏水,每处理4次重复,光照培养箱28 ℃/25 ℃(12 h/12 h)、湿度60%变温条件下培养。称重法每天补水,初次计数为第2天,发芽周期为10 d。为消除试验材料间的差异均采用各项指标的相对值来表示材料的抗性。
1.2.2苗期耐旱性、耐盐性评价 2016年12月29日采用沙培法将材料播种于育苗盘,温室培养,保证每育苗盘每份材料出苗20株以上,每处理育苗盘重复4次。前期正常浇水(田间持水量70%~80%)、除草管理,三叶期时开始进行盐胁迫,将育苗盘置于托盘中,托盘中加入等量盐溶液,每24 h更换一次盐溶液,分别用0、150、300 mmol·L-1NaCl胁迫7 d后,统一在08:00-09:00采集叶片。为了避免造成盐冲击,NaCl浓度由每24 h增加50 mmol·L-1直至试验浓度。干旱胁迫幼苗正常浇水(田间持水量70%~80%)至三叶期,以正常浇水1 d后作为胁迫起始点,分别在1 d(CK)、4 d(实测为田间持水量50%~55%)、7 d(实测为田间持水量25%~35%)08:00-09:00采集叶片。
1.3 测定指标
1.3.1萌发期形态指标
发芽率(GP)=(G/N)×100%。
式中:G为正常发芽的种子数;N为供试种子总数。
发芽指数(GI)=∑Gt/Dt。
式中:Gt为在时间t时的发芽数,Dt为发芽日数。
活力指数(VI)=S×GI。
式中:S为幼苗的芽长。
根长(RL):处理结束时,用直尺测定从种子胚到最长根尖的长度。芽长(BL):处理结束时,用直尺测定从种子胚到最长叶尖的长度。
相对值=(各指标处理值/对照值)×100%。
1.3.2苗期生理指标 超氧化物歧化酶(SOD)采用氮蓝四唑(NBT)[15]法测定;过氧化氢酶(CAT)采用紫外吸收法测定[16];过氧化物酶(POD)活性的测定:采用愈创木酚法测定[16]。
1.4 综合评价方法
利用模糊数学中的隶属函数值法将上述各指标进行抗盐、抗旱综合评价。当性状指标与抗性正相关时,式中:Xij=(xij-xjmin)/(xjmax-xjmin);当性状指标与抗性负相关时,公式为:Xij=1-(xij-xjmin)/(xjmax-xjmin);Xij表示i种类j指标的抗性隶属函数值;xij表示i种类j指标的测定值;隶属函数值xi=1/n ∑xij,xi越大则抗性越强。
1.5 数据处理与分析
用SPSS 19.0统计软件进行方差分析及 DUNCAN 法多重比较;Excel 2013制作图表。
2 结果与分析
2.1 耐旱性评价
20%PEG干旱胁迫对21种供试材料形态指标影响各不相同(表1),干旱胁迫促进了BMP20、BMP448、BMP12的相对发芽率,Tift98bmrB1、BMP453、BMP18、BMP446相对发芽率显著降低(P<0.05)。除BMP12发芽指数比对照增加外,干旱胁迫均抑制其他材料相对发芽指数, BMP454、BMP450、Tift98bmrB1、BMP18相对发芽指数受到显著抑制(P<0.05);干旱胁迫显著增加BMP14、BMP19、Tift98bmrB1根长,显著增加BMP17、BMP456、BMP447芽长(P<0.05);除BMP17活力指数增加外,其他材料活力指数均被抑制,BMP18、Tift98bmrB1受到抑制程度最大,相对活力指数仅为38.04%。
20% PEG干旱胁迫下POD活性呈上升趋势,随胁迫时间的增加,供试材料POD活性有增高也有下降,材料BMP455对重度干旱响应最快,其POD活性显著高于其他材料(P<0.05)(图1)。SOD活性随干旱胁迫增加有增加有减少,BMP446、BMP448、BMP12、BMP456对干旱胁迫响应快且最终含量较高。BMP17、BMP18、BMP14、Tift98bmrB1随干旱胁迫天数增加其SOD活性均降低(图1)。干旱胁迫下CAT活性除BMP14之外其他材料都呈上升趋势,BMP14在重度干旱下CAT含量最低(图1)。
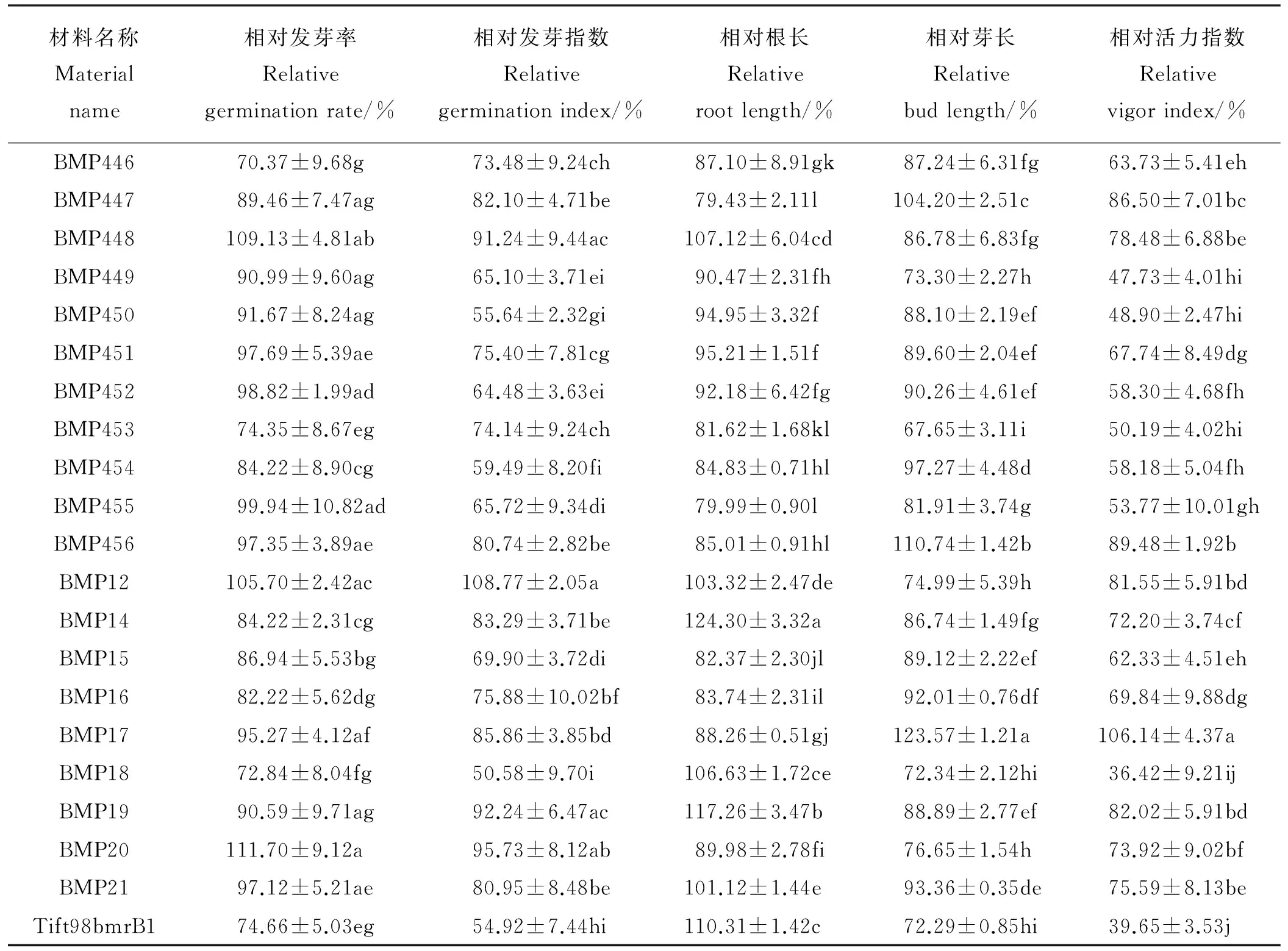
表1 20%PEG干旱胁迫下不同材料的相对发芽率、相对发芽指数、相对根长、相对芽长、相对活力指数Table 1 The relative germination rate, relativegerminationindex, relative root length, relative bud length and relativevigorindex of materials under 20%PEG drought stress
同列不同小写字母表示材料间差异显著(P<0.05)。
Different lowercase letters within the same column indicate significant difference among treatments at the 0.05 level.
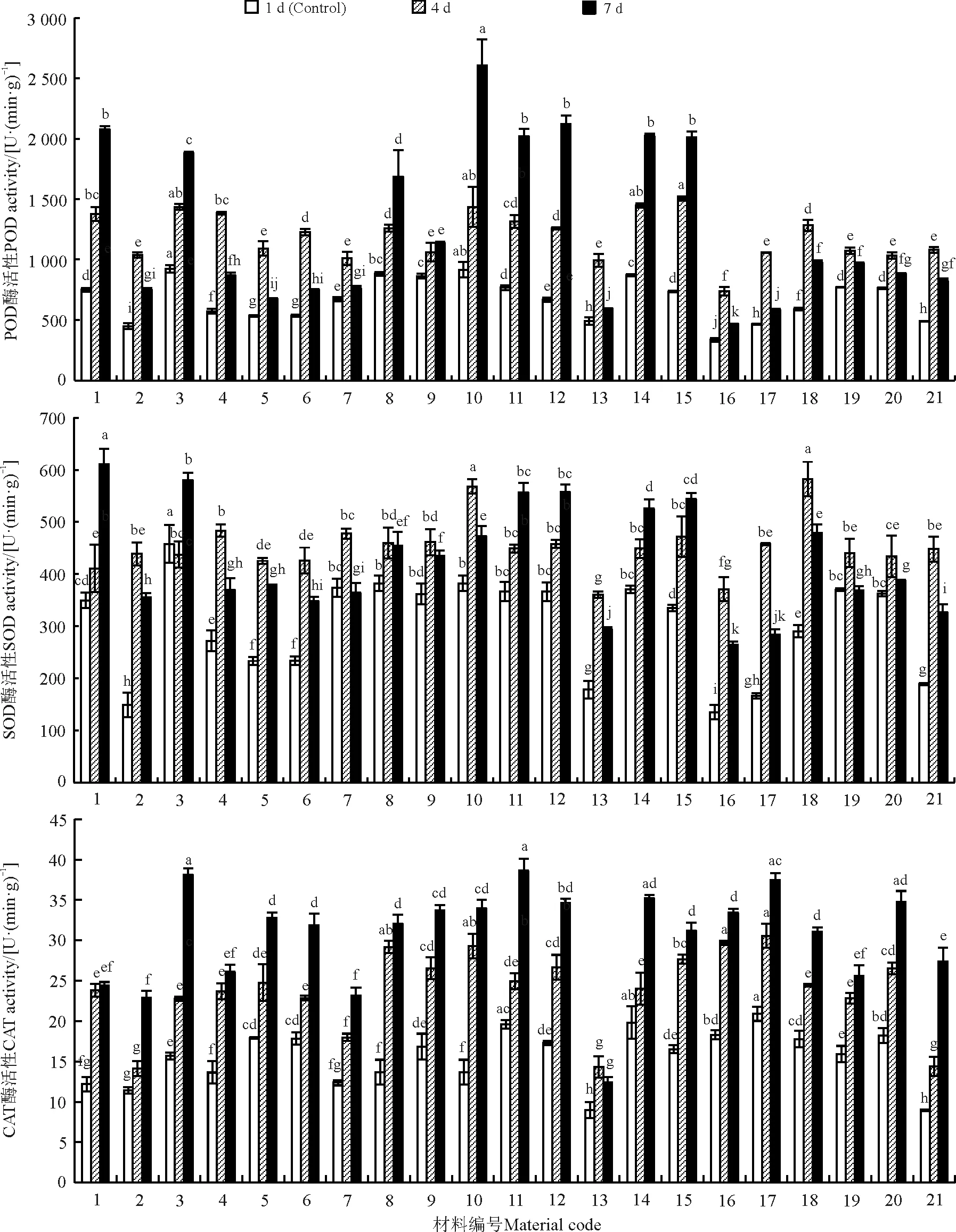
图1 干旱胁迫天数对不同材料苗期POD、SOD、CAT的影响Fig. 1 Effect of drought stress on POD, SOD, and CAT contents of materials during the seedling stage
不同小写字母表示同一时间不同材料间差异显著(P<0.05)。1-21分别表示BMP446,BMP447,BMP448,BMP449,BMP450,BMP451,BMP452,BMP453,BMP454,BMP455,BMP456,BMP12,BMP14,BMP15,BMP16,BMP17,BMP18,BMP19,BMP20,BMP21,Tift98bmrB1,图2同。
Different lowercase letters indicate significant difference among different materials at the 0.05 level.1-21 indicate BMP446,BMP447,BMP448,BMP449,BMP450,BMP451,BMP452,BMP453,BMP454,BMP455,BMP456,BMP12,BMP14,BMP15,BMP16,BMP17,BMP18,BMP19,BMP20,BMP21, Tift98bmrB1, respectively; similarly for the Fig. 2.
2.2 耐盐性评价
300 mmol·L-1盐胁迫下,BMP20、BMP453发芽率、发芽指数均高于其他材料(表2);BMP12、BMP449与对照比发芽率降低; BMP14、BMP15发芽率显著降低(P<0.05)。BMP14、BMP447、BMP15发芽指数显著降低;BMP14、BMP454、BMP447、BMP456、BMP21的芽长; BMP21、BMP454、BMP15活力指数显著降低;300 mmol·L-1盐胁迫对BMP447、BMP14抑制作用最大。
盐胁迫下POD活性升高,随胁迫程度增加BMP455、BMP15、BMP16的POD活性快速增加,而BMP448、BMP17则增加缓慢;Tift98bmrB1、BMP14的POD显著下降(P<0.05)(图2)。随盐胁迫程度增加,BMP446、BMP449、BMP16 SOD活性对盐胁迫响应快且迅速增加,其中,BMP446、BMP16 SOD活性增加至最大且显著高于其他材料,而Tift98bmrB1、BMP14、BMP18 SOD活性较小(图2)。盐胁迫程度增加呈上升趋势,BMP451、BMP15在高盐胁迫下处于较高水平,但两者间差异不显著(P<0.05);高盐胁迫下,BMP14 CAT活性最低(图2)。
2.3 抗性综合评价
将供试材料萌发期、苗期各指标经隶属函数值法分析后发现,萌发期耐旱性较强的为BMP17、BMP448、BMP12,耐旱性较差的为Tift98bmrB1、BMP18、BMP453;苗期耐旱性较强的为BMP456、BMP448、BMP12;萌发期耐盐性较强的为BMP16、BMP453,而最差的为BMP14,苗期耐盐性较强为BMP455、BMP456、BMP16,而最差为BMP14(表3)。

表2 300 mmol·L-1盐胁迫下不同材料的相对发芽率、相对发芽指数、相对根长、相对芽长、相对活力指数Table 2 The relative germination rate, relative germination index, relative root length,relative bud length and relative vigor index of materials under 300 mmol·L-1NaCl salt stress

图2 NaCl胁迫处理对不同材料苗期POD、SOD、CAT的影响 Fig. 2 Effect of salt stress on POD (a), SOD (b), and CAT (c) content of materials during the seedling stage
3 讨论
干旱盐碱地区水分、盐分成为限制种子萌发的主要因素,萌发期是植物对盐胁迫、干旱胁迫最敏感的时期[17],植物在萌发和苗期的抗逆性可以反映该物种的抗逆性[18-19]。研究表明,低浓度NaCl胁迫可促进陇东达乌里胡枝子(Lespedezadavurica)发芽率,但高浓度盐胁迫显著抑制胡枝子发芽率、根长及芽长;低浓度PEG可促进陇东达乌里胡枝子、科尔沁尖叶胡枝子的发芽率及胚根生长[20],在甜高粱“凯勒”、“MN-94”发芽率上也得到相同结果[12]。本研究表明20% PEG-6000、300 mmol·L-1NaCl胁迫可促进某些耐旱耐盐材料的种子萌发,300 mmol·L-1NaCl胁迫可促进耐盐材料BMP20、BMP453的发芽率和发芽指数,抑制不耐盐材料BMP14芽长及活力指数;20%PEG处理下抗旱较强的材料BMP14、BMP19、Tift98bmrB1根长显著增加, BMP17、BMP456、BMP447的芽长显著增加;除BMP17外,PEG胁迫均抑制供试材料的活力指数,说明一定浓度盐、旱胁迫可提高抗逆性强的种子的萌发及种子活力,对抗性弱的种子活力产生一定阻碍作用,减缓其萌发速率,这与甜高粱在盐旱胁迫下发芽指数、活力指数降低结果一致[12]。

表3 供试材料耐旱性、耐盐性相对隶属函数值Table 3 Relative subordinate values of experiment materialsunder drought and salt stress
盐胁迫对植物造成的伤害包括原初伤害和次生盐害两部分,前者是指盐离子渗入造成的细胞及植物体代谢紊乱;而后者指盐胁迫产生的离子胁迫和渗透胁迫进而引发氧化胁迫,导致植物的生理干旱。逆境时植物通过产生抗氧化酶SOD、POD、CAT、GSH、APX等清除体内多余活性氧,通过游离脯氨酸、丙二醛、可溶性糖、可溶性蛋白等渗透调节物质变化来维持调节机体内活性氧平衡,当胁迫超过植物耐受极限时,机体防御系统破坏,保护酶活性下降[21-22]。研究表明,花花柴(Kareliniacaspia)幼苗叶片在盐旱胁迫下短时间内SOD、POD、CAT活性呈上升趋势,随胁迫浓度增加及胁迫时间的延长,细胞代谢紊乱,保护酶失活,活性氧清除能力降低最终导致细胞死亡[23];同样在NaCl胁迫下燕麦(Avenasativa)体内SOD、POD活性也表现为先上升后下降的趋势[24]。本研究表明,盐旱胁迫下BMR高粱SOD活性先增加以清除体内的活性氧,随胁迫程度增加抗性强的材料能快速响应并产生更多SOD酶以减弱逆境对植物体的伤害,但抗性较差的材料可能由于超过耐受极限代谢紊乱而SOD活性下降,POD活性随胁迫程度增加趋势同SOD活性趋势相似,CAT活性则表现为随胁迫程度增加呈上升趋势。
4 结论
21份BMR饲草高粱萌发期耐旱性较强的材料为BMP17、BMP448、BMP12、BMP19、BMP456、BMP14、BMP20、BMP21,耐旱性较弱的为Tift98bmrB1、BMP18、BMP453,耐旱性中等的为BMP14等10个材料;苗期耐旱性较强的为BMP456、BMP448、BMP12、BMP455,耐旱性较弱的为BMP452、BMP17、BMP447、BMP14,耐旱性中等的为BMP15等13个材料。
萌发期耐盐性较强的为BMP16、BMP453、BMP12、Tift98bmrB1、BMP20,耐盐性较弱的为BMP447、BMP15、BMP14、BMP454,耐盐性中等的为BMP455等12个材料;苗期耐盐性较强的为BMP455、BMP456、BMP15、BMP16、BMP446、BMP452,耐盐性较弱的为Tift98bmrB1、BMP14,耐盐性中等的为BMP12等13个材料。
综上,萌发期、苗期耐旱性均较强的材料为BMP12、BMP456、BMP448;萌发期、苗期耐盐性均较强的材料为BMP16、BMP12、BMP453。
参考文献References:
[1] Eyster W H.Chromosomes Ⅷ in maine.Science,1926,64:22.
[2] Porter K S,Axtell J D,Lechtenberg V L,Colenbrander V F.Phenotype,fiber composition,and in vitro dry matter disappearance of chemically induced brown midrib (bmr) mutants of Sorghum.Crop Science,1978,18(2):205-208.
[3] Casler M D,Pedersen J F,Undersander D J.Forage yield and economic losses associated with the brown-midrib trait in sudangrass.Crop Science,2003,43(3):782-789.
[4] 吕鑫,平俊爱,张福耀,杜志宏,李慧明,杨婷婷,牛皓,姚琳.新选饲草高粱恢复系农艺性状配合力效应分析.草业科学,2016,33(7):1361-1366.
Lyu X,Ping J A,Zhang F Y,Du Z H,Li H M,Yang T T,Niu H,Yao L.Effect analysis on the combining ability of main agronomic traits for new breeding restorer lines derived from forage sorghum.Pratacultural Science,2016,33(7):1361-1366.(in Chinese)
[5] Cherney J H,Cherney D,Akin D E,Axtell J D.Potential of brown-midrib,low-lignin mutants for improving forage quality.Advances in Agronomy,1991,46:157-198.
[6] 王红梅,梁潇.宁夏引黄灌区褐色中脉(BMR)高粱饲用性状评定研究.农业科学研究,2016,37(4):6-10.
Wang H M,Liang X.The evaluation feeding value of brown midrib sorghum from Ningxia Yellow River irrigation area.Journal of Agricultural Sciences,2016,37(4):6-10.(in Chinese)
[7] Pedersen J F,Vogel K P,Funnell D L.Impact of reduced lignin on plant fitness.Crop Science,2005,45(3):812-819.
[8] 李杰勤,王丽华,詹秋文,范军成.高粱棕色中脉基因bmr-6的遗传分析和SSR标记定位.草业学报,2010,19(5):273-277.
Li J Q,Wang L H,Zhan Q W,Fan J C.Genetic analysis and mapping with SSR markers of the brown midrib gene bmr-6 in sorghum bicolor.Acta Prataculturae Sinica,2010,19(5):273-277.(in Chinese)
[9] Kamireddy S R,Li J,Abbina S,Berti M,Tucker M,Ji Y.Converting forage sorghum and sunn hemp into biofuels through dilute acid pretreatment.Industrial Crops and Products,2013,49:598-609.
[10] 李源,游永亮,赵海明,谢楠,翟兰菊,刘贵波.褐色中脉饲草高粱品种产量品质与抗逆性分析.草地学报,2014,22(4):889-896.
Li Y,You Y L,Zhao H M,Xie N,Zhai L J,Liu G B.Analysis on the yield,quality and stress resistance of brown midrib forage sorghum varieties.Acta Agrestia Sinica,2014,22(4):889-896.(in Chinese)
[11] 穆志新,李萌,秦慧彬.高粱芽期耐盐指标筛选及耐盐性评价.山西农业科学,2017,45(7):1075-1079.
Mu Z X,Li M,Qin H B.Screening of salt tolerance indices and salt tolerance evaluation of sorghum germplasm resources at germination stage.Journal of Shanxi Agricultural Sciences,2017,45(7):1075-1079.(in Chinese)
[12] 杨帆.甜高粱在萌发期和苗期抗盐性与抗旱性比较研究.济南:山东师范大学硕士学位论文,2015.
Yang F.Comparative studies on salt resistance and drought resistance of sweet sorghums at stage of germination and seedlings.Master Thesis.Ji’nan:Shandong Normal University,2015.(in Chinese)
[13] 王艺陶.高粱抗旱机制及评价指标的研究.沈阳:沈阳农业大学博士学位论文,2013.
Wang Y T.Drought resistant mechanism and the evaluation critaria in sorghum.PhD Thesis.Shenyang:Shenyang Agricultural University,2013.(in Chinese)
[14] Norris R A.Plant Inventory No.207.U.S.Department of Agriculture,Agricultural Research Service,1998,601817-606707.
[15] 王晓峰,陈建勋.植物生理学实验指导.广州:华南理工大学出版社,2006:64-66.
Wang X F,Chen J X.Experimental Instruction of Plant Physiology.Guangzhou:South China University of Technology Press,2006:105-118.(in Chinese)
[16] 李合生.植物生理生化实验原理和技术.北京:高等教育出版社,2000:105-118.
Li H S.Plant Physiological Biochemistry Principle and Technology.Beijing:Higher Education Press,2000:105-118.(in Chinese)
[17] Almansouri M,Kinet J M,Lutts S.Effect of salt and osmotic stresses on germination in durum wheat (TriticumdurumDesf.).Plant and Soil,2001,231(2):243-254.
[18] Abedin M J,Meharg A A.Relative toxicity of arsenite and arsenate on germination and early seedling growth of rice (OryzasativaL.).Plant and Soil,2002,243(1):57-66.
[19] 布海丽且姆·阿卜杜热合曼,刘会良,张道远,管开云.不同温度、水热条件3种植物种子物理休眠解除的影响.干旱区研究,2016,33(3):525-533.
Buhailiqiemu·Abuduregeman,Liu H L,Zhang D Y,Guan K Y.Effects of different temperature and water-heat conditions on the physical dormancy release of three desert legume species.Arid Zone Research,2016,33(3):525-533.(in Chinese)
[20] 刘鸿芳,汪永平,骆凯,余玲,张宝林,塔拉腾,刘晓燕,张吉宇.温度、PEG和NaCl对三种胡枝子种子萌发和幼苗生长的影响.草业科学,2016,33(9):1747-1756.
Liu H F,Wang Y P,Luo K,Yu L,Zhang B L,Talateng,Liu X Y,Zhang J Y.Effects of temperature,PEG and NaCl treatments on seed germination and seeding of threeLespedezaspecies.Pratacultural Science,2016,33(9):1747-1756.(in Chinese)
[21] 石永红,万里强,刘建宁,王运琦,郭锐,吴欣明,李向林.多年生黑麦草抗旱性主成分及隶属函数分析.草地学报.2010(5):669-672.
Shi Y H,Wan L Q,Liu J N,Wang Y Q,Guo R,Wu X M,Li X L.Analysis of the principal components and the subordinate function ofLoliumperennedrought resistance.Acta Agrestia Sinica,2010(5):669-672.(in Chinese)
[22] 崔婷茹,于慧敏,李会彬,边秀举,王丽宏.干旱胁迫及复水对狼尾草幼苗生理特性的影响.草业科学,2017,34(4):788-793.
Cui T R,Yu H M,Li H B,Bian X J,Wang L H.Effect of drought stress and rewatering on physiological characteristics of Pennisetum alopecuroides seedlings.Pratacultural Science,2017,34(4):788-793.(in Chinese)
[23] 石新建,王彦芹,李志军.盐旱胁迫对花花柴种子萌发与幼苗生理生化特性的影响.草业科学,2017,34(9):1855-1862.
Shi X J,Wang Y Q,Li Z J.Physiological changes during seed germination and seedling development inKareliniacaspiaLess.under drought and salinity stress.Pratacultural Science,2017,34(9):1855-1862.(in Chinese)
[24] 刘凤歧,刘杰淋,朱瑞芬,张悦,郭勇,韩贵清,唐凤兰.4种燕麦对NaCL胁迫的生理响应及耐盐性评价.草业学报,2015,24(1):183-189.
Liu F Q,Liu J L,Zhu R F,Zhang Y,Guo Y,Han G Q,Tang F L.Physiological responses and tolerance of four oat varieties to salt stress.Acta Prataculturae Sinica,2015,24(1):183-189.(in Chinese)
