植物与土壤中醇类化合物对高寒草甸退化指示作用初探
2018-05-28段中华全小龙乔有明史惠兰裴海昆郑元铭
段中华,全小龙,乔有明,史惠兰,裴海昆,郑元铭
(1.三江源生态和高原农牧业国家重点实验室,青海 西宁 810016; 2.青海大学生态环境工程学院,青海 西宁 810016)
高寒草甸草地广泛分布于青藏高原东部及其周围山地,退化草甸面积占可利用草甸面积50%[1]。高寒草甸严重退化不仅严重影响到牧民的生产、生活及畜牧业的健康发展[2],而且也造成该区域物种多样性变少,水土流失加剧,沙化面积不断扩大[3],因此研究高寒草甸植被退化演替的指示指标,保护和修复退化高寒草甸迫在眉睫。有关植被演替指示指标有群落物种数、群落结构[4]和生物标记物[5]等,群落指标的研究时间尺度短,而生物标记物由于其性质稳定大大扩展高寒草甸植被演替的研究时间。
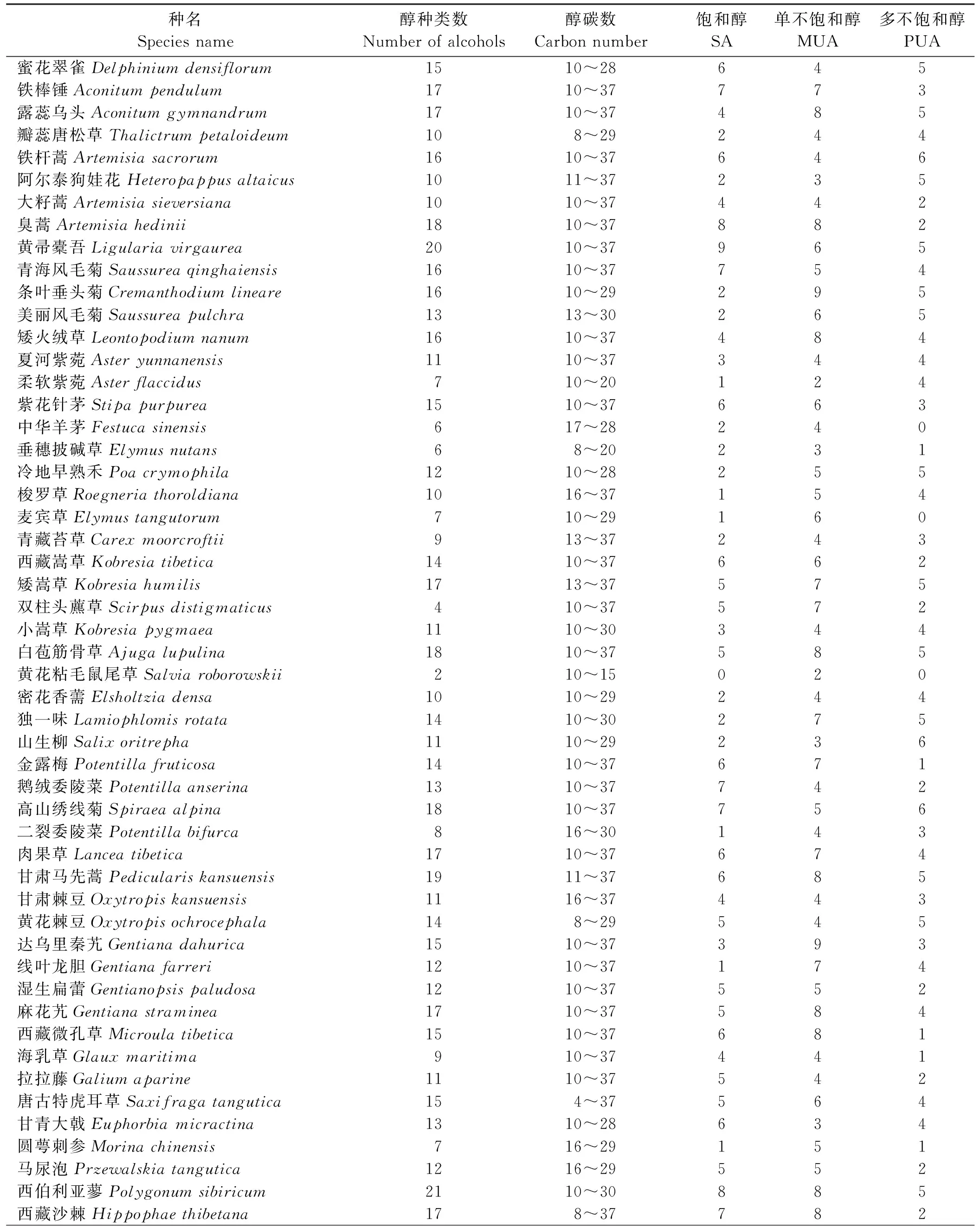
作为生物标记物之一的醇类物质分为烷醇和甾醇等,广泛分布于植物、土壤中[6-8]。直链烷醇都由长碳链与羟基所构成,长链组分来自草本植物[9]。草本植物(Agropyronsmithii)叶蜡中烷醇范围为C22-C32,其丰度最高正构烷醇为C26或C28[10]。木本植物中烷醇也是以C26、C28或C30为主[11]。土壤中烷醇范围为C18-C32,有很强的偶数碳优势,这也是高等植物蜡质物质特性[12]。表层土壤烷醇表明有植物衍生有机物质的输入[13],其中土壤二十六烷醇指示有机物质输入形式以草根为主[14]。不同海拔的土壤烷醇的分布非常相似,最大含量的烷醇为C24或C26,长链烷醇(>C21)明显高于短链的烷醇( 由于烷醇和甾醇性质稳定且具有生物标记物的属性,因此通过高寒草甸土壤与植物中醇类化合物特征分析,得出土壤与植物中醇类化合物的分布规律,为研究醇类化合物对高寒草甸退化指示作用提供数据支撑,为高寒草甸保护与利用提供理论依据。 采样地位于青海省果洛州玛沁县大武镇格多牧委会、格姆滩以及达日县窝赛乡(33°34′-34°28′ N,99°53′-100°29′ E),海拔为3 700~4 100 m。气候具有显著的气温低、光辐射强、昼夜温差大、降水量较多、蒸发量大、多阵性大风等典型的高原大陆性气候特点。样地中未退化高寒草甸典型植被以小嵩草(Kobresiapygmaea)、矮嵩草(K.humilis)为优势种,原生植被盖度高于85%,样地中无秃斑地。退化高寒草甸典型优势植物为鹅绒委陵菜(Potentillaanserina)、西伯利亚蓼(Polygonumsibiricum)、细叶亚菊(Ajaniatenuifolia)、矮火绒草(Leontopodiumnanum)、甘肃棘豆(Oxytropiskansuensis)、甘肃马先蒿(Pediculariskansuensis),原生植被盖度小于50%,样地中有小块秃斑地。土壤类型为寒冻雏形土。 样品采集时,分别在格多牧委会、格姆滩和窝赛乡每个地点都选择退化和未退化高寒草甸两个样地。土壤采集时,在每个样地(0.67 hm2左右)选择3个采样点,相邻的样点间距离为20 m,每个样点挖一个剖面,分0-10、10-20、20-30 cm其3层采集土样。将每层土壤混匀后用四分法留取1 kg左右的鲜土,装入自封袋,记录采样信息。单种植物采集时,在同一采样地点采集5~8株单种整株植物,充分混合后装入纸袋。样方中的植物样品按草地类别采集,每个类别确定3个采样点,剪取样方(1 m×1 m)内所有植物的地上部分,全部装进纸袋。采集完成后的土壤和植物样品转移至实验室中,在室温下自然风干,然后经过磨碎、过0.15 mm筛处理后,用自封袋密封保存备用。52种植物物种的鉴定时,根据每种植物的典型特征,同时查阅《三江源区草地植物图集》、《青海主要草地类型及常见植物图谱》等资料,逐一进行鉴定。以每个样地3个采样点的植物和土壤样品分别作为重复。 1.3.1醇类化合物的提取方法 精确称取植物粉末样品0.400 0 g或土壤样品1.000 0 g放入棕色样品瓶中,加入二氯甲烷和甲醇的浸提混合液(3∶1,V/V) 5 mL[6],盖好样品瓶盖并摇匀,再将样品瓶放入超声波洗涤器中,在超声功率为100%下浸提15 min,连续3次浸提,接下来将所有提取液转移至填充了活化过的硅胶(颗粒直径0.15 mm,干重5 g)层析柱(1 cm×10 cm)中,过夜直至所有提取液都通过层析柱后,再分2次连续加入10 mL甲醇和二氯甲烷混合液(95∶5,v/v)进行洗脱,收集全部的洗脱液,混合均匀,接下来过孔径0.45 μm滤膜后,最后将洗脱液氮气吹扫浓缩至1 mL。 1.3.2分析条件 醇类化合物的分析采用赛默飞公司气相色谱质谱联用仪(GC-MS,DSQ II)。GC条件:DB-5MS石英毛细管柱(60 m×0.25 mm×0.25 μm,安捷伦)。程序升温由室温升到60 ℃,保持1 min;再以10 ℃·min-1升到180 ℃,保持2 min;4 ℃·min-1升到250 ℃,保持20 min;20 ℃·min-1升到280 ℃,保持2 min;不分流进样,进样量1 μL;载气为高纯氦(99.999%),流速1.0 mL·min-1。MS条件:电子离子源 (EI),电离能量为70 eV,离子源的设定温度为250 ℃,气相色谱与质谱的传送杆温度为280 ℃,扫描模式为全扫模式。 醇类化合物种类辨别采用标品和2008版NIST库比对进行定性鉴定,定量数据计算采用内标法,计算公式:醇含量=(A-839 483)/(155 682 00×W),A为醇的峰面积,W为样品重量。数据采用Excel 2007输入数据,用SPSS 19软件进行统计分析。 高寒草甸52种常见植物中醇类种类数为2~21,黄花粘毛鼠尾草(Salviaroborowskii)中醇的种类最少,而西伯利亚蓼(Polygonumsibiricum)种类数最多,醇碳数范围在4~37(表1),不饱和醇种类数均高于饱和醇。 退化高寒草甸植物中含有20种醇,其中5种饱和烷醇,15种不饱和醇;4种直链烷醇,16支链醇(表2)。植物中醇的含量为5.67~191.51 mg·kg-1,其中4α-甲基胆甾烷-8,24-二烯-4β-醇含量最低,3,7,11,15-四甲基-2-反式-1-十六烯醇含量最高。退化草地植物含量最高的烷醇为C27,且以奇数碳烷醇为主。 退化高寒草甸土壤中含有16种醇,其中6种饱和烷醇,10种不饱和醇;2种直链烷醇,14支链醇(表3)。土壤中醇的含量为0.03~1.25 mg·kg-1,其中Z,Z-2,5-十五碳二烯-1-醇含量最低,2-甲基十六烷醇含量最高。 未退化高寒草甸植物中含有12种醇,其中4种饱和烷醇,8种不饱和醇;4种直链烷醇,8支链醇(表4)。植物中醇的含量范围3.46~90.32 mg·kg-1,其中荜澄茄油烯醇含量最低,β-谷甾醇含量最高。未退化草地植物中偶数碳烷醇含量较高,其中十八烷醇含量最高。 未退化高寒草甸土壤中含有10种醇,其中4种饱和烷醇,6种不饱和醇;二元醇1种,其他均为一元醇,无直链醇(表5)。土壤中醇的含量范围0.003~0.406 mg·kg-1,其中2,5-顺式十五碳二烯-1-醇含量最低,3,7,11,16-四甲基-(Z,E,E,E)-2,6,10,14-十六碳四烯-1-醇含量最高。 退化草地植物中烯醇和甾醇种类数要多于未退化草地,草地中相同的烯醇含量前者高于后者,而退化草地植物中甾醇含量除羽扇豆醇外均低于未退化草地。高寒草甸植物和土壤中醇的种类数量大小关系为:退化草甸植物>退化草甸土壤>未退化草甸植物>未退化草甸土壤(表6)。植物和土壤含有6种相同的醇,分别为:9-甲基-10-顺式十五烯-1-醇;2-甲基十六醇;12-甲基-2,13-反式十八碳二烯-1-醇;2-亚甲基-5α-胆甾烷-3β-醇;2,2,4-三甲基-3-(3,8,12,16-四甲基-3E,7E,11E,15-十七碳四烯基)-环己醇;1-三十七烷醇。植物和土壤中这6种醇含量上有很强的相关性,其方程为y=11.00x+6.101(R2=0.871)。其中9-甲基-10-顺式十五烯-1-醇;2-亚甲基-5α-胆甾烷-3β-醇和1-三十七烷醇在未退化土壤中未检出,只存在于退化高寒草甸土壤中,因此这3种醇可以用作生物标记物来指示高寒草甸土壤退化。 生物标记物具有化合物稳定、特殊的立体化学结构、种类多、信息量丰富、专一性、保存时限长、分布广泛的特点,有较好的指示气候和环境的作用,广泛用于古环境中有机质的溯源[5]。尽管生物标记物在古环境重建中具有重要工具价值,但在草甸生态系统研究中应用却相对较少。而有关高寒草甸植物与土壤中生物标记物之一的醇类化合物的研究甚少,通过对高寒草甸植物和土壤中醇类化合物研究,可以揭示土壤有机质与植物的物源关系。高寒草甸植物中含有丰富醇类物质,共检出多种烷醇、烯醇、甾醇等醇类化合物。退化与未退化草甸植物中丰度最高的烷醇碳数不同,且所检测到的烷醇碳奇偶优势不一致,这可能与不同类型草甸中的不同优势植物有关。植物中烯醇种类数多且含量较高,这与植物较低温度生境密切相关。植物甾醇主要包括胆固醇、菜油甾醇和β-谷甾醇,萜醇为羽扇豆醇,这与Pisani等[24]研究吻合。不同类型草地植物中甾醇种类数及含量差别较大,这深受植物生长的逆境环境影响[25],还可能与退化和未退化草地中植物种类有明显差异有关。土壤中也含有多种醇类物质,这与Yang等[15]研究相符。土壤中烷醇和甾醇能记录一些地质信息,是一类相对稳定的生物标记物[22]。它们能表征土壤有机质的来源,长链烷醇(C数>20)来自于植物叶蜡[26]。土壤中检出而在植物中未检出的醇类化合物其来源可能不是高等植物而是土壤藻类或微生物,长链醇类化合物在植物和土壤中都检出表明这些醇主要来自地表高等植物[27]。退化草甸土壤中烷醇和甾醇的种类数多于未退化草甸,这和土壤中有机物质输入的高等植物种类多样性有必然的联系。退化草甸土壤检出而在未退化土壤未检出且存在于植物中这类醇可以用作指示高寒草甸退化的生物标记物。 表1 单种植物中醇类的特征Table 1 Characteristics of alcohols in plants SA,饱和醇;MUA,单不饱和醇;PUA,多不饱和醇。 SA, saturated alcohols; MUA, mono-unsaturated alcohols; PUA, poly-unsaturated alcohols. 表2 退化高寒草甸植物中醇类化合物含量Table 2 Plant alcohol content in degraded alpine meadow 不同的字母表示差异显著性(P<0.05);下同。 Different lowercase letters indicate significant differences at the 0.05 level, similarly for the following tables. 表3 退化高寒草甸土壤中醇类化合物含量Table 3 Soil alcohol content in degraded alpine meadow 表4 未退化高寒草甸植物中醇类化合物含量Table 4 Plant alcohol content in non-degraded alpine meadow 表5 未退化高寒草甸土壤中醇类化合物含量Table 5 Soil alcohol content in non-degraded alpine meadow 高寒草甸单种植物中醇类种类数范围为2~21,碳数范围为4~37,不饱和醇种类数均高于饱和醇。高寒草甸中植物与土壤醇的种类大小关系为:退化植物>退化土壤>未退化植物>未退化土壤。植物和土壤均含有的醇分别为9-甲基-10-顺式十五烯-1-醇、2-甲基十六醇、12-甲基-2,13-反式十八碳二烯-1-醇、2-亚甲基-5α-胆甾烷-3β-醇、2,2,4-三甲基-3-(3,8,12,16-四甲基-3E,7E,11E,15-十七碳四烯基)-环己醇、1-三十七烷醇。植物和土壤中相同的醇有很强的相关性。9-甲基-10-顺式十五烯-1-醇、2-亚甲基-5α-胆甾烷-3β-醇、1-三十七烷醇只存在于退化高寒草甸土壤中,因此可以用作标记物来指示高寒草甸土壤退化。 表6 高寒草甸植物与土壤醇种类差异Table 6 Alcohols found in plants and soil in alpine meadow “+” 表示有,“-” 表示无。 “+”, presence; “-”, absence. 参考文献References: [1] 刘淑丽,林丽,张法伟,杜岩功,李以康,郭小伟,欧阳经政,曹广民.放牧季节及退化程度对高寒草甸土壤有机碳的影响.草业科学,2016,33(1):11-18. Liu S L,Lin L,Zhang F W,Du Y G,Li Y K,Guo X W,Ouyang J Z,Cao G M.Effects of grazing season and degradation degree on the soil organic carbon in alpine meadow.Pratacultural Science,2016,33(1):11-18.(in Chinese) [2] 周丽,张德罡,贠旭江,董永平,王加亭,赵雅丽.退化高寒草甸植被与土壤特征.草业科学,2016,33(11):2196-2201. Zhou L,Zhang D G,Yun X J,Dong Y P,Wang J T,Zhao Y L.The vegetation and soil characteristics of degraded alpine meadow.Pratacultural Science,2016,33(11):2196-2201.(in Chinese) [3] 张颖,章超斌,王钊齐,杨悦,李建龙.三江源1982-2012年草地植被覆盖度动态及其对气候变化的响应.草业科学,2017,34(10):1977-1990. Zhang Y,Zhang C B,Wang Z Q,Yang Y,Li J L.Spatiotemporal dynamics of grassland coverage in response to climate change from 1982 to 2012 in the Three Rivers Source Region,China.Pratacultural Science,2017,34(10):1977-1990.(in Chinese) [4] 王长庭,王根绪,刘伟,王启兰,向泽宇.植被根系及其土壤理化特征在高寒小嵩草草甸退化演替过程中的变化.生态环境学报,2012,21(3):409-416. Wang C T,Wang G X,Liu W,Wang Q L,Xiang Z Y.Vegetation roots and soil physical and chemical characteristics in degeneration succession fo theKobresiapygmaeameadow.Ecology and Environmental Sciences,2012,21(3):409-416.(in Chinese) [5] 段中华,全小龙,乔有明,裴海昆,何桂芳.高寒草甸植物正构烷烃特征分析.草业学报,2016,25(6):136-147. Duan Z H,Quan X L,Qiao Y M,Pei H K,He G F.Characterization of plantn-alkanes in alpine meadow.Acta Prataculturae Sinica,2016,25(6):136-147.(in Chinese) [6] Wu P,Xiao X T,Tao S Q,Yang Z S,Zhang H L,Li L,Zhao M X.Biomarker evidence for changes in terrestrial organic matter input into the Yellow Sea mud area during the Holocene.Science China Earth Sciences,2016,59:1216-1224. [7] Irena A,Gary M.Biogenic and anthropogenic lipid markers in sediments from a marsh habitat associated with the LCP chemicals superfund site in Brunswick,Georgia,USA.Water Air & Soil Pollution,2016,227(40):1-13. [8] Tahir N M,Pang S Y,Simoneit B R T.Distribution and sources of lipid compound series in sediment cores of the southern South China Sea.Environmental Science and Pollution Research,2015,22:7557-7568. [9] 段毅.甘南沼泽沉积脂类生物标志化合物的组成特征.地球化学,2002,31(6):525-531. Duan Y.Compositional features of lipid compounds in sediments from Gannan Marsh,China.Geochimica,2002,31(6):525-531.(in Chinese) [10] Angelika O,Myrna J S.Degradation and preservation of vascular plant-derived biomarkers in grassland and forest soils from Western Canada.Biogeochemistry,2005,74:377-409. [11] Margarita J E, Dirk S, Blas L V G. A deglaciation and Holocene biomarker-based reconstruction of climate and environmental variability in NW Iberian Peninsula:The Sanabria Lake sequence. Journal of Paleolimnology,2016,56:49-66. [12] Zeng F G,Xiang S Y,Zhang K X.Environmental evolution recorded by lipid biomarkers from the Tawan loess-paleosol sequences on the west Chinese Loess Plateau during the late Pleistocene.Environmental Earth Sciences,2011,64:1951-1963. [13] Ian D B,Phillip P B,Richard P E.An organic geochemical investigation of the practice of manuring at a Minoan Site on Pseira Island,Crete.Geoarchaeology,2001,16(2):223-242. [14] Bull I D,Nott C J,Pfvan B.Organic geochemical studies of soils from the Rothamsted classical experiments Ⅵ. The occurrence and source of organic acids in an experimental grassland soil.Soil Biology & Biochemistry,2000,32(10):1367-1376. [15] Yang H,Ding W H,Xie S C.Distribution of microbial fatty acids and fatty alcohols in soils from an altitude transect of Mt.Jianfengling in Hainan,China:Implication for paleoaltimetry and paleotemperaturereconstruction.Science China Earth Sciences,2014,57:999-1012. [16] Zheng Y H,Xie S C,Liu X M.n-Alkanol ratios as proxies of paleovegetation and paleoclimate in a peat-lacustrine core in southern China since the last deglaciation.Frontiers of Earth Science in China,2009,3(4):445-451. [17] 尹红珍,姚鹏,于志刚.边缘海环境中陆源有机质的化学生物标志物研究进展.海洋环境科学,2012,31(1):128-135. Yin H Z,YaoP,Yu Z G.Study advances in chemical biomarkers of terrestrial organic matter in marine margins environment.Marine Environmental Science,2012,31(1):128-135. [18] Santos E S,Carreira R D S,Knoppers B A.Sedimentary sterols as indicators of environmental conditions in Southeastern Guanabara Bay,Brazil.Brazilian Journal of Oceanography,2008,56(2):97-113. [19] Derrien M,Cabrera F A,Tavera N L V.Sources and distribution of organic matter along the Ring of Cenotes,Yucatan,Mexico:Sterol markers and statistical approaches.Science of the Total Environment,2015,511:223-229. [21] Canuel E A,Freeman K H,Wakeham S G.Isotopic composition of lipid biomarker compounds in estuarine plants and surface sediments.Limnol Oceanogr,1997,42:1570-1583. [20] Killops S D,Frewinn L.Triterpenoid diagenesis and cuticular preservation.Organic Geochemistry,1994,21(12):1193-1209. [22] Zhang Z H,Wan T T,Peng X Y.Distribution and sources of oxygenated non-hydrocarbons in topsoil of Beijing,China.Environmental Science and Pollution Research,2016,23:16524 -16541. [23] Celerier J,Rodier C,Favetta P.Depth-related variations in organic matter at the molecular level in a loamy soil:Reference data for a long-term experiment devoted to the carbon sequestration research field.European Journal of Soil Science,2009,60:33-43. [24] Pisani O,Dodds W K,Jaffé R.Characterizing organic matter inputs to sediments of small,intermittent,prairiestreams:A molecular markerand stable isotope approach.Aquatic Sciences,2016,78:343-354. [25] Valitova J N, Sulkarnayeva A G,Minibayeva F V.Plantsterols:diversity,biosynthesis,and physiological functions.Biochemistry(Moscow),2016,81(8):819-834. [26] Charles C N,Elijah O O,John G,Charles G,James M K.Fingerprints of upstream catchment land use in suspended particulate organic matter (SPOM) at the river discharge sites in Lake Victoria (Kenya):Insights from element,stable isotope and lipid biomarker analysis.Aquatic Sciences,2017,79:73-87. [27] Atanassova I,Teoharov M.Nature and origin of lipids in clay fractions from a fluvisol in a sewage sludge deposition field.Water Air & Soil Pollution,2010,208:295-304.1 材料与方法
1.1 研究区概况
1.2 样品采集与处理
1.3 试验方法
1.4 数据处理
2 结果与分析
2.1 单种植物醇类分布特征
2.2 退化高寒草甸植物中醇类含量
2.3 退化高寒草甸土壤中醇类含量
2.4 未退化高寒草甸植物中醇类含量
2.5 未退化高寒草甸土壤中醇类含量
2.6 高寒草甸植物与土壤中醇类比较
3 讨论与结论