低温弱光胁迫下外源ASA与CaCl2对菊花叶片AsA-GSH循环的影响
2018-05-28杨庆贺郑成淑
杨庆贺,郑成淑
低温弱光胁迫下外源ASA与CaCl2对菊花叶片AsA-GSH循环的影响
杨庆贺1,郑成淑2*
1. 山东农业大学后勤管理处, 山东 泰安 271018 2. 山东农业大学 园艺科学与工程学院, 山东 泰安 271018
以切花菊品种‘神马’为材料,研究了低温弱光胁迫下乙酰水杨酸(ASA)和CaCl2处理对菊花叶片抗坏血酸-谷胱甘肽循环中防御系统酶活性和抗氧化物质含量的影响,探讨了ASA和CaCl2缓解菊花对低温弱光胁迫效应的可能的生理机制。结果表明:低温弱光胁迫下,菊花叶片超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)、单脱氢抗坏血酸还原酶(MDAR)和脱氢抗坏血酸还原酶(DHAR)的活性均呈不同程度先上升后下降趋势,但与对照相比,外源ASA、CaCl2和ASA+CaCl2处理显著提高了菊花叶片SOD、APX、GR、MDAR和DHAR活性,其中以ASA+CaCl2处理的效果最为显著。低温弱光胁迫下,菊花叶片还原型抗坏血酸(AsA)和还原型谷胱甘肽(GSH)含量减少,氧化型抗坏血酸(DAsA)和氧化型谷胱甘肽(GSSG)含量增加,但与对照相比,外源ASA、CaCl2和ASA+CaCl2处理显著减小了AsA和GSH含量的下降幅度以及DHA和GSSG含量的上升幅度,并减少了菊花叶片H2O2的含量。表明低温弱光胁迫下,外源ASA和CaCl2处理可通过提高AsA-GSH循环系统的代谢活动,减轻了活性氧对菊花幼苗的伤害,从而提高了菊花对低温弱光的耐性,而且ASA与CaCl2复配处理优于ASA或CaCl2单独处理。
菊花; 低温弱光; ASA; CaCl2; 抗坏血酸-谷胱甘肽循环
北方地区日光温室菊花生产中,常因冬季连续几天的阴雨雪天,使菊花植株常处于低温和弱光胁迫环境中,给菊花的生产造成不良影响[1]。低温弱光胁迫下,植物体内产生大量的活性氧物质,能够破坏叶绿体、细胞膜、蛋白质及核酸等,扰乱有机体正常生命活动的动态平衡[2]。
阿司匹林为市售阿司匹林肠溶片(Aspirin entericcoated tablets,Asp),主要成分为乙酰水杨酸[2-(乙酰氧基)苯甲酸]。乙酰水杨酸(ASA)是水杨酸(SA)的衍生物,因其价格低廉,可代替SA在农业生产上应用。SA是植物体内普遍存在的酚类化合物,它不仅参与调节植物的许多生理过程,如植物开花、种子发芽、气孔关闭、离子吸收等,能诱导提高植物对真菌、细菌和病毒等生物胁迫[3,4]及重金属、低温、热激和盐害等非生物胁迫的抗性[5-7]。
Ca2+作为外界刺激信号的“第二信使”,广泛参与并调节植物体内的生理生化反应。大量研究表明,Ca2+在多种作物的抗热、抗冷、抗盐、抗旱等抗逆性中起着重要作用[8,9]。也有研究表明,外源SA和Ca2+处理可以提高高温胁迫和低温胁迫下的植物体内保护酶活性,对植物光合系统起到保护作用[9,10],但ASA和CaCl2处理对菊花低温弱光胁迫缓解机理的研究未见报道。
本试验以切花菊‘神马’(‘Shenma’)为试材,研究ASA和CaCl2单一和复配处理对低温弱光逆境下菊花叶片AsA-GSH循环系统中的几种酶活性及抗氧化物质含量的影响,探讨ASA和CaCl2对植物抗逆的缓解机理,为ASA和CaCl2的合理利用提供理论依据。
1 材料和方法
1.1 植物材料和处理
试验材料选用切花菊品种‘神马’(‘Shenma’)。盆栽(基质为珍珠岩:蛭石=1:1,v/v)幼苗(1株1盆)在日光温室内自然光照下长至株高约30 cm、叶片数20片左右时,挑选生长一致、长势良好的植株共200株,用清水将全株冲洗干净后,分别用0.05% ASA、10 mmol/L CaCl2、0.05% ASA +10 mmol/L CaCl2处理,以相同条件下喷施蒸馏水的苗为对照(每处理50株),溶液均匀喷洒于菊花叶片正、背面,以不形成可见的液珠为度。间隔24 h连喷2次,第二次喷后24 h后将所有植株移入温度12 ℃/8 ℃(昼夜),PFD 60 μmol·m-2·s-1的低温弱光的人工气候室。光周期均设为白天15 h,黑夜9 h。在低温弱光胁迫第0、1、3、5、7 d分别选取植株上部第4~5节位叶片,测定各项指标,3次重复。试验期间各处理其他环境条件及管理措施都保持一致。
1.2 测定项目和方法
1.2.1 几种酶活性和抗氧化物质含量测定SOD和APX活性采用[11]的方法。GR、DHAR和MDAR活性参考[12]的方法,AsA和DAsA含量参考[13]方法,GSH和GSSG含量参考[14]的方法,H2O2含量参照[15]的方法测定。采用Excel软件作图,采用DPS统计软件中的Duncan’s新复极差法对数据进行统计分析。
2 结果与分析
2.1 低温弱光胁迫下ASA和CaCl2对菊花叶片SOD、APX、GR活性的影响
SOD是植物防御体系中的第一道防线,能催化活性氧(如O2-.、H2O2、·OH、1O2等)歧化生成O2和H2O2,APX则以AsA为电子供体将H2O2还原成H2O,GR可以利用NADPH的电子将GSSG还原为GSH,从而使细胞内胱甘肽库保持在还原状态,在维持AsA-GSH循环的有效运行及对氧化胁迫的响应起重要作用[16]。从图1可以看出,低温弱光胁迫下,所有处理的SOD和APX活性均呈先上升后下降趋势,GR活性只在ASA+CaCl2处理中出现略微上升,其他处理均有所下降。但ASA、CaCl2和ASA+CaCl2处理的SOD、APX和GR活性始终比对照有所增加,在胁迫第7d时,ASA、CaCl2和ASA+CaCl2处理的菊花叶片SOD活性比对照分别增加13.86%、9.03%和18.44%;APX活性比对照分别增加31.11%、16.22%和40.38%,GR活性也比对照分别增加了38.28%、29.27%和51.67%,而且SOD、APX和GR活性在ASA+CaCl2复配处理区始终保持最高水平,其次是ASA处理优于CaCl2处理。说明外源ASA、CaCl2和ASA+CaCl2处理均可提高低温弱光胁迫下菊花叶片SOD、APX和GR活性,从而增强体内清除H2O2的能力。
2.2 低温弱光胁迫下ASA和CaCl2对菊花叶片单脱氢抗坏血酸还原酶(MDAR)和脱氢抗坏血酸还原酶(DHAR)的活性的影响
MDHAR和DHAR对维持细胞内重要的抗氧化剂AsA和GSH水平具有重要作用。GSH是DHAR催化再生AsA的底物,而AsA在APX催化下清除H2O2的过程中,AsA作为电子供体被氧化为MDHA和DHA(氧化型抗坏血酸),然后MDHA和DHA被MDAR和DHAR再还原为AsA,因此MDAR和DHAR是AsA-GSH循环中再生AsA的两个重要酶[17]。
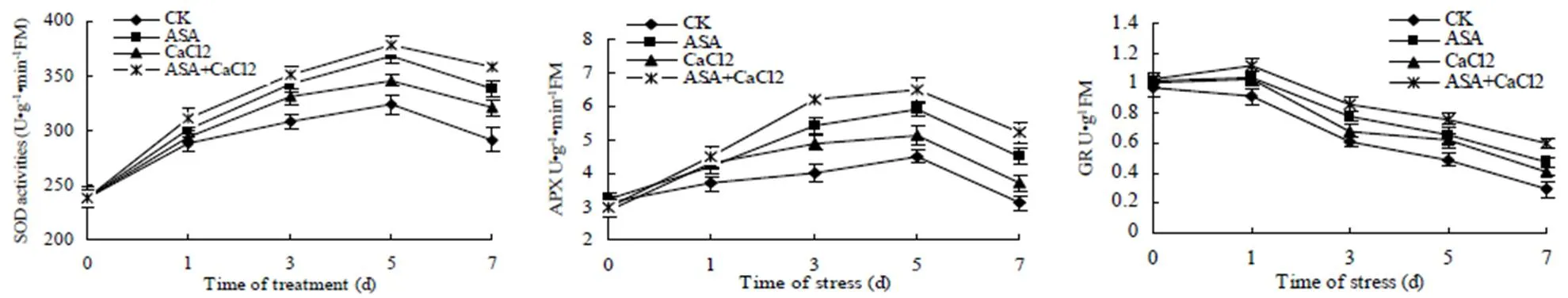
图 1 ASA 和CaCl2处理对低温弱光胁迫下菊花叶片SOD、APX和GR活性的影响
由图2可以看出,低温弱光胁迫下,MDAR和DHAR活性呈先上升后下降的趋势。ASA、CaCl2和ASA+CaCl2处理的菊花叶片MDAR和DHAR的活性始终比对照保持较高水平。在胁迫第7 d时,与对照相比,MDAR活性分别增加了23.58%、17.35%和34.15%,DHAR活性分别增加了36.88%、22.44%和52.02%。说明ASA、CaCl2和ASA+CaCl2处理提高了菊花叶片AsA-GSH循环系统的酶活性,从而提高了菊花对低温弱光胁迫逆境的抵抗力,而且ASA+CaCl2复配处理效果优于ASA和CaCl2单独处理。

图 2 ASA 和CaCl2处理对低温弱光胁迫下菊花叶片MDAR和DHAR活性的影响
2.3 低温弱光胁迫下ASA和CaCl2对菊花叶片抗坏血酸(AsA)和谷胱甘肽(GSH)含量的影响
抗坏血酸(AsA)和谷胱甘肽(GSH)是普遍存在于植物体内的小分子水溶性非酶抗氧化物质,其代谢途径AsA-GSH循环系统在植物清除活性氧,抵抗氧化胁迫,对诱导植物防御基因的表达、稳定蛋白质结构,促进细胞生长等方面具有重要功能,并且其功能的发挥与它们的存在形态密切相关[18]。由图3可以看出,低温弱光胁迫下,菊花叶片还原型抗坏血酸(AsA)和还原型谷胱甘肽(GSH)含量出现下降趋势,而氧化型抗坏血酸(DAsA)和氧化型谷胱甘肽(GSSG)含量出现上升趋势,而外源ASA、CaCl2和ASA+CaCl2处理与对照相比,明显减小了菊花叶片AsA和GSH含量下降幅度以及DAsA和GSSG含量上升幅度。说明ASA、CaCl2和ASA+CaCl2处理可以提高菊花叶片AsA-GSH循环系统中重要的抗氧化酶活性,从而提高了植株的防御性能,其中ASA处理效果优于CaCl2处理,而且ASA+CaCl2复配处理效果优于ASA和CaCl2单独处理效果。
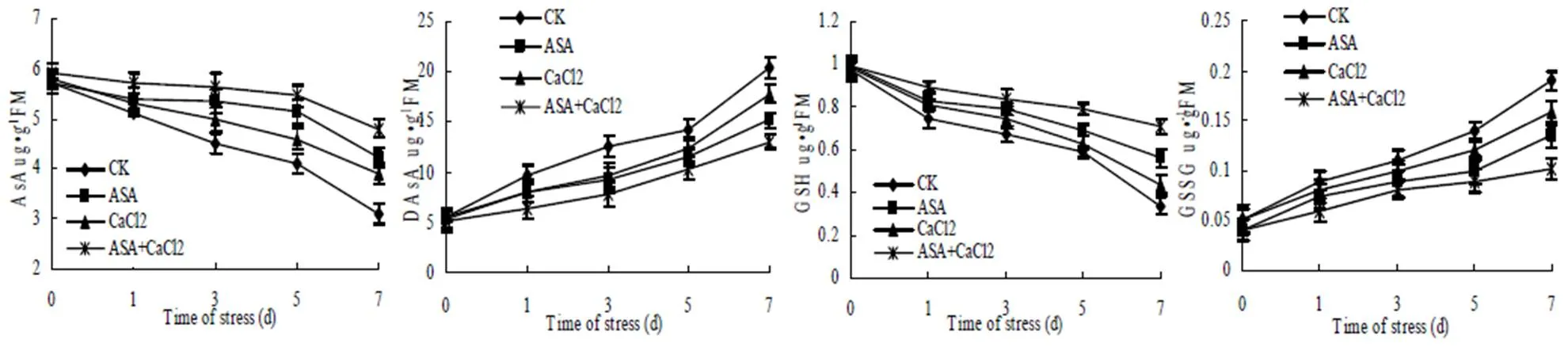
图 3 ASA 和CaCl2处理对低温弱光胁迫下菊花叶片抗坏血酸和谷胱甘肽含量的影响
Fig.3 Effects of ASA andCaCl2on the contents of ascorbate and glutathione of the leaves of chrysanthemum under the stress of low temperature and poor light
2.4 低温弱光胁迫下ASA和CaCl2对菊花叶片过氧化氢(H2O2)含量的影响
植物处于逆境胁迫条件时,细胞内积累大量的H2O2等活性氧,从而使细胞质膜过氧化加剧,对膜系统产生损伤,导致细胞受到伤害。由图4可知,低温弱光胁迫下,菊花叶片H2O2含量均呈先迅速上升后下降再回升的趋势。但ASA、CaCl2和ASA+CaCl2处理显著减少了菊花叶片H2O2含量上升幅度,说明低温弱光胁迫下,外源ASA、CaCl2和ASA+CaCl2处理明显增加了抗氧化酶的活性,从而减少了活性氧对植株的伤害,而且ASA处理的清除H2O2效果比CaCl2处理效果好,而且ASA+CaCl2复配处理的清除H2O2效果比ASA和CaCl2和单一处理效果更好。

图 4 ASA 和CaCl2处理对低温弱光胁迫下菊花叶片过氧化氢含量的影响
3 讨论
植物在逆境下或衰老时H2O2等活性氧发生积累并氧化胞内核酸、蛋白质等生物大分子,使细胞膜遭受损害,加速细胞衰老和解体[19],此时,植物体内的SOD、APX、MDAR、DHAR和GR等酶作为AsA-GSH循环系统中清除H2O2等活性氧的重要抗氧化酶发挥着重要作用[18]。本试验结果表明,低温弱光胁迫下,外源ASA、CaCl2和ASA+CaCl2处理有效提高了菊花叶片SOD、APX、GR、MDAR和DHAR的活性,同时发现H2O2出现先上升后下降再回升的趋势,这可能是因为胁迫初期的H2O2的迅速积累,诱发了SOD、APX以及MDAR等抗氧化酶的活性,但随着胁迫时间的延长,菊花体内活性氧水平持续增加,抑制了酶的活性,AsA-GSH循环系统正常代谢被破坏,导致后期H2O2再一次积累,但是外源ASA、CaCl2和ASA+CaCl2处理均减小了菊花叶片H2O2增加的幅度,说明外源ASA、CaCl2和ASA+CaCl2是通过提高菊花叶片AsA-GSH循环中的抗氧化酶活性和抗氧化物质,有效的减少了H2O2大量积累,从而缓解了低温弱光对菊花植株的伤害程度。
抗坏血酸(AsA)是细胞内糖代谢过程中产生的一种重要的活性氧清除剂,也是AsA-GSH循环中重要的抗氧化剂。AsA含量、氧化还原状态(AsA/DAsA比值)及其合成和代谢相关酶类活性的变化与植物对环境胁迫的响应关系密切,AsA可直接参与超氧阴离子的清除,维生素E的再生和叶黄素循环中紫黄质的还原反应[20]。因此,植物体内保持相对稳定的AsA水平对细胞正常生理代谢具有重要意义。在本试验中,低温弱光胁迫下,外源ASA、CaCl2和ASA+CaCl2处理减小了菊花叶片AsA水平的下降幅度和DHA含量的上升幅度,说明外源ASA、CaCl2和ASA+CaCl2处理可通过提高抗氧化剂AsA水平,减少了H2O2对植物的氧化损伤,提高了菊花抗低温弱光性。
谷胱甘肽(GSH)与植物对多种环境胁迫的忍耐能力密切相关。正常生理环境下,GSSG在NADPH存在时可被GR还原为GSH,GR活性直接影响细胞GSH库的水平。当植物处于逆境胁迫时,细胞处于还原力不足状态,此时胞内GSH含量减少,GSSG含量相对增加,GSH/GSSG比值下降[21]。GSH在植物胁迫抵抗中的主要作用是通过AsA-GSH循环系统使DAsA再还原成AsA而实现的,因此,在植物细胞内保持较高的GSH含量可使膜蛋白结构稳定,因此,GSH含量和GR活性水平被认为是机体抗氧化状态的重要标志[18]。本试验结果表明,低温弱光胁迫下,所有处理均使菊花叶片GSH和GR水平均下降,而GSSS水平上升,但外源ASA、CaCl2和ASA+CaCl2处理缓解了菊花叶片GSH含量的下降幅度和GSSG含量的上升幅度,说明外源ASA、CaCl2和ASA+CaCl2处理可通过提高GR活性使菊花叶片保持相对较高GSH含量,有效防止菊花在低温弱光胁迫下细胞膜发生损伤,提高其忍耐性[22]。
植物在逆境条件下是否受到伤害与植物种类、逆境强度和持续时间有关。在逆境初期,植物有一个应激保护反应,SOD、APX、MDAR和DHAR等抗氧化酶的活性增加。植物的自我保护能力有限,随着胁迫时间的延长,过多的活性氧不能及时有效清除,最终导致植物受到逆境伤害。本研究中还发现,在几种抗氧化酶增加的同时,也消耗了大量的AsA和GSH,而它们的产物DAsA和GSSG含量不断增加。说明菊花在受到低温弱光胁迫时,抗氧化酶与抗氧化剂是共同协调作用,以减轻不良环境造成的伤害。
总之,外源ASA和CaCl2预处理减轻了低温弱光胁迫对菊花叶片AsA-GSH循环系统中抗氧化防御酶和抗氧化物质的破坏,使保护酶保持较高活性,使AsA-GSH循环代谢抑制程度受到缓解,减少了H2O2大量积累,降低了膜脂过氧化的程度,维护膜结构与功能相对完整,提高了菊花抵抗低温弱光的能力。而且ASA单一处理在增强SOD、APX和GR等活性及减少H2O2产生等方面的效果优于CaCl2单独处理;而ASA和CaCl2二者混合使用,效果优于二者单独使用。但是,ASA和CaCl2对植物的抗逆性机制并非只是在活性氧清除水平上,因此,还需进一步深入研究。
[1] 梁芳,郑成淑,孙宪芝,等.低温弱光胁迫及恢复对切花‘神马’幼苗光合作用和叶绿素荧光参数的影响[J].应用生态 学报,2009,19(9):2149-2154
[2] 艾希珍,王秀峰,崔志峰,等.钙对弱光亚适温下黄瓜光合作用的影响[J].中国农业科学,2006,39(9):1865-1871
[3] Kang GZ, Wang CH, Sun GC,Salicylic acid changes activities of H2O2-metabolizing enzymes and increases the chilling tolerance of banana seedlings[J]. Environ. Exp. Bot., 2003,50:9-15
[4] Horvǎth E, Pǎl M, Szalai G,. Induction of abiotic stress tolerance by salicylic acid signaling[J]. Journal of Plant Growth Regulation, 2007,26: 290-300
[5] Larkindale J, Knight MR. Protection against the stress induced oxidative damage in arabidopsis involves calcium, ethylene and salicylic acid[J]. Plant Physiology, 2002,128:682-695
[6] Metwally A, Finkemeier I, Georgi M. Salicylic acid alleviates the cadmium toxicity in barley seedlings[J]. Plant Physiology, 2003,132:272-281
[7] Stevens J, Senaratna T, Sivasithampara K. Salicylic acid induces salinity tolerance in tomato (cv. Roma): Associated changes in gas exchange, water relations and membrane stabilization[J]. Journal of Plant Growth Regulation, 2006,49:77-83
[8] 孙宪芝,郑成淑,王秀峰.高温胁迫对切花菊‘神马’光合作用与叶绿素荧光的影响[J].应用生态学报,2008,19(10):2149-2154
[9] Wang Y, Yang ZM, Zhang QF,. Enhanced chilling tolerance inby pre-treatment with salicylic acid, calcium chloride, hydrogen peroxide or 6-benzylaminopurine[J]. Biologia Plantarum,2009,53:179-182
[10] 李天来,李淼,孙周平.钙和水杨酸对亚高温胁迫下番茄叶片保护酶活性的调控作用[J].应用生态学报,2009,20(3):586-590
[11] 李合生.植物生理学实验指导书[M].北京:高等教育出版社,2000:184-197
[12] Miyake C, Asada K. Thylakoid-bound ascorbate peroxidase in spinach chloroplasts and photoreduction of its primary oxidation product monodehydroascorbate radicals in thylakoids[J]. Plant and Cell Physiology, 1992,33:541-553
[13] Logan BA, Grace SC, Adams III WW,. Seasonal differences in xanthophylls cycle characteristics and antioxidants ingrowing in different light environments[J]. Oecologia, 1998,116:9-17
[14] Griffith OW. Determination of glutathione and glutathione disulfide using glutathione reductase and 2-vinylpyridine[J]. Analytical Biochemistry, 1980,106:207-212
[15] Petrie SE, Jaekson TL. Eeffects of nitrogen fertilization on manganese concentration and yield of parley and oats[J]. Soil Science Society of America Journal, 1984,48:319-322
[16] 高俊杰,秦爱国,于贤昌.低温胁迫对嫁接黄瓜叶片抗坏血酸-谷胱甘肽循环的影响[J].园艺学报,2009,36(2):215-220
[17] 吴锦程,陈建琴,梁杰,等.外源一氧化氮对低温胁迫下枇杷叶片AsA-GSH循环的影响[J].应用生态学报,2009,20(6):1395-1400
[18] Pukacka S, Ratajczak E. Antioxidative response of ascorbate-glutathione pathway enzymes and metabolites to desiccation of recalcitrantseeds[J]. Journal of Plant Physiology, 2006,163:1259-1266
[19] 孙宪芝,郭先锋,郑成淑,等.高胁迫下外源钙对菊花叶片光合机构和活性氧清除酶系统的影响[J].应用生态学 报,2008,19(9):1983-1988
[20] 罗娅,汤浩茹,张勇.低温胁迫对草莓叶片SOD和AsA-GSH循环酶系统的影响[J].园艺学报,2007,34(6):1405-1410
[21] Walker MA, McKersie BD.Roleof ascorbate-glutathione antioxidant system in chilling resistanceof tomato[J]. J Plant Physiol, 1993,141:234-239
[22] Zhong C, Daniel RG. The ascorbic acid redox state controls guard cell signaling and stomatal movement[J]. The Plant Cell, 2004,16:1143-1162
Effects of Exogenous Acetylsalicylic Acid and Calcium Chloride on AsA-GSH Cycle inChrysanthemum Leaves under Stress of Low Temperature and Poor Light
YANG Qing-he1, ZHENG Cheng-shu2*
1.271018,2.271018,
Taking cut flower chrysanthemum ‘Shenma’ as testmaterial, the effects of acetylsalicylic acid (ASA) and CaCl2treatments on antioxidant enzyme activities and antioxidant substances in the AsA-GSH cycle of the leaves of chrysanthemum under stress of low temperature and poor light were investigated, and the possible physiological mechanisms of ASA and CaCl2was discussed. The results showed that under the stress of low temperature and poor light, the activities of peroxide dismutase (SOD), ascorbate peroxidase (APX), glutathione reductase (GR), monodehydroascorbate reductase (MDAR) and dehydroascorbate reductase (DHAR) of the leaves of chrysanthemum increased at first and then decreased in all treatments, but they increased significantly by the treatments of ASA and CaCl2addition compared with those of controls, and the effects of Induced resistance effect of ASA and CaCl2mixture treatments was better than single ASA or CaCl2.treatment. Also, under the stress of low temperature and poor light, contents of ascorbate (AsA) and glutathione (GSH) decreased while the contents of dehydroascorbate (DAsA) and oxidized glutathione (GSSG) increased in the leaves of chrysanthemum, but ASA, CaCl2and ASA+CaCl2treatments reduced the scope of reduction of the contents of AsA and GSH and the scope of increasing of the contents of DAsA and GSSG of the leaves of chrysanthemum compared with the controls, and also ASA, CaCl2and ASA+CaCl2treatments reduced significantly the contents of H2O2of the leaves of chrysanthemum. The results indicated that ASA and CaCl2treatments could lighten the damage from H2O2by increasing the AsA-GSH cycle systems, so that increase the damage from the stress of low temperature and poor light, Induced resistance effect of ASA and CaCl2mixture was better than single ASA or CaCl2.
chrysanthemum; low temperature and low light; ASA; CaCl2; AsA-GSH cycle
S68
A
1000-2324(2018)03-0495-05
2017-03-14
2017-03-28
杨庆贺(1977-),男,硕士,工程师.研究方向:园林植物与观赏园艺. E-mail:yqh@sdau.edu.cn
Author for correspondence. E-mail:zcs@sdau.edu.cn
