用Box-Behnken原理优化纤维素酶-微波提取海红果渣中果胶的工艺研究
2018-05-28杜芳艳刘慧瑾温俊峰
李 梅, 杜芳艳, 刘慧瑾, 温俊峰
(榆林学院 化学与化工学院, 陕西 榆林 719000)
0 引言
果胶是一种以多聚α-1,4-D-半乳糖醛酸聚糖为骨架成分的植物酸性多糖,因其具有良好的胶凝性和乳化稳定性已成为食品工业、医药、日化及纺织行业中的一种重要的天然添加剂[1].此外它还具有护肤、防紫外线辐射、养颜美容、抗癌、抗腹泻和减肥等功效.从上世纪末开始,果胶的世界贸易量每年约为30 000 t,占食品胶贸易总量10%左右,且需求量呈每年4%~5%的高度增长.随着人们生活质量不断提高,国内对果胶的需求量也在逐年增加[2].
提取果胶的方法有传统的酸提取法、超声波辅助提取法、酶解法、微波法、螯合剂法等[3].但这些单一的提取技术,均存在不足,如酸提法耗时长、温度高,且存在多糖、色素等共提取的现象,造成果胶纯度较低的问题[4],微波法存在温度升高过快,不易控制[5,6],只有控制好微波提取参数,才能保证果胶的提取率以及果胶品质的问题[7].提取法中酶用量大,价格高,酶活性对外界条件变化较敏感,对实验条件控制要求较高,且原料不同使用酶的种类也不同等问题,阻碍了其应用.而采用复合辅助法提取技术,可一定程度弥补单一萃取技术存在的不足,从而提升提取效率和产品品质.采用复合辅助技术提取果胶的研究已有报道[8-11],但采用纤维素酶-微波辅助技术提取果胶的研究还未见报道.
海红果学名西府海棠,仅产于府谷县及其周边区域,是世界稀有的特色果品资源,富含钙、磷、氨基酸、维生素等营养成分和矿物质,含钙量为水果之冠,素有“钙王”之称,被当地农民称为“果中的鳖精”,主要用于制造果汁、果酒、果脯、饮料.在生产过程中产生大量果渣被扔掉,不仅浪费资源,而且污染环境.因此,我们采用纤维素酶-微波辅助技术提取海红果渣中的果胶,并通过响应面法对提取工艺进行优化,以求为海红果的有效开发利用提供技术支撑.
1 材料与方法
1.1 材料与仪器
1.1.1 主要材料与试剂
海红果渣:采自陕西省府谷县天安绿色农业科技开发有限公司.
试剂: D-半乳糖醛酸对照品(中国药品及生物制品鉴定所);咔唑(西安化学试剂公司);纤维素酶(西安化学试剂公司);所用试剂均为分析纯,实验用水为双蒸水.
1.1.2 主要仪器
MDS-8型多通量密闭微波化学工作站(上海新仪微波化学科技有限公司);pHS-25型酸度计(上海精密科学仪器厂); 722N型可见分光光度计(上海箐华科技仪器有限公司);SB-05型多功能粉碎机(上海市浦恒信息科技有限公司);ESJ60-4电子分析天平(沈阳龙腾电子有限公司).
1.2 实验方法
1.2.1 原料预处理及果胶提取
原料预处理及果胶提取流程如下:


称取2.000 g果渣粉,按照一定的料液比加入一定浓度的纤维素酶溶液(溶液的pH用0.02 mol/L 的盐酸调节至pH4.8),置于MDS-8型多通量密闭微波化学工作站中于在额定功率700 W的条件下,控制一定的提取温度、提取时间进行提取,提取结束后,混合物过滤,重复提取三次,合并滤液,滤液定容至100 mL得样品溶液.其中,微波功率虽然也可能是影响提取率的因素,但是,在前期的研究中,发现在微波功率为700 W时,该仪器才能正常运行(仪器的额定功率是700 W),因此,试验研究时没有考察微波功率对提取率的影响,而是直接选择可以使仪器正常运行的额定功率700 W.
1.2.2 标准曲线及果胶含量的测定
半乳糖醛酸是果胶最主要的组成成分,被广泛用作对照品分析果胶的含量[12,13],参照文献方法,采用咔唑-硫酸分光光度法测定[14],以 D- 半乳糖醛酸为标准品绘制标准曲线.其标准曲线方程为:
A=0.011 5x+0.020 4(R2=0.999 3)
(1)
式(1)中:A为波长 530 nm 处的吸光度;x为D- 半乳糖醛酸的含量(μg/mL).
准确量取样品储备液10.0 mL于50 mL烧杯中,加入1.0 mol/L硫酸溶液6.0 mL,在70 ℃水浴中加热20 min进行水解,水解液冷却至室温后移入50 mL容量瓶,水稀释定容,得到样品溶液.准确移取样品溶液10.0 mL并定容到50 mL,移取稀释后的样品溶液 l.0 mL于试管中,加入浓硫酸6.0 mL,边加边流水冷却,冷至室温后加入0.15%的咔唑无水乙醇溶液0.50 mL,摇匀,在室温下暗处放置30 min后,以试剂空白为参比,在530 nm处测定吸吸光度.样品中的果胶物质总含量以半乳糖醛酸表示.果胶得率计算如下:
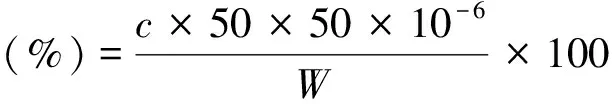
(2)
式(2)中:c为从标准曲线查得的所测果胶液中的半乳糖醛酸的浓度(mg/L);W为样品的质量,单位为g.
1.2.3 单因素实验
按照1.2.1方法,分别研究微波提取时间、料液比、纤维素酶加入量、微波提取温度、溶剂pH值对果胶得率的影响,确定各因素的最佳范围.相应面实验因素水平编码如表1所示.

表1 响应面实验因素水平编码
1.2.4 响应面法优化试验
在单因素实验的基础上,从经济性和可操作性综合考虑,固定加酶量为0.1 u/g,微波提取功率为700 W,料液比为1∶20,采用Box-Behnken原理对海红果渣中果胶得率影响较大的主要因素进行优化试验.选取溶剂的pH值A、微波提取时间B及提取温度C三个因素为水平因子,以海红果渣中果胶得率R1为目标,试验因子和水平编码如表1所示.通过 Design Expert 8.0 软件对试验进行回归分析,预测提取果胶的最优工艺参数.
2 结果与讨论
2.1 单因素实验
2.1.1 pH值对果胶得率的影响
固定纤维素酶的添加量为0.1 u/g,微波提取功率700 W,微波提取时间10 min,微波提取温度为37 ℃,料液比为1∶20,研究溶剂pH值的变化对果胶得率的影响,由图1可知,果胶得率在pH<4.8时随pH升高而增加,在pH值为4.8时达到最大,而pH>4.8时随pH升高果胶得率反而降低,这是因为酸度太小时,果胶会逐步水解成单糖,而酸度过大使得果胶分子甙键及酯键被破坏导致果胶发生脱酯裂解,同时酶对pH的变化比较敏感,酸度过大过小都会使酶的生物活性下降,从而导致果胶得率减小.所以pH值为4.8较合适.
2.1.2 微波时间对果胶得率的影响
按照2.1.1中所述,保持其他条件不变,溶剂的pH为4.8,研究微波提取时间对果胶得率的影响,由图2可知,在微波提取时间低于14 min或者高于14 min时,果胶得率都较14 min时低,这是因为微波加热可以促进原料薄壁组织细胞的破裂,比表面积增大、多孔渗透性和吸水能力提升[15],有利于细胞中果胶的充分溶出.因此,开始时,酶解反应产物随着微波时间的增加不断积累,酶解液中果胶产量增幅较大;酶解一段时间后,由于底物逐渐减少,微波高温长时间作用使果胶中的半乳糖醛酸分解,酶的活性减弱,果胶产量增幅缓慢,从而使果胶得率反而下降.
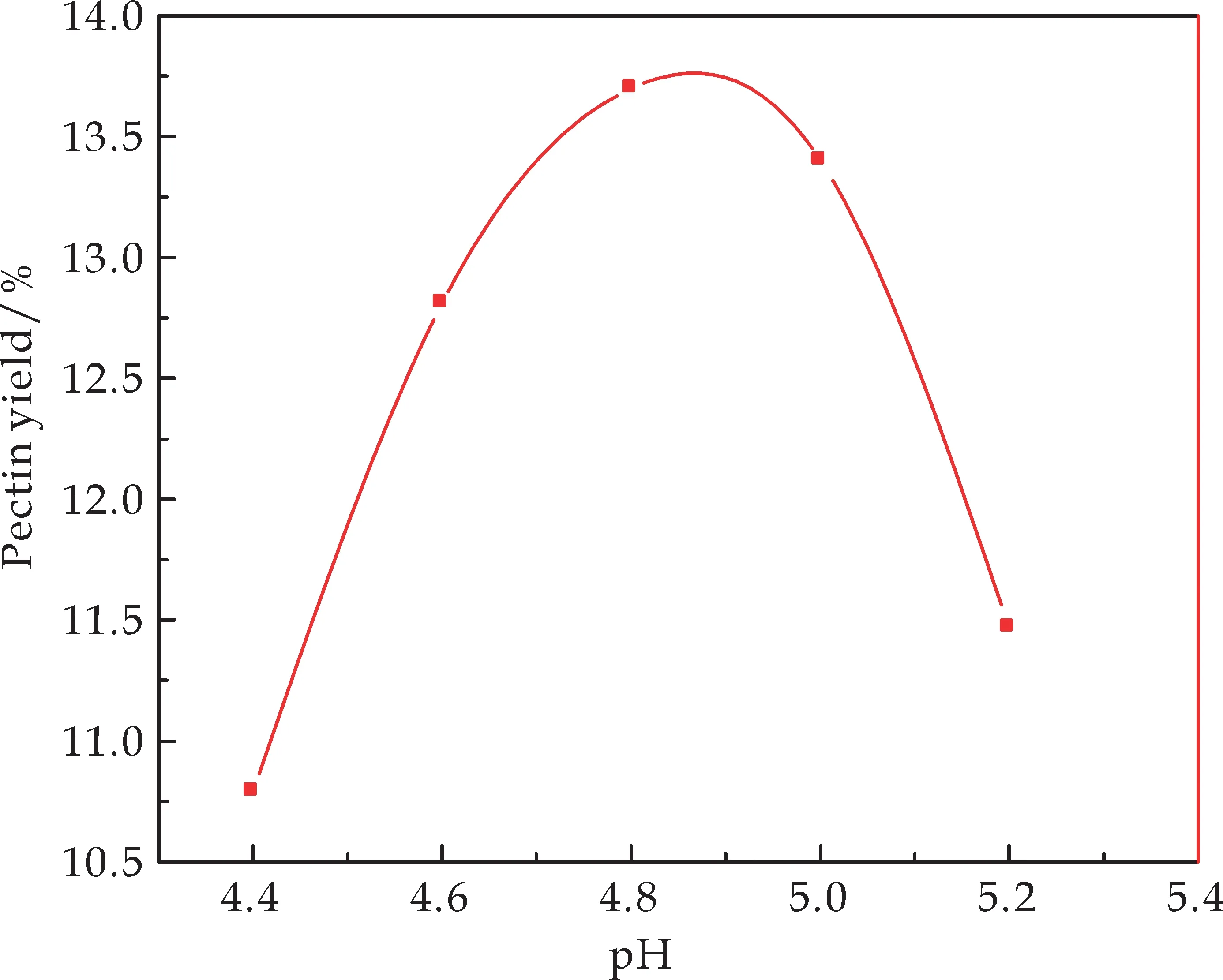
图1 pH值对果胶得率的影响
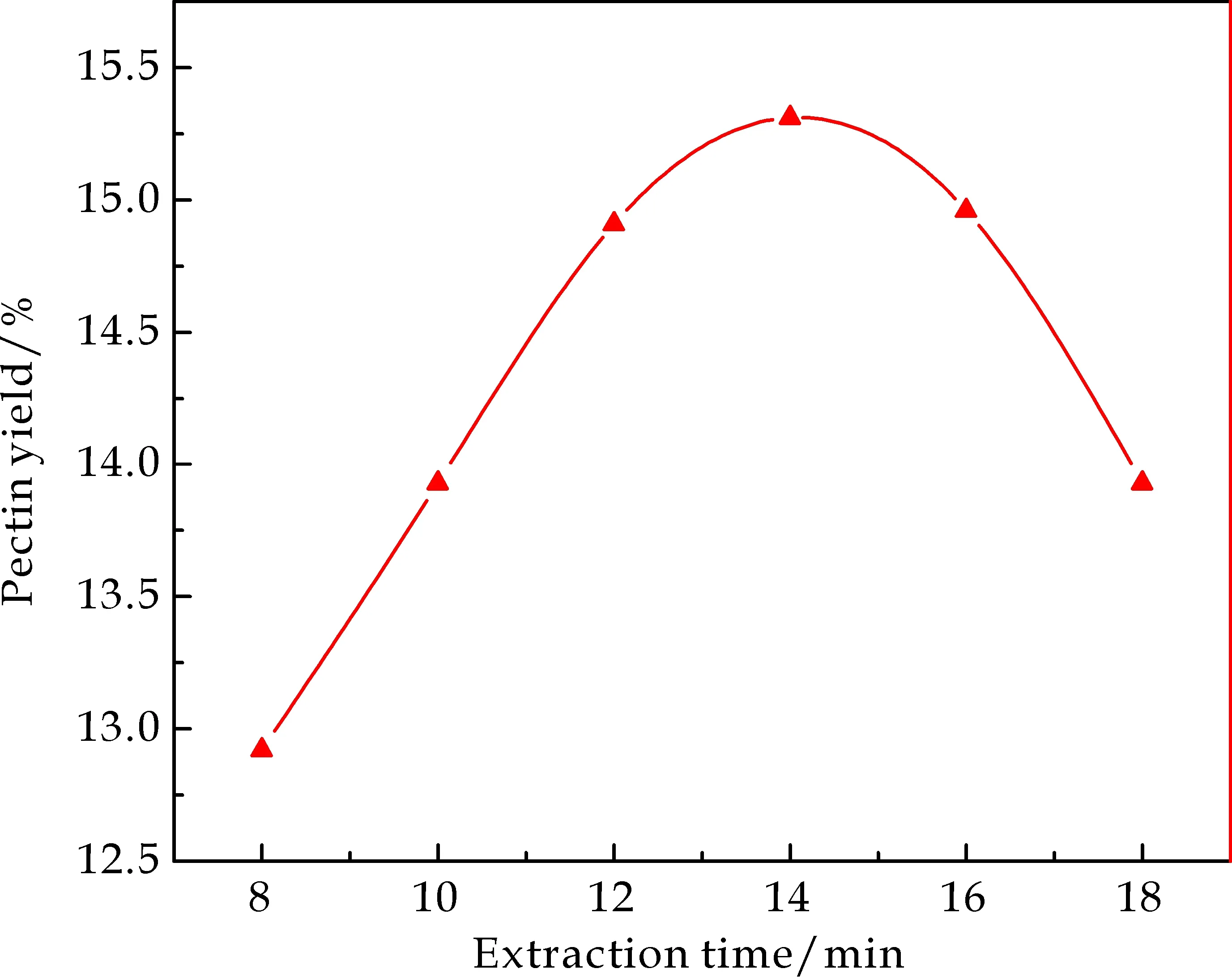
图2 提取时间对果胶得率的影响
2.1.3 料液比对果胶得率的影响
按照2.1.1中所述,保持其他条件不变,溶剂的pH为4.8,研究料液比对果胶得率的影响,由图3可知,料液比过大过小,都会使得果胶得率降低,当料液比为1∶20时果胶得率最大,料液比过小时,不利于果胶质水解成果胶,溶液中含有的果胶浓度低.料液比过大时,由于其他物质的溶出,造成过滤困难,整体的溶出率虽然达到最大,而果胶得率反而下降.
2.1.4 加酶量对果胶得率的影响
控制其他条件与2.1.1中相同,溶剂的pH为4.8,研究酶的加入量对果胶得率的影响,由图4可知,当加酶量小于0.1 u/g时果胶得率随酶浓度增加而增大,这是由于纤维素酶可选择分解植物细胞组织中的复合多糖体,将植物组织中的果胶释放出来,但当纤维素酶用量小于0.1 u/g时,酶解反应不充分,果胶得率较低.当加酶量大于0.1 u/g 时,加酶量继续增大,果胶得率略有增加,但变化不大.这是因为当底物浓度一定时,酶的浓度超过一定范围的话,它的催化效果(速率)并不会再上升,而是维持在一个平衡的状态.因此确定加酶量为0.1 u/g.
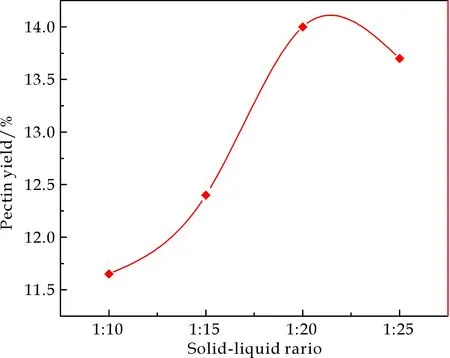
图3 料液比对果胶得率的影响
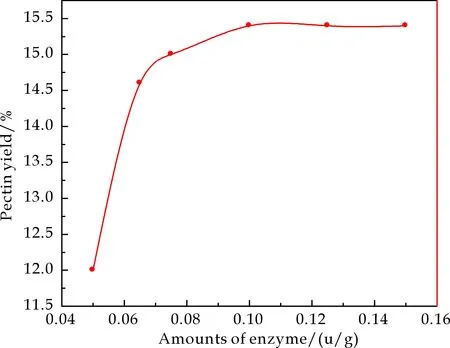
图4 加酶量对果胶得率的影响
2.1.5 微波提取温度对果胶得率的影响
控制其他条件与2.1.1中相同,溶剂的pH为4.8,研究提取温度对果胶得率的影响,由图5可知,微波温度在37 ℃时果胶溶出速率达到最大,果胶得率达到最高,当温度低于37 ℃或者高于37 ℃时,果胶得率都随着温度的降低或者升高而减小,这是因为温度的升高有利于增强纤维素酶对细胞壁纤维素的作用,使溶出的果胶不断增加[16],而且在37 ℃左右时,纤维素酶的活性最高,果胶的溶出速率达到最大,酶解液中果胶含量达到最高;但温度过高会导致酶蛋白变性失活,对细胞壁的作用减弱,从而影响果胶的充分溶出,另一方面,高温使果胶进一步水解成单糖,导致果胶得率随温度升高而降低.
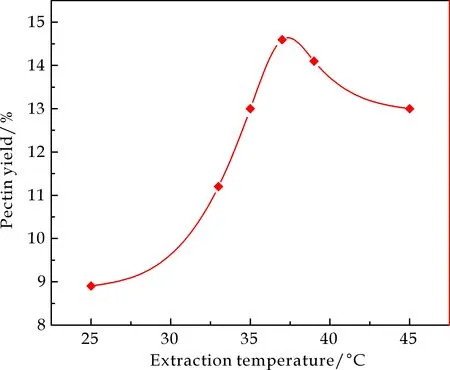
图5 提取温度对果胶得率的影响
2.2 响应面试验结果及分析
中心组合试验和响应面试验结果如表2所示.根据表2数据,用Design ExprtV7.1.3响应面分析软件对实验结果做多元二次拟合,得二次回归模型的拟合方程式为:
R1=15.18+0.45A+0.45B+0.15C+
0.32A·B-0.23A·C-0.17B·C-
0.40A2-0.65B2·0.40C2
(3)
采用Box-Behnken Design对上述试验的回归模型进行方差分析,结果如表3所示.分析表中数据,通过P值来判断[17]拟合方程中的每个因素对响应值影响的显著性.由表3可知,二次回归模型的F= 10.59,其(P>F)<0.01则表示二次回归模型具有极显著性.失拟项F=5.62,P=0.064 4>0.05,说明试验设计拟合效果好试验设计模型合理.微波提取时间B一次项和二次项、pH值A的一次项均达到极显著水平(P<0.01),微波提取温度C的一次项达到显著水平(P<0.05),表明微波提取时间、pH、提取温度对果胶得率具有重要的影响,是不可忽略的因素,且微波提取时间B和pH值A的组合项为显著水平(P<0.05);说明提取时间和pH值的交互影响也是重要因素;其他各项均P>0.05,说明其他因素与另外因素的相互作用不明显;由此可以看出回归模型不是简单的线性关系.比较回归方程中各因素的系数和表3中的F值大小,可以得到各因素对提取海红果渣果胶得率影响的大小顺序为:微波提取时间>溶剂pH>微波提取温度.模型调整确定相关系数R2=0.931 6,说明该模型能较好的解释所选因素变量与响应值之间的实际关系,可用于确定提取工艺条件.
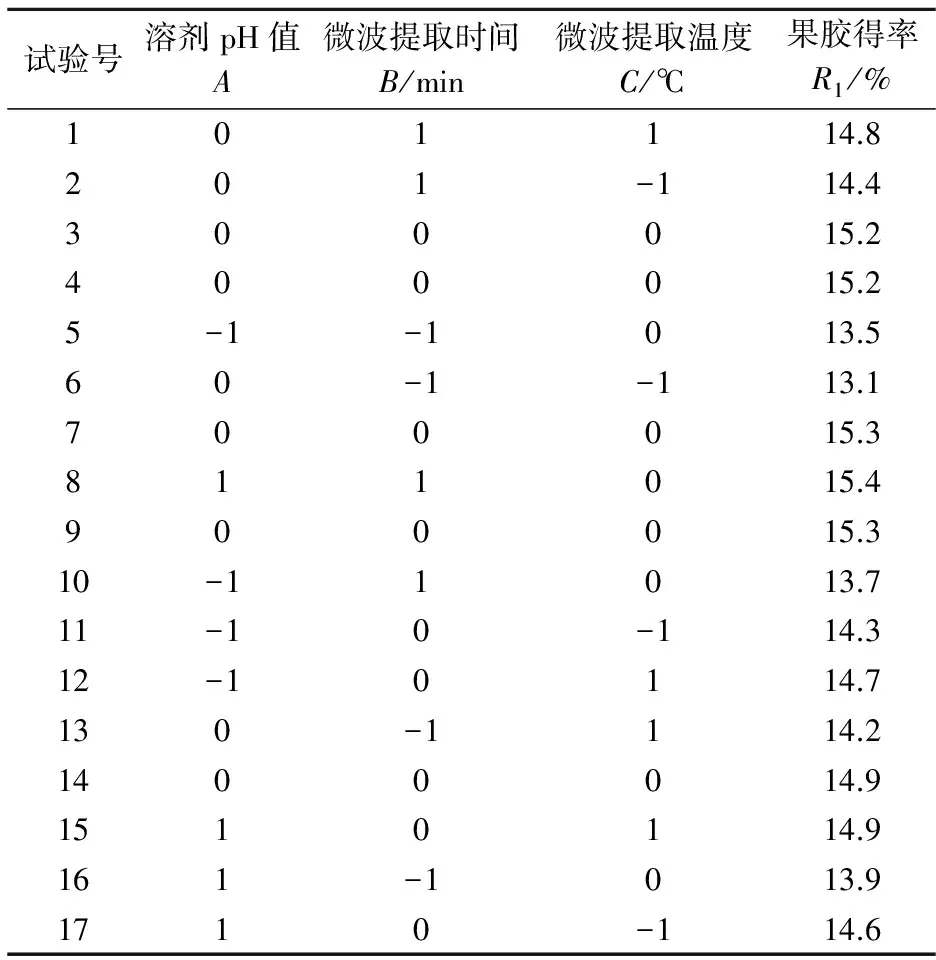
表2 响应面分析方案及实验结果
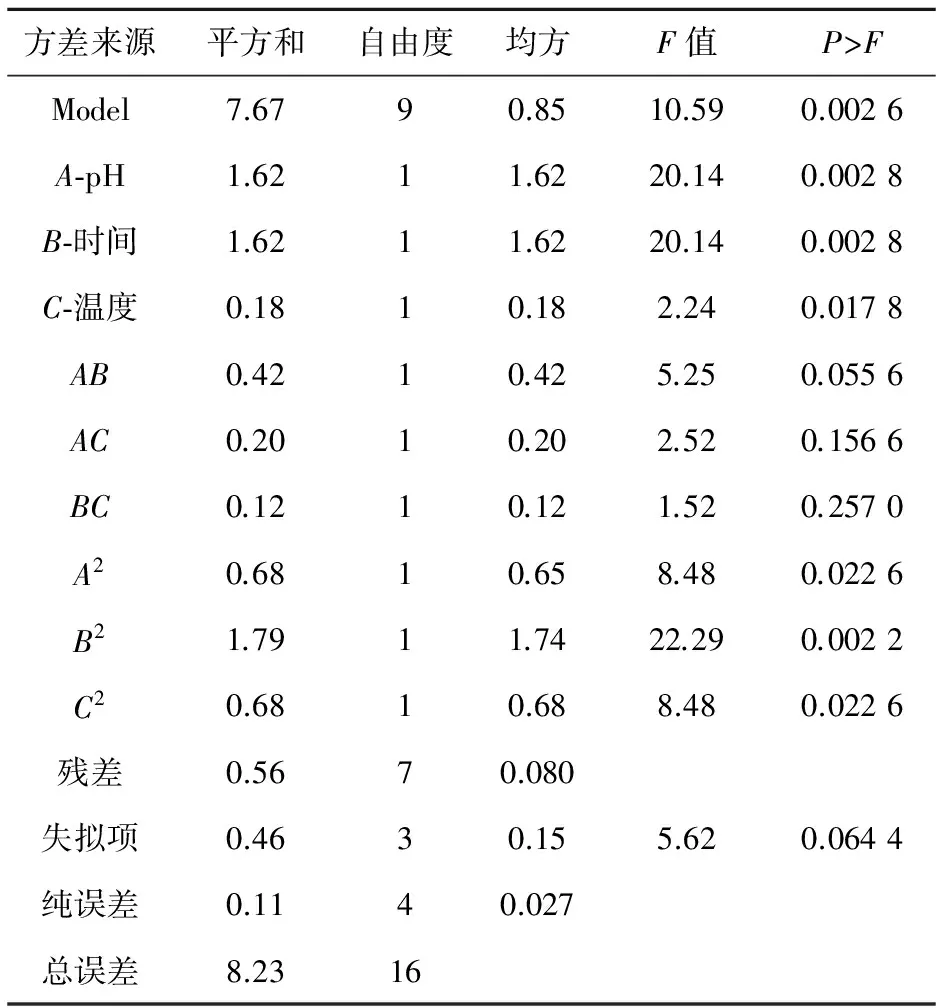
表3 回归模型方差分析
为了更直观地表现各因素及两两因素的交互作用对果胶提取率的影响,以任意两因素为考查对象,剩余因素水平值取为零,进行降维分析,得出三个开口向下的响应曲面图(如图6~8所示),且其中心位于所研究的区域内,且随着每个因素值的增大,响应值增大,当响应值增大到极值后,又随着因素值的增大逐渐减小,故该模型有稳定点,且稳定点是最大值.说明响应值在研究的区域范围内存在最大值,通过Design-Expert8.0软件拟合得到的纤维素酶/微波辅助提取海红果渣中果胶的最佳工艺条件为:在微波功率为700 W,纤维素酶的加入量为0.1 u/g,料液比为1∶20(g/mL)的条件下,控制溶剂的pH值为4.97,微波提取时间15.03 min,微波提取温度为37.94 ℃,模型预测果胶得率为15.53%.
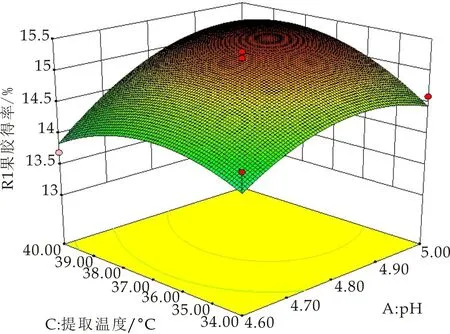
图6 R=(A,C)的响应面图
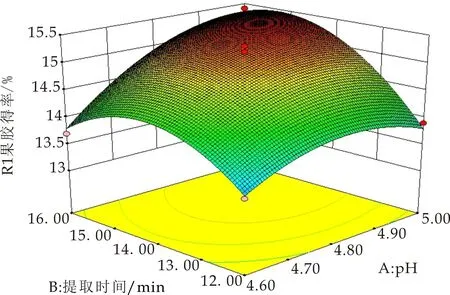
图7 R=(A,B)的响应面图
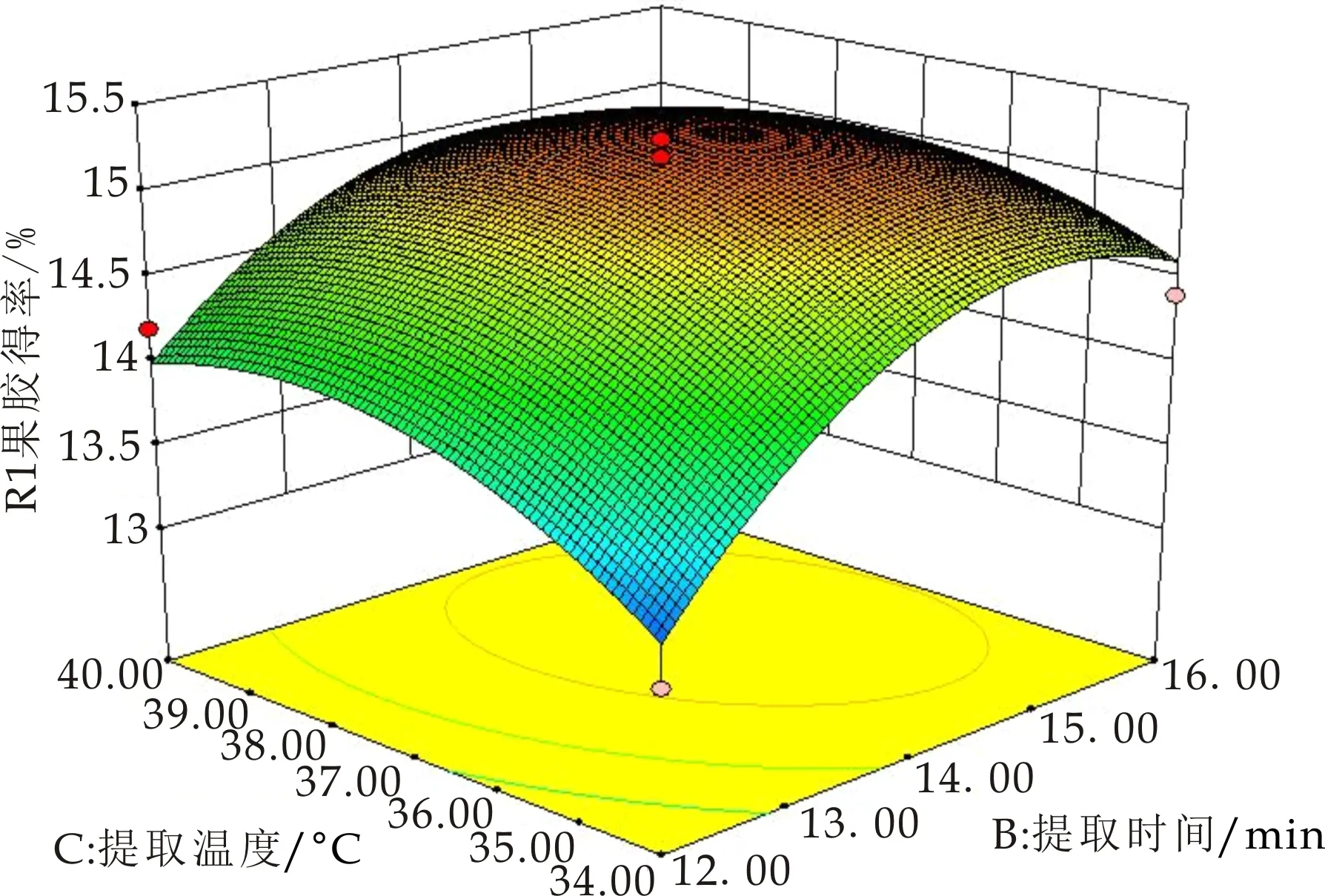
图8 R=(B,C)的响应面图
2.3 验证实验
对优化所得试验方案进行验证,即采用0.500 g海红果渣,控制微波功率为700 W,按照1∶20(g/mL)的料液比,纤维素酶的加入量为0.1 u/g的条件下,用 0.05 mol/L 的盐酸调节pH值5,微波温度38 ℃,微波提取时间为15 min,重复提取三次.进行5次平行试验求平均值.结果海红果渣中果胶得率为15.3±0.2%.与模型预测值之间的误差为-0.23%.
刘慧瑾等[8]2014年发表的《响应面法优化表面活性剂/微波辅助提取海红果渣中果胶的工艺》中最终得率为16.1%,略高于本试验的得率,是由于本文以提取果汁饮料以后的剩余物果渣作为原料,不同于文献中以海红果果实直接切除果肉后的剩余物为原料.且纤维素酶对人体无毒无害,作为食品或者医药品使用果胶,采用纤维素酶提取的更加安全、健康.因此,可以视果胶的用途,采用不同的提取方法,充分发挥各提取方法的优势.
3 结论
(1)海红果渣中含有一定量的果胶,采用响应面法所得到的实验模型可靠,具有一定的实用价值,其优化的提取工艺条件是:按照1∶20(g/mL)的料液比,加入纤维素酶的量为0.1 u/g的条件下,用 0.05 mol/L 的盐酸调节pH值至5.0,控制微波温度38 ℃,微波提取时间为15 min,重复提取三次.海红果渣中果胶得率为15.3±0.2%.
(2)采用纤维素酶-微波辅助工艺提取红果渣中果胶,可以显著提高海红果渣中果胶得率,而且提取时间短,温度低,可降低成本,说明此试验方案有效可行.
[1] 赵学思,刘亚琼,董 洋,等.酸水解法提取雪花梨皮果胶工艺研究[J].河北农业大学学报,2016,39(3):37-41,54.
[2] 高 健,马路山,胡建军,等.果胶提取技术研究进展[J].食品工业科技,2014,35(6):368-372.
[3] 刘丽平,张淑华,及雪敏.果胶的提取及应用研究进展[J].江苏农业科学,2016,44(8):30-34.
[4] 安仕豪,赵芳芳,魏 佳,等.响应面法优化超声辅助离子液体提取籽瓜果胶工艺的研究[J].食品工业科技,2017,38(11):270-275.
[5] M.Kratchanova,E.pvalova,I Panchev.The effect of microwave heating of fresh orange peels on the fruit tissue and quality of extraction pectin[J].Cabohydrate Polymers,2004,56:181-185.
[6] Huo Y R,Gao Q X.Effect of different drying methods on the properties of pectin from premna phyla turcz leaves[J].Medicinal Plant,2010,11:77-79.
[7] 韩宗元,李晓静,吴秀月,等.微波辅助提取桔皮果胶的理化及凝胶特性比较[J].农业工程学报,2016,32(23):309-314.
[8] 刘慧瑾,杜芳艳,高立国,等.响应面法优化表面活性剂/微波辅助提取海红果渣中果胶的工艺[J].食品工业科技,2014,35(21):215-219.
[9] 陈妮娜,曾稍俏.螯合剂协同微波法提取枇杷皮果胶的工艺研究[J].食品研究与开发,2016,37(22):56-58,101.
[10] 程振玉,张跃伟,宋海燕,等.微波辅助提取龙胆果胶的工艺研究[J].食品工业科技,2017,38(1):214-218.
[11] 张星启,宋贤良,陈颖森,等.响应面优化菠萝蜜果皮果胶的酶法提取工艺[J].广东农业科学,2015,42(3):89-93, 98.
[12] 钟方丽,王晓林,薛健飞,等.微波辅助提取刺玫果果胶工艺研究[J].食品工业科技,2015,36(11):239-242,246.
[13] 杨继涛,杨 敏 .响应面法优化籽瓜皮中高纯度果胶的提取工艺[J].中国酿造,2015,34(5):110-114.
[14] 丁建东,张雪红,姚先超,等.咔唑比色法测定剑麻果胶含量[J].食品研究与开发,2010,31(11):138-140.
[15] Kratchanova M,Palllova E,Panchev I.The effect of microwave heating of fresh orange peels on the fruit tissue and quality of extracted pectin[J].Carbobydrate Polymers,2004,56(2):181-185.
[16] 李 胜,黄 兰.纤维素酶促进菠萝皮果胶提取的研究[J].热带生物学报,2011,2(2):164-166.
[17] Shengli Y,Hui Z.Optimization of cholesterol oxidase production by brevibacterium spemp-loying response surface methodology[J].African Journal of Biotechnology,2012,24(1):90-94.
