具有铁氧化功能的硝基苯降解菌的筛选及特性
2018-05-26王亚娥
郑 莹,王亚娥,牟 彪
具有铁氧化功能的硝基苯降解菌的筛选及特性
郑 莹,王亚娥*,牟 彪
(兰州交通大学环境与市政工程学院,甘肃 兰州 730070)
采用硝基苯(NB)模拟废水对生物海绵铁体系进行驯化,筛选出一株具有铁氧化功能的高效硝基苯降解菌Y-9.经鉴定,菌株Y-9为节杆菌属().通过平行对比实验,考察了菌株Y-9适宜的生长条件,研究了菌株Y-9介入下的海绵铁体系对NB的强化降解效果及降解机理.结果表明,菌株Y-9在硝基苯初始含量为200mg/L的条件下生长良好,且适宜的温度为25~40℃,适宜的pH值为6~8.此外,菌株Y-9作用下的海绵铁体系较单纯海绵铁体系及介入普通活性污泥的海绵铁体系对硝基苯的降解率分别提高88.6%和32.2%.生物海绵铁体系中Fe2+、H2O2、×OH含量明显高于海绵铁体系,尤其是铁细菌Y-9作用下的生物海绵铁体系,Fe2+、H2O2、×OH含量最高,为体系发生较强类Fenton效应提供了条件.通过对降解产物的定量分析发现,菌株Y-9降解硝基苯的途径遵循部分还原途径.本研究初步揭示了生物海绵铁体系类Fenton效应机理,为经济有效地处理硝基苯废水提供了新思路.
硝基苯;降解;铁氧化酶;海绵铁
硝基苯(NB)具有较强的生物毒性被列于世界“环境优先控制有毒有机污染物”名单前列[1].作为一种重要的有机原料中间体,被广泛应用于生产染料、炸药、农药、医药等,每年大约有9000t NB通过工业废水等方式进入环境,造成水体、土壤和空气等不同程度的污染[2-3].NB化学性质稳定,苯环容易发生亲电取代,不易发生氧化反应.目前[4-9],众多学者的研究集中在采用高级氧化技术降解NB废水.利用高活性的自由基,虽能在短时间内将有机物完全矿化,但成本较高,易产生二次污染.研究表明,在Fe2+与微生物的混合体系中,铁氧化菌大量繁殖[10].铁氧化菌氧化Fe2+,并释放一种特殊的酶,与过氧化氢酶一样,能够促进H2O2形成[11],形成的H2O2与Fe2+可进一步发生类Fenton反应[12-13],从而促进难降解有机物的降解[14].在Fe0体系中投加具有铁氧化功能的NB降解菌处理NB废水,既能利用微生物的新陈代谢作用降解NB, 又能通过生物腐蚀和电化学腐蚀促进Fe2+的产生,从而使Fe2+与铁氧化菌释放的H2O2发生Fenton反应,进一步强化降解NB.近年来, NB降解菌的研究主要包括藤黄微球菌()、丛毛单胞菌()、胶红酵母()、链霉菌()和臭假单胞菌()等[15],且低温或含盐条件下NB降解菌的研究较多[16-20],而对于具有铁氧化功能的NB降解菌鲜有报道.本研究利用NB对生物海绵铁体系进行驯化,富集分离得到7株具有铁氧化功能的NB降解菌,通过NB降解率及铁氧化酶活性的比较,筛选得到一株具有铁氧化功能的高效NB降解菌,对其生长降解特性及主要影响因素进行了研究.此外,将该高效菌富集培养成菌泥介入海绵铁体系,通过与普通活性污泥海绵铁体系对比,初步揭示了生物海绵铁体系类Fenton效应机理,为生物海绵铁体系高效处理难降解有机物的后续研究奠定了基础.
1 材料与方法
1.1 实验材料
实验所用Fe0为粒径2~3mm的海绵铁,使用前进行预处理,即在1%硫酸中浸泡10min,期间不断搅拌,取出后,用自来水冲洗数次,备用.接种污泥取自兰州市安宁区污水处理厂二沉池.
1.2 培养基
无机盐培养基(g/L):Na2HPO4·12H2O 3.8; KH2PO41.0;NaCl1.0;MgSO4·7H2O0.2;pH值7.0~ 7.2.
Winogradsky铁细菌培养基(g/L):NH4NO30.5; NaNO30.5; MgSO4·7H2O0.5; CaCl20.2; K2HPO40.5;柠檬酸铁铵10;pH值7.2~7.4.
营养培养基(g/L):蛋白胨10;牛肉膏3;NaCl 5;pH值7.4~7.6.
NB培养基:在无机盐培养基中加入200mg/ LNB; pH值7.0~7.2.
固体培养基:在上述培养基中加入15g/L琼脂.
1.3 实验废水
1.2g/LNB储备液:在1L棕色容量瓶中加入1mLNB原液,去离子水定容,封口膜封口,超声至NB溶解.
100mL/L甲醇储备液:10mL甲醇,去离子水定容至100mL.
NB模拟废水:采用人工配水,以无机盐溶液为主体,除驯化所用NB废水外,其余配水以NB为唯一碳源.驯化所用NB废水:逐渐减少甲醇储备液的加量(5,3,2,1,0mL/L)同时逐渐增加NB储备液的加量(16.7,33.3,66.8,133.3,166.7ml/L),配制成不同浓度(20,40,80,160,200mg/L) NB废水.
1.4 实验方法
1.4.1 菌种的富集、驯化 将90g/L海绵铁, 4g/L活性污泥加入有效容积为300mL的锥形瓶中,无机盐培养基中加入20mg/LNB废水,气浴摇床震荡培养(30℃,140r/min),周期为12h,换水比为1/2.培养一定时间至NB降解率达97%以上,提高NB浓度至40mg/L,此后不断重复该过程至NB浓度达200mg/L,降解率为97%以上时,可认为驯化完成.
1.4.2 菌种的分离筛选 将驯化完成的菌液涂布于Winogradsky铁细菌固体培养基上,30℃培养48h,挑取具有代表性的菌落,经多次划线,得到数株铁细菌,再将得到的铁细菌于以NB为唯一碳源的无机盐固体培养基上不断分离纯化,得到7株具有铁氧化功能的NB降解菌.
对分离所得的7株菌进行NB降解能力及铁氧化酶活性测定,从而得到1株具有铁氧化功能的高效NB降解菌.
(1)NB降解能力测定
将筛选所得菌株分别培养成OD600相同的菌液,菌液投加量为10%,进水NB浓度为200mg/L,于有效容积为100mL的锥形瓶中进行NB降解实验,30℃、140r/min培养60h,测定指定时间点各反应器中NB浓度,比较各株菌对NB的降解效果.
(2)铁氧化酶活性测定
将筛选所得菌株分别培养成OD600相同的菌液,取1mL接种到装有9mLWinogradsky铁细菌培养基的试管中,30℃培养5d得到发酵液.取8mL发酵液离心,离心后5mL上清液作为粗酶液测定酶活性.向5mL粗酶液中加入 FeSO4至200mg/L,30℃静置30min后离心,按邻菲罗啉法测定.
氧化率=[1-(OD平均值/OD空白值)]×100% (1)
相对酶活性=(氧化率/氧化率最高值)×100% (2)
式中:OD平均值为3个平行样的平均值;OD空白值为3个未接菌平行样的平均值;本文将测试组中氧化率最高者的相对酶活性定为100%.
1.4.3 高效菌的生长条件试验 通过平行对比实验,将处于对数生长期的菌液接种到NB浓度为200mg/L的无机盐培养基中,140r/min恒温振荡培养60h后,测定NB剩余量及OD600.实验控制单一变量(接种量10%,温度30℃,pH值为7,改变其一),考察不同接种量(1%,5%,10%,15%,20%),不同温度(10、15、20、25、30、35、40℃),不同pH值(4、5、6、7、8、9、10)对高效菌降解特性的影响.接种、离心和取样等操作均在无菌条件下完成.
1.4.4 生物海绵铁体系降解硝基苯试验 将活化好的高效菌,接种至含200mg/LNB的灭菌Winogradsky铁细菌培养基中,30℃,140r/min恒温震荡培养,期间不断补充营养物质,直至铁细菌菌泥形成.
在无机盐培养基中加入浓度为200mg/LNB作为实验废水,调节pH值至6.启动三个有效容积为300mL的反应器进行平行对比实验.1#反应器投加60g/L海绵铁;2#反应器投加4g/LNB驯化完成的普通活性污泥,60g/L海绵铁;3#反应器投加4g/L铁细菌菌泥,60g/L海绵铁.30℃, 140r/min恒温震荡培养,定点取样,取样间隔为1h,水样经0.22μm滤膜过滤后,测定其中NB、H2O2、Fe2+、×OH含量.每个反应器设置两组平行样,取均值.
1.5 分析测定方法
NB浓度:高效液相色谱法.采用1260高效液相色谱仪(美国Agilent公司),样品过0.22μm有机滤膜后,收集到液相小瓶待测.测试条件:色谱柱C18(150mm´4.6mm,4μm),柱温30℃,流动相:甲醇:水(:=70:30),等梯度淋洗,流速1.0mL/min,紫外检测波长为265nm,自动进样,进样量10μL.
×OH:高效液相色谱法.取5mL水样,加入2mL水杨酸(10mmol/L),去离子水定容至25mL,混匀,经0.22μm有机滤膜过滤,收集到液相小瓶后待测.测试条件:色谱柱C18(150mm´4.6mm, 4μm),柱温30℃,流动相:甲醇:水(:=40:60),等梯度淋洗,流速1.0mL/min,紫外检测波长为239nm,自动进样,进样量20μL.
细胞浓度(OD600):比浊法,在采用紫外分光光度计测定菌液在600nm下的光密度值.
铁氧化酶活性参考相关文献[21];H2O2:钛盐光度法[22];Fe2+浓度:邻菲罗啉分光光度法.
2 结果与讨论
2.1 降解菌的分离纯化及降解特性研究
2.1.1 降解菌的分离纯化 经分离纯化后得到具有铁氧化功能的NB降解菌7株,其在含200mg/LNB的营养培养基上培养4d的菌落形态特征如表1所示.

表1 降解菌的菌落特性
2.1.2 降解菌的降解特性及铁氧化酶活性比较 对上述分离得到的7株菌进行NB降解性能比较及铁氧化酶活性比较,结果列于表2.
综合比较各菌株60h对NB降解率、OD600及铁氧化酶活性,选定Y-9为目标菌株.经16S rDNA鉴定,菌株Y-9为节杆菌属(sp.).

表2 菌株的降解特性及铁氧化酶活性比较
2.2 高效菌生长曲线
按10%的接种量将菌株Y-9接种于含200mg/LNB的无机盐培养基中,30℃,140r/min恒温震荡培养,研究菌株Y-9的生长曲线和NB的降解过程.结果见图1.各点NB含量均已扣除NB的挥发量.

图1 菌株Y-9的生长曲线和NB的降解情况
由图1可知,20h内菌株Y-9在适应期,该阶段微生物代谢系统要适应新环境,同时需合成酶、辅酶等,微生物仅表现为个体增大,对NB降解缓慢;20~60h为菌株Y-9的对数生长期,此时菌体以几何数增加,细胞代谢能力最强,大量NB被降解,60hNB降解率为61.4%,此后菌株生长进入稳定期,但由于营养的消耗使营养物比例失调、有害代谢产物积累等理化条件变化,导致NB降解缓慢.
目前,被广泛运用的描述生物群体在限制性条件下生长的数学模型是Monod方程和Logistic方程.Logistic方程以一定环境条件下所能达到的最大种群密度作为限制性因素,更易于操作.采用logistic 4参数拟合算法对菌株Y-9的生长曲线进行拟合,以描述NB为唯一碳源时菌株的生长情况.
Logistic方程:
=2+ (1-2)/(1+(/0)) (3)
式中:为累计反应时间;为某时间点微生物的光密度(OD600)值;1为OD600值的最小估值;2为OD600的最大估值;0为OD600max/2时的时间,亦是菌株增长速率最快的时间点;与0曲线斜率相关.由图1可知,logistic方程对菌株Y-9随时间的生长变化曲线拟合度很高,相关性系数高达0.999,拟合方程为:=0.996-0.965/(1+(/ 40.39)6.24).易知,0=40.39,故取培养40h的Y-9菌液进行实验.
2.3 高效菌生长条件试验
取培养40h,处于对数生长期(OD600=0.52)的Y-9菌液,接种于含有200mg/LNB的无机盐培养基中,考察不同条件下,菌株Y-9对NB的降解效果.
2.3.1 接种量 接种量直接影响培养液中菌体的初始浓度.由图2可知,菌株的生长速度和NB的降解能力随接种量的增大而提高,但当接种量增加到10%以上时对菌株的生长和降解能力影响较小,可能是此时菌种密度过大造成菌株处于贫营养状态,限制了菌株的生长代谢能力.因此,菌株Y-9的最适接种量为10%.
2.3.2 温度 温度是微生物生长繁殖重要的影响因子,它能够影响微生物自身的酶催化反应速度及基质扩散到细胞的速度.由图3可知,菌株Y-9在10~15℃时,生长极其缓慢,对NB的去除率低于25%, 说明低温抑制了铁细菌Y-9的生长.25~40℃时生长良好,特别是30℃时,菌株生长最好,NB去除率在60%以上.Franzmann等[23]研究发现,铁细菌的活性与温度密切相关,且认为绝大部分铁细菌的最适生长温度为30~50℃.由图3可知,温度高达40℃时,菌株Y-9对NB仍能保持较高去除率,对高温环境有一定适应性.

图2 接种量对菌株Y-9生长和降解性能的影响

图3 温度对菌株Y-9生长和NB降解性能的影响

图4 pH值对菌株Y-9生长和NB降解性能的影响
2.3.3 pH值 pH值与微生物的生命活动密切相关,它不仅影响微生物的酶活性,还能影响微生物蛋白质的解离,造成微生物细胞膜表面的电荷变化,从而影响细胞膜结构稳定性,最终对微生物生长速率造成影响.此外,pH值对营养物质的离子化和溶解度也有不同程度的影响.由图4可知,pH值对菌株生长影响很大,过酸或过碱性均不利于菌株Y-9的生长.pH值为6~8时菌株生长良好,NB降解率均在60%以上.
2.4 生物海绵铁体系降解NB试验
由图5可知,12h后,1#反应器内剩余177.3mg/LNB,去除率为11.4%,说明单独的海绵铁体系对NB具有一定的去除作用;2#反应器对NB的降解作用较强,但12h后体系内仍有64.5mg/LNB未被降解,去除率为67.8%;菌株Y-9(铁细菌)作用下的3#反应器能够高效降解NB,12h可将浓度为200mg/L的NB完全降解,去除率远高出1#反应器88.6%,且较2#反应器高出32.2%.
研究表明[12-13],铁细菌在氧化Fe2+的过程中会自主诱导胞外基质中活性氧的产生,形成活性氧(ROS),进一步诱发超氧化物、H2O2、×OH的产生,继而发生类Fenton反应,能够大大提高体系对难降解有机物的处理效果.为进一步探究铁细菌作用下海绵铁体系高效降解NB的机理,测定每组反应器内Fe2+、H2O2、×OH含量,取均值对比.
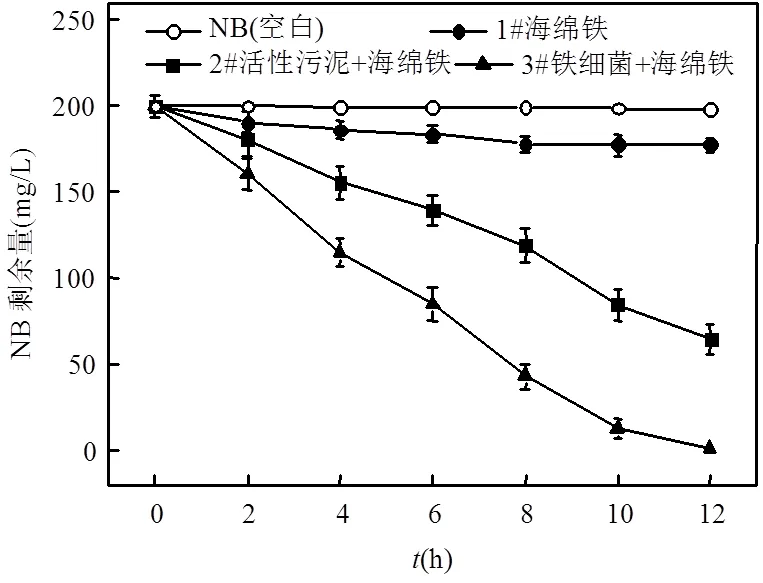
图5 生物海绵铁体系对NB的降解效果
2.5 生物海绵铁体系降解NB机理分析
由图6可知,在初始pH值为6的条件下,1#海绵铁体系与介入普通活性污泥的2#海绵铁体系能够产生少量活性氧化物,而铁细菌存在的3#海绵铁体系中,类Fenton效应较为显著,Fe2+、H2O2、×OH含量分别为8.4mg/L, 16.4mg/L, 0.2mg/L,远高于其他反应器.

图6 生物海绵铁体系类Fenton效应
研究表明[24-25],Fe0/O2体系在酸性条件下能够发生类Fenton效应(图7),在海绵铁体系中可检测出少量Fe2+、H2O2及×OH.但随着Fe2+与H+的消耗,pH值升高,类Fenton反应停止,体系中NB也不再降低.微生物的加入,促进了海绵铁腐蚀,Fe2+浓度升高.尤其是铁细菌的存在,不仅能够诱发超氧化物、H2O2、×OH的产生,且在氧化Fe2+的过程中产生大量的H+[11],促进了类Fenton效应的发生,提高了NB降解效果.

图7 Fe0/O2体系类Fenton效应
Nishino等[26-27]研究发现,微生物对NB的降解存在2种途径,部分还原途径和氧化降解途径.环境中大部分微生物降解NB遵循部分还原途径[28],降解机理如图8所示[26].从图8可知,NB先还原成苯胲,再进一步还原成邻羟基苯胺,开环降解,脱去的氨基全部转化成为NH3.部分还原途径以氨氮的积累为代表[26],而氧化降解途径则脱去NO2-,亚硝酸盐积累[27].

图8 NB部分还原降解途径
为进一步探究生物海绵铁体系对NB的降解途径,在反应初期、中期和末期对3#铁细菌体系NB降解过程中的氮素进行测定.结果表明,铁细菌存在的海绵铁体系在降解NB的过程中,仅存在氨氮的积累.理论上,200mg/L的NB通过部分还原途径被微生物完全降解,可产生27.6mg/L氨氮.该体系12h完全降解200mg/LNB产生了26.94mg/L氨氮,氮素的转化率为97.6%,其他极少部分氮素可能被菌株Y-9直接利用合成自身物质.因此,菌株Y-9降解NB的途径为部分还原途径.
3 结论
3.1 采用模拟NB废水对生物海绵铁体系进行驯化,得到大量具有铁氧化功能的NB降解菌.通过铁氧化酶活性及NB降解效果的比较,筛选出一株具有铁氧化功能的硝基苯高效降解菌Y-9. 经鉴定,菌株Y-9为节杆菌属().该菌株在NB初始含量为200mg/L的条件下生长良好,且适宜的温度为25~40℃,适宜的pH值为6~8.
3.2 铁细菌介入的海绵铁体系对NB具有良好的处理效果,12h可将200mg/L的NB完全降解,较单纯海绵铁体系及活性污泥介入的海绵铁体系分别提高88.6%和32.2%.
3.3 通过对不同体系降解机理的研究发现,生物海绵铁体系中Fe2+、H2O2、×OH含量明显高于海绵铁体系,尤其是介入铁细菌Y-9的生物海绵铁体系,Fe2+、H2O2、×OH含量更高,为体系发生较强类Fenton效应提供了条件.通过对降解产物的定量分析发现,菌株Y-9对NB的降解遵循部分还原途径.
[1] Ye J, Singh A, Ward O P. Biodegradation of nitroaromatics and other nitrogen-containing xenobiotics [J]. World Journal of Microbiology & Biotechnology, 2004,20(2):117-135.
[2] Rodriguez M, Timokhin V, Michl F, et al. The influence of different irradiation sources on the treatment of nitrobenzene [J]. Catalysis Today, 2002,76(2):291-300.
[3] Li Z L, Yang M, Li D, et al. Nitrobenzene biodegradation ability of microbial communities in water and sediments along the Songhua River after a nitrobenzene pollution event [J]. Journal of Environmental Sciences, 2008,20(7):778-786.
[4] Duan H T, Liu Y, Yin X H, et al. Degradation of nitrobenzene by Fenton-like reaction in a H2O2/schwertmannite system [J]. Chemical Engineering Journal, 2016,283:873-879.
[5] Carlos L, Nichela D, Triszcz J M, et al. Nitration of nitrobenzene in Fenton's processes [J]. Chemosphere, 2010,80(3):340-345.
[6] 孙茜茜,李睿华,胡俊松,等.臭氧曝气沸石生物滤池处理硝基苯废水 [J]. 环境工程学报, 2016,10(6):3012-3016.
[7] 余丽胜,焦纬洲,刘有智,等.超声强化铁碳微电解-Fenton法降解硝基苯废水 [J]. 化工学报, 2017,68(1):297-304.
[8] Jiao W Z, Feng Z R, LiuY Z, et al. Degradation of nitrobenzene- containing wastewater by carbon nanotubes immobilized nanoscale zerovalent iron [J]. Journal of Nanoparticle Research, 2016,18(7):1-9.
[9] HuS, WuY, Yao H, et al. Enhanced Fenton-like removal of nitrobenzene via internal microelectrolysis in nano zerovalent iron/activated carbon composite [J].Water Science & Technology, 2016,73(1):153-160.
[10] Ghiorse W C. Biology of iron and manganese depositing bacteria [J]. Annual Review of Microbiology, 1984,38(1):515-50.
[11] 张 艳,王宏武,马鲁铭.铁细菌在水处理方面的应用及影响其生长的因素 [J]. 四川环境, 2006,25(5):61-64.
[12] Voegelin A, Hug S J. Catalyzed oxidation of arsenic (III) by hydrogen peroxide on the surface of ferrihydrite: an in situ ATR-FTIR study [J]. Environmental Science & Technology, 2003, 37(5):972-978.
[13] Wang X M, Waite T D. Iron speciation and iron species transformation in activated sludge membrane bioreactors [J]. Water Research, 2010,44(11):3511-3521.
[14] 冯娟娟,王亚娥,李 杰,等.新型富铁多孔复合填料强化生化处理效能研究[J]. 中国给水排水, 2013,29(3):24-28.
[15] 张迎迎,迟向群,王道胜,等.类产碱假单胞菌JS45的硝基苯降解动力学.环境工程学报 [J]. 2017,11(2):1257-1261.
[16] Wang D, Zheng G, Zhou L. Isolation and characterization of a nitrobenzene-degrading bacteriumNB1from aerobic granular sludge [J]. Bioresource Technology, 2012,110(4):91-96.
[17] Tian L, Deng X, Wang J, et al. Biodegradation of nitrobenzene in a lysogeny broth medium by a novel halophilic bacterium[J]. Marine Pollution Bulletin, 2014, 89(1/2):384-389.
[18] Zheng C L, Zhou J T, Wang J, et al. Isolation and characterization of a nitrobenzene degrading yeast strain from activated sludge [J]. Journal of Hazardous Materials, 2008,160(1):194-199.
[19] Liu N, Li H J, Ding F, et al. Analysis of biodegradation by- products of nitrobenzene and aniline mixture by a cold-tolerant microbial consortium [J]. Journal of Hazardous Materials, 2013, 260(18):323-329.
[20] 马溪平,李鲜珠,李万龙,等.低温高盐条件下活性污泥降解水中硝基苯的研究 [J]. 辽宁大学学报(自然科学版), 2016,43(2): 183-188.
[21] 林跃鑫,佘晨兴,许旭萍,等.氧化铁鞘细菌铁氧化酶最适产酶条件及其酶学特性的研究[J]. 水生生物学报, 2004,28(4):385-390.
[22] 姜成春,庞素艳,马 军,等.钛盐光度法测定Fenton氧化中的过氧化氢[J]. 中国给水排水, 2006,22(4):88-91.
[23] Franzmann P D, Haddad C M, Hawkes R B, et al. Effects of temperature on the rates of iron and sulfur oxidation by selected bioleaching Bacteria and Archaea: Application of the Ratkowsky equation [J]. Minerals Engineering, 2005,18(13):1304-1314.
[24] Keenan C R, Sedlak D L. Factors affecting the yield of oxidants from the reaction of nanoparticulate zero-valent iron and oxygen [J]. Environ. Sci. Technol., 2008,42(4):1262-1267.
[25] Joo S H, Feitz A J, Waite T D. Oxidative degradation of the carbothioate herbicide, molinate,using nanoscale zero-valent iron [J]. Environ. Sci. Technol., 2004,38(7):2242-2247.
[26] Nishino S F, Spain J C. Degradation of Nitrobenzene by a[J]. Applied and Environmental Microbiology, 1993,59(8):2520-2525.
[27] Nishino S F, Spain J C. Oxidative Pathway for the Biodegradation of Nitrobenzene byJS765 [J]. Applied and Environmental Microbiology, 1995,61(6):2308-2313.
[28] Hofstetter T B, Spain J C, Nishino S F, et al. Identifying competing aerobic nitrobenzene biodegradation pathways by compound-specific isotope analysis [J]. Environ. Sci. Technol., 2008,42(13):4764-4770.
Screening and degradation characteristics of nitrobenzene-degrading bacterium with iron oxidation function.
ZHENG Ying, WANG Ya-e*, MU Biao
(School of Environmental and Municipal Engineering, Lanzhou Jiaotong University, Lanzhou 730070, China)., 2018,38(5):1837~1843
An efficient iron bacterium used to degrade nitrobenzene (NB) was isolated from the biological sponge iron system domesticated through NB simulated wastewater. The strain was identified assp. The suitable growing conditions, as well as the degradation effect and mechanism in sponge iron system with strain Y-9, were carried out by the contrast experiments. Results indicated that strain Y-9 grew well when the initial concentration of NB was 200mg/L, and the optimal conditions for the biodegradation of NB by strain Y-9 were at 25~40℃ and pH 6~8. Besides, in contrast with the normal sponge irons system and the sponge irons system involved in ordinary activated sludge, the degradation rate of NB in biological sponge irons system at the present of strain Y-9 increased by 88.6% and 32.2%, respectively. The concentration of Fe2+, H2O2, and ·OH in the biological sponge iron system, especially the system inoculated with strain Y-9, were significantly higher than that of normal sponge iron system, thus, it could promote Fenton-like effect. Quantitative analysis of the degradation products revealed that strain Y-9 followed the partial reductive degradation pathway of NB. The research revealed the mechanism of Fenton-like effect in a biological sponge iron system, and it also provided a new way to treat NB wastewater effectively.
nitrobenzene;degradation;ferroxidase;sponge iron
X172
A
1000-6923(2018)05-1837-07
2017-09-29
国家自然科学基金资助项目(51468030)
, 教授, wye@ mail.lzjtu.cn
郑 莹(1993-),女,江西宜春人,兰州交通大学硕士研究生,研究方向为水污染控制.
