肉桂醛在壳聚糖复合活性包装膜中的释放及在鲜猪肉冷藏中的应用
2018-05-25曾少甫胡长鹰匡衡峰吴宇梅
曾少甫,胡长鹰,,*,匡衡峰,黄 程,吴宇梅
活性包装正逐渐成为食品包装领域中的一个新兴焦点,其利用聚合物材料本身的性能以及将某些食品添加剂纳入包装系统(置于包装内部或纳入包装材料本身),通过所产生的材料扩散行为,释放对食品保鲜具有积极作用的物质,提供阻隔外部并且作用于内部包装环境的条件,从而起到保持产品质量和延长保质期的作用[1]。活性包装除了可以延长食品的保质期外,还具有改善食品感官特性、防止食物营养成分损失等优点[2]。
壳聚糖(chitosan,CS)是甲壳素在碱性介质中的脱乙酰化产物[3],其来源广[4],被公认为无毒、可降解的环境友好型包装材料[5],常以溶液浇铸法制备成膜并应用于食品包装中[6]。已有研究表明,壳聚糖有良好的生物相容性,其与天然活性物质结合而成的复合膜能使食品贮藏期间的品质及保鲜程度得到改进。如Qin Yuyue等[7]开发了一种结合茶多酚的壳聚糖膜用于猪肉的保鲜;Vargas等[8]研究了含有向日葵油的壳聚糖复合膜在猪肉汉堡中的抗氧化作用;张慧芸等[9]研究了丁香精油-壳聚糖复合可食性膜对生肉糜的贮藏影响,都得到良好的应用效果。肉桂醛(cinamaldehyde,CIN)是天然植物肉桂树的次生代谢产物肉桂精油中的一种主要物质,对大部分微生物有抗菌作用,特别是常见的肉类腐败微生物,如大肠杆菌、产气杆菌、肠杆菌属成团泛菌和英诺克李斯特氏菌[10-12]。同时,肉桂醛也属于食品风味添加剂[13-14]。肉桂醛具有高正辛醇/水分配系数,能更好地溶解、扩散和渗透到普通的材料中制备成抗菌膜[15]。肉桂醛也有一定的挥发性[16],将其加入壳聚糖并设计成可控食品贮藏系统有着广泛的应用意义,因此研究其释放行为具有必要性[17-18]。
本课题组之前的研究已证明以壳聚糖为基底掺入天然活性剂肉桂醛制备成复合膜的可行性以及高抗菌性[19],本研究主要利用气相色谱-质谱仪对复合膜中肉桂醛含量进行检测,对于复合膜中活性成分肉桂醛在聚合物基体壳聚糖中的释放影响因素进行分析,分别研究了不同温度、肉桂醛体积分数下肉桂醛向空气和向脂溶性食品模拟液异辛烷中的释放规律,并将其应用于新鲜猪肉的保鲜。
1 材料与方法
1.1 材料与试剂
猪里脊肉由广州市永旺购物中心提供。
壳聚糖(分析纯,脱乙酰度≥90.0%)、肉桂醛(分析纯、色谱纯)、甘油(分析纯) 上海泰坦科技股份有限公司;乙酸(分析纯) 广州化学试剂厂;吐温-80(分析纯) 天津化学试剂厂;甲醇(色谱纯)、异辛烷(色谱纯) 德国Merker公司;平板计数琼脂 青岛海博生物技术有限公司;聚乙烯保鲜膜(30 cm×20 m) 广州家亮化工有限公司。
1.2 仪器与设备
成膜器(15 cm×25 cm有机玻璃板)由广东省普通高校产品包装与物流重点实验室自制;7890A-5975C气相色谱-质谱仪 美国安捷伦科技有限公司;TG 209 F3热重(thermogravimetric,TG)分析仪 德国NETZSCH公司;SPX-100B-Z恒温培养箱 上海博迅医疗生物仪器股份有限公司;PHS-25型pH计 上海仪电科学仪器股份有限公司;STD-XG001型半微量凯氏定氮快速检测仪厦门斯坦道科学仪器股份有限公司;DHG-9140A电热鼓风干燥箱 上海培因实验仪器有限公司;BCD-196TXZ型冰箱 青岛海尔股份有限公司。
1.3 方法
1.3.1 壳聚糖-肉桂醛复合膜的制备
称取一定量的壳聚糖溶于乙酸中配制成体积分数1.5%的溶液,在25 ℃下磁力搅拌4 h至壳聚糖完全溶解。将体积分数3%甘油作为增塑剂加入壳聚糖溶液中,搅拌混合30 min,加入体积分数0.5%吐温-80作为乳化剂协助肉桂醛分散溶解,搅拌混合30 min。分别加入体积分数为0.5%、1.0%、1.5%和2.0%的肉桂醛于壳聚糖膜液中,搅拌混合30 min后形成肉桂醛/壳聚糖溶液,经过真空泵1 h去除气泡。利用流延法将成膜溶液(100 mL)于平板玻璃板上在鼓风干燥箱中干燥成膜(40 ℃、24 h),成膜保存于25 ℃、相对湿度53%的干燥器中48 h,平衡后检测。
1.3.2 TG分析
通过TG 209 F3热重分析仪对膜热稳定性进行分析。称取膜4.0~5.0 mg,样品事先在50 ℃下除湿干燥48 h,以氮气作为载气,实验温度30~600 ℃,升温速率为10 ℃/min,记录TG曲线、微分热重(derivative thermogravimetry,DTG)曲线。
1.3.3 复合膜中肉桂醛初始含量的测定
通过分析预实验的结果,采用甲醇作为膜中肉桂醛的提取溶剂。准确称取不同肉桂醛体积分数(分别为0.5%、1.0%、1.5%和2.0%)的复合膜0.050 0 g,放入10 mL的试管中,加入5.0 mL甲醇,塞紧试管,用封口胶密封,放置于超声波清洗机中萃取30 min,一定倍数稀释,萃取液经0.45 μm有机滤膜过滤,进行气相色谱-质谱检测,每组平行检测5 次。初始含量按式(1)计算。

式中:C0为肉桂醛在复合膜中的初始含量/(mg/kg);ρf为检测所得肉桂醛质量浓度/(mg/L);V为提取肉桂醛时的定容体积/L;F为提取时所稀释的倍数;m为复合膜的质量/kg。
色谱条件:色谱柱为Agilent 19091S-433HP-5MS(30 m×0.25 mm,0.25 μm);升温程序为起始温度40 ℃,保持2 min,以20 ℃/min的速率升温至130 ℃,再以30 ℃/min的速率升温至300 ℃,保持2 min;进样方式为分流进样,分流比20∶1,进样量为1 μL;进样口温度为280 ℃;载气为氦气(纯度≥99.999%),流速为1.1 mL/min;溶剂延迟为3 min。
质谱条件:离子源温度230 ℃;四极杆温度150 ℃;电离方式为电子轰击离子化;电子能量为70 V;全扫描质荷比范围为m/z 50~550;采用选择离子扫描模式进行定量,定量离子质荷比为m/z 131、m/z 103和m/z 77。
1.3.4 复合膜中肉桂醛的释放性
1.3.4.1 复合膜中肉桂醛向异辛烷中的释放
根据欧盟委员会指令EC 10/2011[20],选择向脂肪食品模拟物异辛烷进行迁移,采用100 mL的透明带盖玻璃瓶为迁移容器,按照100 mL食品模拟物对应60 cm2食品包装材料进行迁移实验。
将剪成5 cm×6 cm的复合膜样品片浸没在盛有50 mL异辛烷的玻璃瓶中,用封口钳将盖封紧,放入恒温水浴锅中,选取4、25、40 ℃作为迁移温度,分别以0.5%、1.0%、1.5%、2.0%肉桂醛的复合膜作为不同膜样体积分数,选择1、2、4、8、16、32、64、120、240 h为时间点进行取样,以研究不同温度、不同肉桂醛体积分数对迁移规律的影响。到达取样时间时,将透明玻璃瓶从恒温水浴锅中取出,用微量加样枪移取0.5 mL异辛烷,迅速将棕色玻璃瓶盖紧并放回恒温水浴锅中,用一定比例的异辛烷稀释,经0.22 μm有机滤膜过滤,上机测试。每个时间点重复3 次。
释放率是异辛烷中测得的肉桂醛的质量浓度与复合膜中肉桂醛的初始含量的比值,释放率公式如式(2)所示。

式中:ρ为某时间肉桂醛在异辛烷中的质量浓度/(mg/L);V为对应肉桂醛质量浓度的异辛烷体积/L;k为检测时所稀释的倍数;C0为肉桂醛在壳聚糖膜中的初始含量/(mg/kg);m代表壳聚糖膜的质量/kg。
1.3.4.2 复合膜中肉桂醛向空气中的释放
将刚制备好的复合膜分别剪成1 cm×5 cm的复合膜样品片,精确称量初始质量(精确到0.000 1 g)以及厚度(精确到0.01 mm),放入20 mL顶空瓶中,用封口钳将盖封紧,放置于4 ℃冰箱中(恒温波动度为±0.5 ℃)和25、40 ℃(恒温波动度为±2 ℃)恒温烘箱中,以此作为复合膜中肉桂醛释放温度。预实验表明肉桂醛向空气中释放较慢,所以选择1、2、3、4、5、6、7、12 d为时间点进行取样。在40 ℃、肉桂醛体积分数2.0%的条件下,肉桂醛的释放规律较明显,故本实验探究40 ℃条件下4 种不同肉桂醛体积分数(0.5%、1.0%、1.5%、2.0%)对肉桂醛释放的影响以及肉桂醛体积分数2.0%复合膜在4、25、40 ℃条件下的释放规律。到达取样时间时,将透明玻璃瓶从烘箱中取出,打开封口,顶空瓶一次一用,将复合膜用有机溶剂提取,经0.22 μm有机滤膜过滤,上机测试,经过与之前所测的初始质量相对比,得出差值即为肉桂醛在密闭顶空瓶空气中所释放的质量。每个时间点重复3 次。
复合膜中肉桂醛在空气中的释放率公式如式(3)。

式中:mF,0为复合膜中肉桂醛的初始质量/mg;mF,t为t时刻复合膜中肉桂醛的质量/mg。
1.3.5 复合膜在猪肉包装上的应用
活性包装材料中活性成分的释放行为和规律对内装食品的保鲜有重要作用。肉桂醛作为一种具有一定挥发性的活性成分,会同时向包装外环境和内环境(包括向食品)迁移释放,通过包装设计,可以更好地利用其释放规律延长食品保质期。本研究将其初步应用于生鲜肉的保鲜。
实验用猪肉为从市场购得的里脊肉,保证距离屠宰时间不大于6 h。猪肉为去除可见结缔组织以及皮下肌内脂肪的瘦肉,当天用。选取外观均匀、较好的猪肉,分割成约10 g的小块(厚度大约1 cm),用制备的膜包裹,分为3 组:空白组(肉样无复合膜包裹)、CS组(纯壳聚糖膜包裹)以及2.0% CIN-CS组(壳聚糖-肉桂醛复合膜包裹,V/V),所有肉样外部用聚乙烯保鲜膜包裹后放置于密封袋中以隔绝外界环境的影响,置于4 ℃冰箱中冷藏。在第0、1、2、3、4、5、6、7、8天(第0天指购买当天)分别测定肉的pH值、挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量、细菌总数,并进行感官评定。
1.3.5.1 TVB-N含量检测
按GB/T 5009.44—2003《肉与肉制品卫生标准的分析方法》[21]检测TVB-N含量,实验重复3 次。根据GB 9959.1—2001《鲜、冻片猪肉》[22],评定标准如下:新鲜肉为TVB-N含量不超过15 mg/100 g,次新肉为TVB-N含量不超过20 mg/100 g,变质肉为TVB-N含量大于20 mg/100 g。
1.3.5.2 pH值的测定
按照GB/T 9695.5—2008《肉与肉制品pH测定》[23]进行,取待测鲜猪肉样品10.0 g,绞碎,置于烧杯中,加蒸馏水至100 mL,用均质机均质10 min,静置,用数显式酸度计测液体的pH值,实验重复3 次。评价标准:新鲜肉pH值为5.8~6.2,次鲜肉pH值为6.3~6.6,变质肉pH>6.7。
1.3.5.3 细菌总数的分析
按照GB 4789.2—2010《食品微生物学检验 菌落总数测定》[24]进行测定,所有微生物计数都表示为lg(CFU/g),实验重复3 次,评定标准如下:新鲜肉细菌总数小于4 (lg(CFU/g)),次新鲜肉细菌总数为4~6 (lg(CFU/g)),变质肉细菌总数大于6 (lg(CFU/g))。
1.3.5.4 感官评价
根据Siripatrawan等[25]的方法适当修改,感官评定小组由10 名评价人员组成,通过感官评定观察肉的色泽、气味、黏液和整体的接受程度。感官评价设4 个指标、10 个水平:颜色(10为无变色;7为轻微变色;0为极不可接受);气味(10为非常可取;7为轻微的异味;0为极不可接受);黏液形成(10为无黏液形成;7为轻微的黏液形成;0为非常不可接受);整体的接受程度(10为非常可接受;7为轻微不可接受;0为极不可接受)。评分得分低于4定义为不可接受。所得评分去掉差异最大的数值,取几何平均值,结果以雷达图形式给出。
1.4 数据处理
实验数据采用软件SPSS 19.0进行方差分析,采用Duncan多重比较检验法进行显著性分析,以P<0.05表示差异显著。采用软件Origin Pro 8.0作图。
2 结果与分析
2.1 热重分析
由图1可知,随温度的升高,添加了肉桂醛的复合膜在不同热降解阶段的质量损失都要少于纯壳聚糖膜,并且随肉桂醛体积分数的增加质量损失减少,说明肉桂醛的添加提高了各个组分物质的热降解温度,从而增强了复合膜的热稳定性。
从图1可以看到,随温度升高,复合膜与纯壳聚糖膜的热降解经历阶段有所差异,且质量变化率也有所不同。第一阶段,发生在35~100 ℃,归因于膜中基团水分子的蒸发以及甘油和低分子质量的蒸发化合物。第二阶段为壳聚糖聚合物降解分解过程[26-27],此阶段分解最剧烈,发生在150~250 ℃,这期间样品膜发生显著的质量损失。据相关文献所述,壳聚糖的疏水基团与肉桂醛的烷基链和苯环相互作用,并且随肉桂醛体积分数和温度的增加,降解壳聚糖乙酰基所需要的温度提高,增强了热稳定性[28]。第三阶段为甘油的热分解过程,大约在270~300 ℃间。第四阶段(370~420 ℃)主要是肉桂醛的分解[29],由于肉桂醛是有苯环的高度稳定芳香结构,导致其分解要在较高的温度下进行。
2.2 肉桂醛的初始含量分析
经检测,0.5%、1.0%、1.5%和2.0%的肉桂醛-壳聚糖膜中肉桂醛的初始含量分别为(2.39±0.13)、(3.86±0.20)、(7.59±0.80)mg/kg和(18.93±1.78)mg/kg,不同肉桂醛体积分数实验组间差异显著。
2.3 温度对复合膜中肉桂醛向空气释放行为的影响
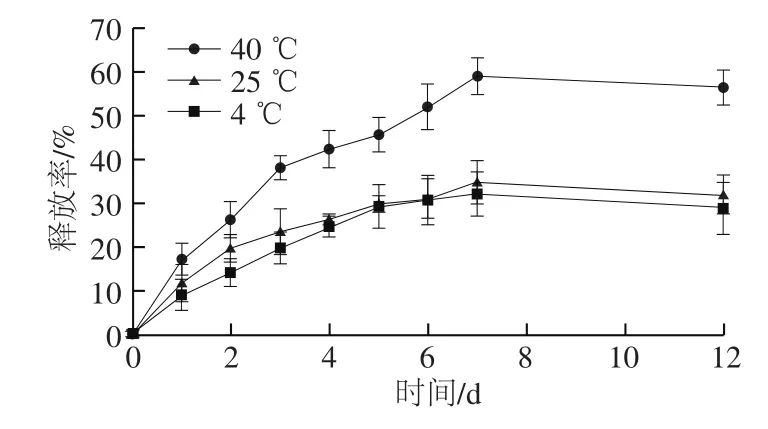
图2 温度对2.0%CIN-CS复合膜中肉桂醛向空气释放行为的影响Fig. 2 Effect of temperature on release behavior of cinnamaldehyde from 2.0% CIN-CS antimicrobial films to headspace
如图2所示,温度对肉桂醛释放速度有着重要的影响。随着温度的升高,肉桂醛的释放量迅速增加,释放率增大。一方面,温度升高使得壳聚糖分子热运动加快,分子链构象变化加快,聚合物内聚能下降,进而导致壳聚糖分子链间的空隙距离变大,因此温度上升使其迁移速率加快;另一方面,由于肉桂醛具有高正辛醇/水分配系数,使它们有一定的扩散渗透能力,温度上升,肉桂醛的活动能力增强,也使得释放速度加快。释放在第8天趋于平衡,40 ℃时的释放率显著大于25 ℃和4 ℃(P<0.05),其中40 ℃环境下释放率最高达59.22%,相比之下,25 ℃和4 ℃环境下释放率只能达到28.95%~32.09%。
2.4 肉桂醛体积分数对复合膜中肉桂醛向空气释放行为的影响
不同肉桂醛体积分数复合膜中肉桂醛在40 ℃密闭环境下释放行为如图3所示。肉桂醛释放率随着膜中肉桂醛体积分数的升高而降低,0.5%、1.0%、1.5%的复合膜的释放率大约平衡在84.45%~89.46%之间,而体积分数为2.0%的复合膜释放率明显小,在56.66%~59.22%之间。根据本课题组对复合膜X射线衍射已有的结论[19]及文献[30]报道可知,肉桂醛浓度提高,膜表面结晶性加大,肉桂醛结晶程度也随之增加,肉桂醛的晶体状态对其释放造成一定程度上的影响,所以高肉桂醛体积分数复合膜中肉桂醛的释放率减小。

图3 肉桂醛体积分数对复合膜中肉桂醛向空气释放行为的影响(40 ℃)Fig. 3 Effect of cinnamaldehyde concentration on release behavior of cinnamaldehyde from antimicrobial films to headspace at 40 ℃
2.5 复合膜中肉桂醛向异辛烷中释放行为的分析

图4 复合膜中肉桂醛向异辛烷中的释放行为Fig. 4 Release behavior of cinnamaldehyde from antimicrobial films to isooctane
结合图4可知,随温度的升高,复合膜中肉桂醛的释放率各有不同程度的增加。随着温度的升高,肉桂醛更加容易释放,根据自由体积理论[31],温度越高,原子热活化能量越大,越容易发生扩散行为。在各温度下,不同肉桂醛体积分数的复合膜中肉桂醛的释放率大小顺序为:0.5%复合膜>1.0%复合膜>1.5%复合膜>2.0%复合膜,可能是高体积分数复合膜中肉桂醛分子的结晶程度高,对其释放造成了一定程度上的影响[32]。各体积分数复合膜释放率最大达81.76%,最终均不能达到100%,可能是由于异辛烷对肉桂醛溶解度有影响;另一方面,也与肉桂醛在膜与溶液中的含量差有关。当两相含量接近时,肉桂醛的渗透性减小,释放率趋于平衡。同时,在0~32 h内,即释放初始阶段,不同温度下各体积分数膜的释放率变化都最大,这主要与溶液两相间物质的含量差有关。除此之外,温度越高,释放速率越大,达到平衡所需时间越短。
2.6 TVB-N含量分析
肉类主要成分为蛋白质、脂肪和碳水化合物,其容易在细菌的作用下被分解并逐渐产生一些有毒的物质,在猪肉贮藏过程中,这些物质和其他碱性氮化物一起组成TVB-N,TVB-N是一个评估猪肉新鲜程度的重要指标[33]。如图5所示,空白组的TVB-N含量迅速上升,到第5天变质。而与空白组相比,壳聚糖对肉中微生物生长起到了一定的抑制作用,而肉桂醛能更好地抑制腐败菌,抑制微生物分泌的蛋白酶和一些组织蛋白酶,从而减少了TVB-N的产生。从TVB-N含量看,相比于空白组,CS组和2.0% CIN-CS组保鲜时间分别延长了1 d和3 d。
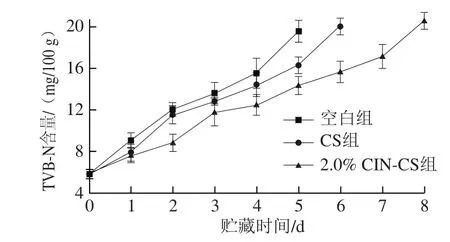
图5 鲜猪肉在4 ℃贮藏环境下TVB-N含量的变化Fig. 5 Change of TVB-N in fresh pork at 4 ℃
2.7 pH值分析
贮藏过程中空白组pH值均高于CS组和2.0% CIN-CS组(P<0.05)。猪肉屠宰后,组织的呼吸由有氧呼吸变为无氧呼吸。无氧呼吸过程中肌糖原无氧糖酵解产生乳酸,三磷酸腺苷分解产生磷酸,两酸共同作用下,导致pH值在刚开始会有一个下降的过程。而后,随时间的延长,由于猪肉中微生物蛋白酶和猪肉蛋白酶的分泌,冷鲜肉蛋白质分解为氨基酸和肽,氨基酸和肽进一步分解为氨和胺从而导致pH值逐渐增加[34-35]。空白组pH值上升较快,第5天时pH值已达到6.68,接近变质。CS组和2.0% CIN-CS组对猪肉腐败有一定的控制作用,猪肉的pH值分别在第6天和第8天达到变质。
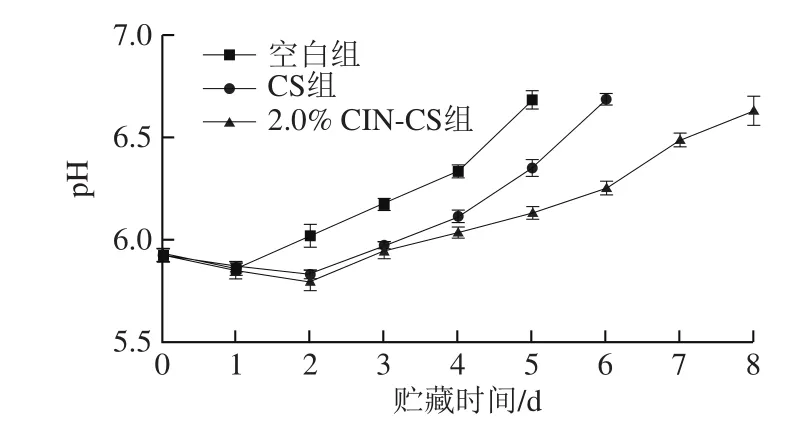
图6 鲜猪肉在4 ℃贮藏环境下pH值的变化Fig. 6 Change in pH of fresh pork at 4 ℃
2.8 细菌总数分析

图7 鲜猪肉在4 ℃贮藏环境下细菌总数的变化Fig. 7 Changes in total bacterial counts of fresh pork at 4 ℃
由图7可知,空白组的猪肉在第3天细菌总数超过4 (lg(CFU/g)),属于次鲜肉,第5天的细菌总数超过6 (lg(CFU/g)),已腐败变质。CS组中细菌的生长有一定程度的抑制,在第6天时细菌总数接近变质。2.0% CIN-CS组在第4天时仍处于新鲜肉范围内,第5~7天属次新鲜肉。
2.9 感官评价
猪肉在贮藏时期颜色的变化主要是微生物生长和脂质氧化所致。各组颜色评分随贮藏时间延长而下降(图8a),空白组颜色得分均显著低于CS组和2% CIN-CS组(P<0.05),在第6天达到不能接受的分数(感官评分为3.5)。对于2.0% CIN-CS组的猪肉,颜色评分在整个贮藏期内均可以接受,说明肉桂醛对于抑制微生物生长和脂质氧化有一定作用。
肉具有微生物生长的营养条件,容易滋生微生物,并且易被氧化,微生物的生长和脂肪氧化是造成肉腐败酸臭味的主要原因[36]。各组的气味评分随贮藏时间的延长而减小(图8b),空白组的气味评分在第4天接近不可接受范围,在第8天,除了2.0% CIN-CS组外,其他两组都在不可接受范围,说明肉桂醛具有一定的抗菌以及抗氧化作用,抑制猪肉腐败酸臭味作用明显。
黏液的产生主要是因为酵母菌和霉菌的繁殖所致[37],肉在贮存过程中如果发生腐败则表面会变黏,黏液产生量越多,变质越严重。如图8c,空白组黏液形成多于其他两组(P<0.05),到第6天处于不可接受范围。其他两组的黏度在整个贮藏期都保持良好,这与真菌对肉桂醛的高敏感性有关。另外,壳聚糖膜有一定的吸附水分作用,使得猪肉的水分含量减少,黏度下降,有利于减少细菌的繁殖。
整体感官接受程度如图8d所示,空白组的感官评价最低,而包裹复合膜的猪肉的感官品质整个贮藏期都可以被接受,复合膜对提高猪肉抗菌性以及抗氧化活性有一定作用,具有维持猪肉感官质量和延长保质期的作用。
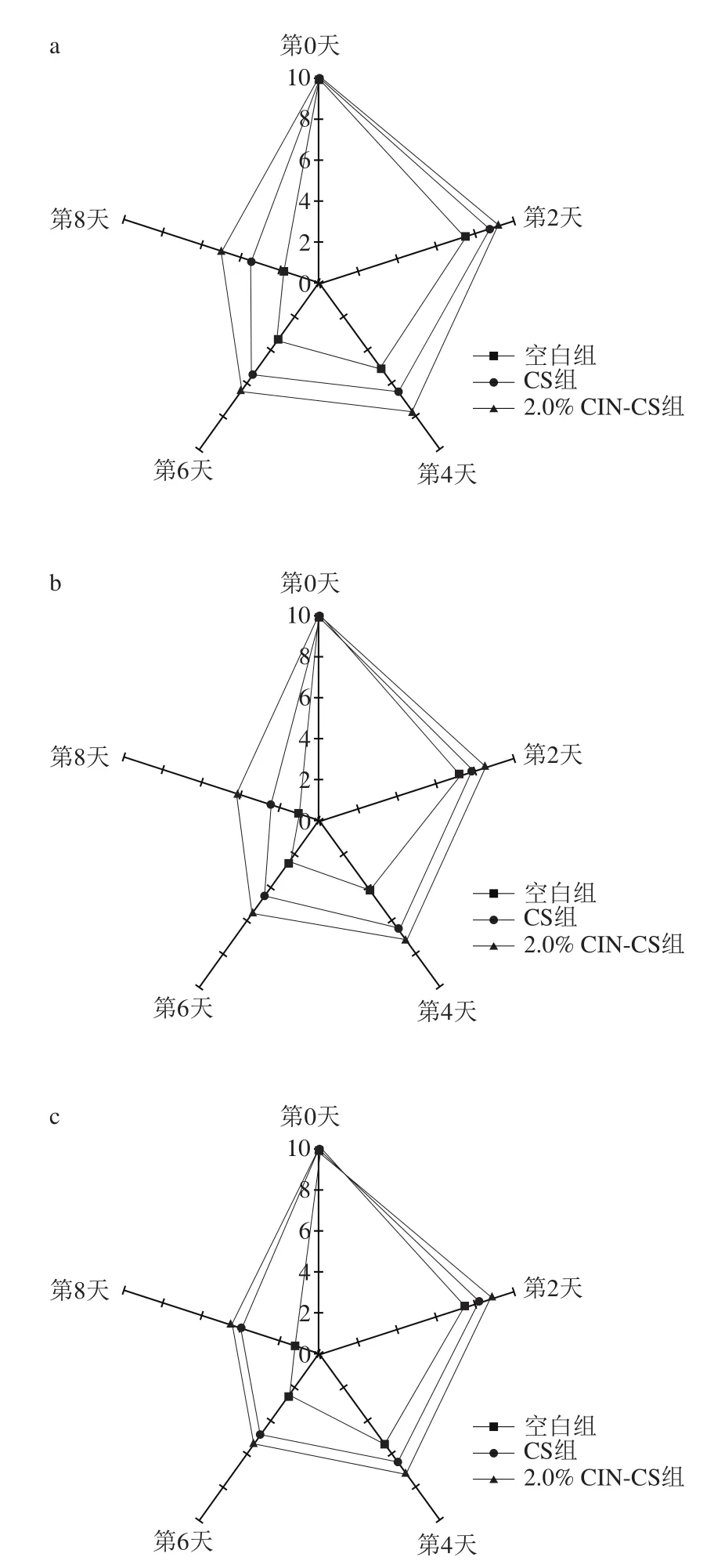

图8 4 ℃贮藏环境下鲜猪肉的感官评价Fig. 8 Sensory evaluation of fresh pork at 4 ℃
3 结 论
本研究制备了一种具备一定力学性能以及抑菌性的可降解活性复合膜。分别探讨了该复合膜的热稳定性、在顶空密闭环境和异辛烷中活性成分肉桂醛的释放规律,初步研究了4 ℃冷藏条件下其包装生鲜猪肉的保鲜效果。得出以下结论:肉桂醛体积分数的增加促进了复合膜热稳定性的提升;肉桂醛的释放率受肉桂醛体积分数和温度影响,肉桂醛体积分数越高,其在复合膜中向空气和异辛烷的释放率越小,温度上升会提高复合膜中肉桂醛的释放率;对冷藏鲜猪肉的活性包装实验表明,肉桂醛体积分数为2.0%的复合膜在抑制微生物生长和蛋白腐败方面取得了良好的效果,肉样的贮藏时间可达7 d。
综上所述,肉桂醛-壳聚糖复合膜的释放性对猪肉保鲜具有良好的效果,可进行后续关于活性物质的释放对食品保鲜的研究,并进一步开发和优化活性包装体系。
参考文献:
[1] LÓPEZ-DE-DICASTILLO C, GALLUR M, CATALÁ R, et al.Immobilization of β-cyclodextrin in ethylene-vinyl alcohol copolymer for active food packaging applications[J]. Journal of Membrane Science, 2010, 353(1/2): 184-191. DOI:10.1016/j.memsci.2010.02.049.
[2] VERMEIREN L, DEVLIEGHERE F, VAN BEEST M, et al.Developments in the active packaging of foods[J]. Trends in Food Science & Technology, 1999, 10(3): 77-86. DOI:10.1016/S0924-2244(99)00032-1.
[3] ABDOU E S, NAGY K S A, ELSABEE M Z. Extraction and characterization of chitin and chitosan from local sources[J].Bioresource Technology, 2008, 99(5): 1359-1367. DOI:10.1016/j.biortech.2007.01.051.
[4] AGULLÓ E, RODRÍGUEZ M S, RAMOS V, et al. Present and future role of chitin and chitosan in food[J]. Macromolecular Bioscience,2003, 3(10): 521-530. DOI:10.1002/mabi.200300010.
[5] CANER C, CANSIZ O. Effectiveness of chitosan-based coating in improving shelf-life of eggs[J]. Journal of the Science of Food and Agriculture, 2007, 87(2): 227-232. DOI:10.1002/jsfa.2698.
[6] TRIPATHI S, MEHROTRA G K, DUTTA P K. Physicochemical and bioactivity of cross-linked chitosan-PVA film for food packaging applications[J]. International Journal of Biological Macromolecules,2009, 45(4): 372-376. DOI:10.1016/j.ijbiomac.2009.07.006.
[7] QIN Yuyue, YANG Jiyi, LU Hongbo, et al. Effect of chitosan film incorporated with tea polyphenol on quality and shelf life of pork meat patties[J]. International Journal of Biological Macromolecules, 2013,61(10): 312-316. DOI:10.1016/j.ijbiomac.2013.07.018.
[8] VARGAS M, ALBORS A, CHIRALT A. Application of chitosansunflower oil edible films to pork meat hamburgers[J]. Procedia Food Science, 2011, 1(1): 39-43. DOI:10.1016/j.profoo.2011.09.007.
[9] 张慧芸, 郭新宇. 丁香精油-壳聚糖复合可食性膜对生肉糜保鲜效果的影响[J]. 食品科学, 2014, 35(18): 196-200. DOI:10.7506/spkx1002-6630-201418038.
[10] UNLU M, ERGENE E, UNLU G V, et al. Composition, antimicrobial activity and in vitro cytotoxicity of essential oil from Cinnamomum zeylanicum Blume (Lauraceae)[J]. Food and Chemical Toxicology,2010, 48(11): 3274-3280. DOI:10.1016/j.fct.2010.09.001.
[11] NAVEENA B M, MUTHUKUMAR M, SEN A R, et al. Use of cinnamaldehyde as a potential antioxidant in ground spent hen meat[J].Journal of Food Processing and Preservation, 2014, 38(4): 1911-1907.DOI:10.1111/jfpp.12163.
[12] DUSSAULT D, VU K D, LACROIX M. In vitro evaluation of antimicrobial activities of various commercial essential oils, oleoresin and pure compounds against food pathogens and application in ham[J]. Meat Science, 2014, 96(1): 514-520. DOI:10.1016/j.meatsci.2013.08.015.
[13] BURT S. Essential oils: their antibacterial properties and potential applications in foods: a review[J]. International Journal of Food Microbiology, 2004, 94(3): 223-253. DOI:10.1016/j.ijfoodmicro.2004.03.022.
[14] TUNC S, CHOLLET E, CHALIER P, et al. Combined effect of volatile antimicrobial agents on the growth of Penicillium notatum[J].International Journal of Food Microbiology, 2007, 113(3): 263-270.DOI:10.1016/j.ijfoodmicro.2006.07.004.
[15] LICCIARDELLO F, MURATORE G, MERCEA P, et al.Diffusional behaviour of essential oil components in active packaging polypropylene films by multiple headspace solid phase microextraction-gas chromatography[J]. Packaging Technology and Science, 2013, 26(3): 173-185. DOI:10.1002/pts.1969.
[16] SÁNCHEZ-GONZÁLEZ L, VARGAS M, GONZÁLEZ-MARTÍNEZ C, et al. Use of essential oils in bioactive edible coatings[J]. Food Engineering Reviews, 2011, 3(1): 11-16. DOI:10.1007/s12393-010-9031-3.
[17] BECERRIL R, GÓMEZ-LUS R, GOÑI P, et al. Combination of analytical and microbiological techniques to study the antimicrobial activity of a new active food packaging containing cinnamon or oregano against E. coli and S. aureus[J]. Analytical and Bioanalytical Chemistry, 2007, 388(5/6): 1003-1011. DOI:10.1007/s00216-007-1332-x.
[18] HOSSEINI M H, RAZAVI S H, MOUSAVI M A. Antimicrobial,physical and mechanical properties of chitosan-based films incorporated with thyme, clove and cinnamon essential oils[J].Journal of Food Processing & Preservation, 2009, 33(6): 727-743.DOI:10.1111/j.1745-4549.2008.00307.x.
[19] 曾少甫, 胡长鹰, 刘婧. 壳聚糖-肉桂醛复合抗菌降解膜的制备及性能[J]. 食品科学, 2016, 37(10): 6-11. DOI:10.7506/spkx1002-6630-201610002.
[20] The European Commission. Commission Regulation (EU) No 10/2011 of 14 January 2011 on plastic materials and articles intended to come into contact with food: EU 10/2011[S]. Office Journal of European Commission, 2011: 41-43.
[21] 卫生部. 肉与肉制品卫生标准的分析方法: GB/T 5009.44—2003[S].北京: 中国标准出版社, 2003: 1-8.
[22] 卫生部. 鲜、冻片猪肉: GB 9959.1—2001[S]. 北京: 中国标准出版社, 2001: 1-8.
[23] 卫生部. 肉与肉制品pH测定: GB/T 9695.5—2008[S]. 北京: 中国标准出版社, 2008: 1-12.
[24] 卫生部. 食品微生物学检验 菌落总数测定: GB 4789.2—2010[S].北京: 中国标准出版社, 2010: 1-12.
[25] SIRIPATRAWAN U, NOIPHA S. Active film from chitosan incorporating green tea extract for shelf life extension of pork sausages[J]. Food Hydrocolloids, 2012, 27(1): 102-108. DOI:10.1016/j.foodhyd.2011.08.011.
[26] PELISSARI F M, GROSSMANN M V E, YAMASHITA F, et al.Antimicrobial, mechanical, and barrier properties of cassava starchchitosan films incorporated with oregano essential oil[J]. Journal of Agricultural & Food Chemistry, 2009, 57(16): 7499-7504.DOI:10.1021/jf9002363.
[27] PAULA H C B, SOMBRA F M, CAVALCANTE R D, et al.Preparation and characterization of chitosan/cashew gum beads loaded with Lippia sidoides essential oil[J]. Materials Science & Engineering:C, 2011, 31(2): 173-178. DOI:10.1016/j.msec.2010.08.013.
[28] DOS SANTOS A L, CHIERICE G O, RIGA A T, et al. Thermal behavior and structural properites of plant-derived eugenyl acetate[J].Journal of Thermal Analysis and Calorimetry, 2009, 97(1): 329-332.DOI:10.1007/s10973-008-9753-0.
[29] BALAGUER M P, GÓMEZ-ESTACA J, GAVARA R, et al.Functional properties of bioplastics made from wheat gliadins modified with cinnamaldehyde[J]. Journal of Agricultural & Food Chemistry, 2011, 59(12): 6689-6695. DOI:10.1021/jf200477a.
[30] UZ M, ALTINKAYA S A. Development of mono and multilayer antimicrobial food packaging materials for controlled release of potassium sorbate[J]. LWT-Food Science and Technology, 2011,44(10): 2302-2309. DOI:10.1016/j.lwt.2011.05.003.
[31] VRENTAS J S, VRENTAS C M. Evaluation of the free-volume theory of diffusion[J]. Journal of Polymer Science Part B Polymer Physics,2003, 41(5): 501-507. DOI:10.1002/Polb.10397.
[32] GRANDA-RESTREPO D M, SOTO-VALDEZ H, PERALTA E, et al.Migration of α-tocopherol from an active multilayer film into whole milk powder[J]. Food Research International, 2009, 42(10): 1396-1402. DOI:10.1016/j.foodres.2009.07.007.
[33] BOYD W. Making meat-science, technology, and American poultry production[J]. Technology and Culture, 2001, 42(4): 631-664.DOI:10.1353/tech.2001.0150.
[34] ANDREWS B S, HUTCHISON S, UNRUH J A, et al. Influence of pH at 24 h postmortem on quality characteristics of pork loins aged 45 days postmortem[J]. Journal of Muscle Foods, 2007, 18(4): 401-419.DOI:10.1111/j.1745-4573.2007.00095.x.
[35] BIDNER B S, ELLIS M, BREWER M S, et al. Effect of ultimate pH on the quality characteristics of pork[J]. Journal of Muscle Foods,2004, 15(2): 139-154. DOI:10.1111/j.1745-4573.2004.tb00717.x.
[36] SAMELIS J, KAKOURI A, REMENTZIS J. Selective effect of the product type and the packaging conditions on the species of lactic acid bacteria dominating the spoilage microbial association of cooked meats at 4 ℃[J]. Food Food Microbiology, 2000, 17(3): 329-340.DOI:10.1006/fmic.1999.0316.
[37] AMBROSIADIS J, SOULTOS N, ABRAHIM A, et al.Physicochemical, microbiological and sensory attributes for the characterization of Greek traditional sausages[J]. Meat Science, 2004,66(2): 279-287. DOI:10.1016/S0309-1740(03)00100-1.
