允许性高碳酸血症通气策略在婴儿肺囊腺瘤术单肺通气中的应用效果
2018-05-25李永乐彭玲莉袁超漆冬梅方琴黄伟坚胡祖荣刘晶
李永乐,彭玲莉,袁超,漆冬梅,方琴,黄伟坚,胡祖荣,刘晶
(广东省妇幼保健院,广州510010)
允许性高碳酸血症(PHC)是指患者接受机械通气时,在氧合满意的前提下,使用较小的潮气量(Vt),允许患者血内CO2在一定范围内的升高,从而避免机械相关的通气损伤(VALI)。PHC作为一种保护性的通气策略在急性呼吸衰竭(ARDS)中被广泛应用[1,2]。婴儿由于其肺容量小等生理发育特点,在实行单肺通气(OLV)时与ARDS有诸多相似的地方,故有学者提出应把婴儿OLV视为“特殊形式”的ARDS[3]。在我们过去的研究[4,5]中发现,在婴儿OLV时采用传统通气策略,Vt往往过大,导致肺顺应性较低,肺通气换气效率较低,而采用PHC通气策略不但可进一步改善婴儿的组织氧合,而且能起到更好的肺保护作用。本研究拟从肺部炎症角度出发,初步探索PHC对婴儿肺保护作用的可能机制,为临床更合理地权衡使用PHC策略提供科学依据。
1 资料与方法
1.1 临床资料 选择广东省妇幼保健院2016年5月~2017年5月择期行胸腔镜手术的肺囊腺瘤患儿64例,年龄49~351 d、体质量4.1~12.1 kg。入选标准:诊断肺囊腺瘤需行肺囊腺瘤切除术,ASA分级Ⅰ~Ⅱ级,无其他相关肺部疾病,且术前一般检查无明显异常。排除标准:血氧饱和度(SpO2)无法维持在90%以上或出现难以维持尖峰气道压(Ppeak)低于30 cmH2O;OLV时间小于1 h或手术时间超过3 h;术中出血量超过血容量20%;术中因手术需要转开胸手术。本研究经广东省妇幼保健院医学伦理协会批准并与患儿家属签署知情同意书。采用随机数字表法分成传统通气策略组(C组,n=32)和PHC通气策略组(H组,n=32)。最终共59例患儿入选本研究。其中,C组更改手术方式患儿1例,术中Ppeak无法维持低于30 cmH2O患儿2例;H组OLV时无法维持SpO2>90%以上患儿1例,OLV时间短于1 h患儿1例。C组男15例、女14例;H组男16例、女14例。两组基线资料有可比性。
1.2 手术方法 患儿入手术室后常规监护一般生命体征,行全身麻醉,快速静脉诱导,充分给氧去氮后气管内插管实行双肺通气,随后行动脉穿刺置管。采用压力控制通气模式。通过调节Ppeak和呼吸频率(RR)确定不同的Vt和每分钟最大通气量(MVV),以调整患儿呼吸末二氧化碳分压(EtCO2)。术前使两组EtCO2维持在正常水平(30~40 mmHg),吸入氧浓度(FiO2)为100%,以利于OLV时术侧肺部萎陷。采用纤支镜引导下支气管气管插管术至健侧肺部以实施OLV。改变体位后,通过听诊和纤支镜检查再次确认导管位置。随后于术侧胸腔进行人工气胸,维持压力在5~8 mmHg,并行胸腔镜下肺囊腺瘤切除术。术中使C组EtCO2维持在正常水平(30~40 mmHg),H组EtCO2维持在较高水平(50~70 mmHg)。除此以外,患儿术中均采取下列呼吸参数:吸呼比1∶1.5;新鲜期流量2 L/min;呼气末正压4~6 cmH2O;FiO2,初始设为50%,并视术中氧合情况调整。术中采用静吸复合麻醉,持续吸入1.5%~3%七氟醚,并根据术中情况间断给予顺阿曲库铵0.1 mg/kg,舒芬太尼0.3 μg/kg以维持麻醉深度。手术完成后,先将气管导管移回主气管实施双肺通气,随后再将患儿送至麻醉复苏室行麻醉复苏。
1.3 观察指标及其检测方法 于患儿气管插管后10 min(T1),人工气胸后30 min(T2)和60 min(T3),以及术后30 min(T4)四个时间点观察通气情况[Ppeak、Vt、RR、MVV],行动脉血气分析[pH值、PaO2、PaCO2、乳酸、氧合指数(OI)]。此外,术前和术后在通气侧肺行支气管灌洗,并收集支气管灌洗液(BALF)。利用公式计算OI,OI=PaO2/FiO2。采用ELISA法检测BALF中IL-6和IL-8的表达水平。术后第2天行X线检查,观察并发症发生情况。
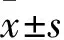
2 结果
2.1 两组患儿围术期情况及并发症情况比较 C组OLV时间、手术时间、拔管时间、术后复苏室(PACU)停留时间、失血量、尿量分别为(98.4±11.4)、(126.1±10.3)、(33.6±5.7)、(111.2±12.2)min,(1.2±0.20)mL/kg,(1.6±0.5)mL/(kg·h);H组分别为(94.4±9.5)、(121.2±13.8)、(35.7±6.4)、(116.0±11.8)min,(1.1±0.17)mL/kg,(1.5±0.4)mL/(kg·h)。两组各指标比较,P均>0.05。术后第2天X线检查示,C组出现胸腔积液2例,肺不张1例;H组出现胸腔积液1例,肺不张1例。两组术后肺部并发症发生率比较,P>0.05。
2.2 两组通气参数和动脉血气分析结果比较 与T1相比,两组患儿于T2和T3时PaO2和OI降低、Ppeak升高(P均<0.05),H组于T2和T3时Vt、MVV、pH值、乳酸水平较T1时降低,而PaCO2升高(P均<0.05)。与C组相比,H组于T2和T3时Ppeak、Vt、MVV、pH值以及乳酸水平均降低,PaCO2升高(P均<0.05)。见表1、2。

表1 两组不同时间点通气参数比较
注:与C组比较,#P<0.05;与同组T1比较,△P<0.05。
2.3 两组BALF中IL-6和IL-8表达水平比较 C组术前、术后IL-6分别为(9.16±5.92)、(63.65±36.28)pg/mL,IL-8分别为(110.52±42.40)、(423.71±210.17)pg/mL,H组术前、术后IL-6分别为(11.42±6.75)和(45.62±24.99)pg/mL,IL-8分别为(122.78±51.86)和(320.60±156.32)pg/mL。两组术前IL-6和IL-8表达水平比较,P均>0.05,两组术后IL-6和IL-8较术前增高(P均<0.05)。与C组相比,H组IL-6和IL-8表达水平低(P均<0.05)。

表2 两组不同时间血气分析指标比较
注:与C组比较,#P<0.05;与同组T1比较,△P<0.05。
3 讨论
目前,PHC作为一种保护性的通气策略在ARDS、哮喘、慢性阻塞性肺疾病、甚至危重早产儿等患者的机械通气治疗中均可起到积极作用[6]。合适的高碳酸血症不但可以减轻肺内通气血流比例的失衡,还可以引起肺表面物质分泌增多,改善肺的顺应性,从而促进机体氧合。此外,根据Bohr效应,pH值降低和CO2升高可使氧解离曲线右移,氧释放增多,加之高碳酸血症引起微血管扩张,组织灌流量增加,组织氧供得到有效改善。由此,我们认为PHC策略在婴儿OLV中应用更为合适。在本研究中,各组患儿的年龄、体质量、OLV时间、手术时间、麻醉时间等一般情况差异无统计学意义,且均为择期胸腔镜下肺叶切除术,具有较好的可比性。在氧合方面,尽管在H组中,PHC使OLV时的MMV更低,两组PaO2和OI差异无统计学意义,而H组血乳酸水平低于C组,提示PHC策略在较低的通气量下,即可维持不低于传统通气策略的氧合水平。考虑血乳酸水平可反映组织的缺氧程度,结果进一步提示PHC策略在改善组织氧合上或许更有优势,与文献[7,8]一致。
IL-6和IL-8为机体炎性反应中的促炎性因子,可视为肺部急性损伤的标志物[9]。炎症水平的高低在肺部疾病发生、发展以及转归中均起着极其重要的作用[10,11]。本研究结果显示,术前两组IL-6和IL-8水平差异无统计学意义,而术后IL-6和IL-8水平较术前均增高,说明两组可能均存在VALI。此外,H组术后IL-6和IL-8水平较C组低,提示PHC可在一定程度上减轻肺部炎症反应。其可能机制如下:首先,机械通气时较大Vt引起的物理牵拉可激活细胞MAPK通路中的p44/42蛋白,使其磷酸化并最终引起促炎性因子的释放[12]。而PHC策略采用较小的Vt,可一定程度上减轻物理牵拉,避免p44/42蛋白的磷酸化,从而减少促炎性因子的释放。其次,PHC策略引起的高CO2水平可参与调节细胞内一系列的信号传导通路。Contreras等[13]发现CO2可预防细胞质内IκB-α蛋白的降解,抑制p65蛋白的核转位,从而减轻物理牵拉引起的炎症反应。此外,近期的研究发现CO2可直接抑制NF-κB相关信号传导通路的激活,使IL-6和TNF-α等炎性因子释放减少的同时,提高IL-10等抗炎因子的表达水平,起到抗炎症反应的作用[14,15]。综上,PHC策略可一定程度上降低肺部炎症反应的水平,从而避免过度炎性反应导致的肺部损伤。
术后第2天X线显示两组患儿术后肺部并发症发生率差异无统计学意义,说明两种通气策略安全性相当,PHC策略的肺保护优势在本研究中并无充分体现。我们认为与研究设计相关。考虑过高Ppeak是引起机VALI的主要危险因素,不少研究建议机械通气时尽量控制Ppeak低于35 cmH2O[16]。因此,本研究设定通气时Ppeak应低于30 cmH2O,以保证患儿的医疗安全。然而,临床上采用传统通气策略时往往较难保证每例患儿OLV时Ppeak均低于30 cmH2O。其次,除通气容量外,机械通气的时间长短亦是VALI发生的相关因素之一。本研究中OLV时间较短,我们推测较短的OLV对患儿健康的肺部损伤程度有限,且该程度的损伤大多可在术后自行恢复。由此,我们认为PHC策略在婴儿需接受较长时间OLV的胸腔镜手术中可能会有更大的优势,而其具体范围仍有待进一步研究。
综上所述,PHC策略不但可以更好改善婴儿OLV时的氧供氧合,还可以通过调控肺部炎症反应水平,起到一定程度的肺保护作用。
参考文献:
[1] Amato MB, Barbas CS, Medeiros DM, et al. Effect of a protective-ventilation strategy on mortality in the acute respiratory distress syndrome[J]. N Engl J Med, 1998,338(6):347-354.
[2] Brower RG, Matthay MA, Morris A, et al. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome[J]. N Engl J Med, 2000,342(18):1301-1308.
[3] Senturk M. New concepts of the management of one-lung ventilation[J]. Curr Opin Anaesthesiol, 2006,19(1):1-4.
[4] Liu J, Liao X, Li Y, et al. Effect of low tidal volume with PEEP on respiratory function in infants undergoing one-lung ventilation[J]. Anaesthesist, 2017,9(66):667-671.
[5] 刘晶,苏润霞,黎昆伟,等.允许性高碳酸血症通气策略在婴儿胸腔镜肺切除术中的应用观察[J].山东医药,2017,57(31):92-94.
[6] Contreras M, Masterson C, Laffey J G. Permissive hypercapnia: what to remember[J]. Curr Opin Anaesthesiol, 2015,28(1):26-37.
[7] Fleischmann E, Herbst F, Kugener A, et al. Mild hypercapnia increases subcutaneous and colonic oxygen tension in patients given 80% inspired oxygen during abdominal surgery[J]. Anesthesiology, 2006,104(5):944-949.
[8] Hager H, Reddy D, Mandadi G, et al. Hypercapnia improves tissue oxygenation in morbidly obese surgical patients[J]. Anesth Analg, 2006,103(3):677-681.
[9] Cross LJ, Matthay MA. Biomarkers in acute lung injury: insights into the pathogenesis of acute lung injury[J]. Crit Care Clin, 2011,27(2):355-377.
[10] de la Gala F, Pineiro P, Garutti I, et al. Systemic and alveolar inflammatory response in the dependent and nondependent lung in patients undergoing lung resection surgery: a prospective observational study[J]. Eur J Anaesthesiol, 2015,32(12):872-880.
[11] Frick VO, Justinger C, Rubie C, et al. Thoracotomy procedures effect cytokine levels after thoracoabdominal esophagectomy[J]. Oncol Rep, 2012,27(1):258-264.
[12] Otulakowski G, Engelberts D, Gusarova GA, et al. Hypercapnia attenuates ventilator-induced lung injury via a disintegrin and metalloprotease-17[J]. J Physiol, 2014,592(20):4507-4521.
[13] Contreras M, Ansari B, Curley G, et al. Hypercapnic acidosis attenuates ventilation-induced lung injury by a nuclear factor-kappa B-dependent mechanism[J]. Crit Care Med, 2012,40(9):2622-2630.
[14] Cummins EP, Oliver KM, Lenihan CR, et al. NF-kappaB links CO2sensing to innate immunity and inflammation in mammalian cells[J]. J Immunol, 2010,185(7):4439-4445.
[15] Wang N, Gates KL, Trejo H, et al. Elevated CO2selectively inhibits interleukin-6 and tumor necrosis factor expression and decreases phagocytosis in the macrophage[J]. FASEB J, 2010,24(7):2178-2190.
[16] Petrucci N, De Feo C. Lung protective ventilation strategy for the acute respiratory distress syndrome[J]. Cochrane Database Syst Rev, 2013(2):CD003844.
