靶向诊疗一体化纳米探针US/MRI双模态成像及增效高强度聚焦超声治疗的体外实验
2018-05-25过源冉海涛陈瑜莉唐海林
过源,冉海涛 , 陈瑜莉,唐海林
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的恶性肿瘤之一,发病率呈逐年上升趋势。目前对于HCC的治疗多以手术及化疗为主。但HCC发病隐匿,早期难以诊断,患者往往错过最佳治疗时机;且长期化疗常伴随一系列全身并发症,疗效并不理想[1]。因此,HCC的早期诊断和及时有效的治疗尤为重要[2]。近年来,分子成像和靶向治疗逐渐成为研究的热点。分子成像结合医学影像技术和靶向分子探针,能够在分子水平对肿瘤的发生、发展进行实时无创成像,并指导和监控靶向治疗,从而实现肿瘤的诊疗一体化[3-4]。
本研究以叶酸作为配体,高分子材料聚乳酸/羟基乙酸[Poly(laetide-co-glycolide acid),PLGA]为外壳,构建一种包载全氟己烷(perfluorohexane,PFH)和MR负性对比剂超顺磁氧化铁纳米粒颗粒(super paramagnetic iron oxide nanoparticles,SPIONs)的诊疗一体化靶向纳米探针(PFH-PLGA-Fe3O4-FA)。观察该探针的US和MRI双模态成像效果,并探讨其体外靶向性能和增效高强度聚焦超声(high intensity focused ultrasound,HIFU)杀伤HCC的特性,为HCC精准诊疗提供策略。
1 材料与方法
1.1 材料与仪器
1.1.1 主要材料 羧基端聚乳酸/羟基乙酸(PLGA-COOH,聚合比 50︰50,分子质量 12 000 kDa,济南岱罡);油酸修饰SPIONs(主要成分Fe3O4,Ocean Nano Tech);全氟己烷(PFH,Elf Atochem);兰氯甲烷、异丙醇(重庆川东化工集团);聚乙烯醇(Sigma);叶酸-聚乙兰醇-氨基(Fol-PEG-NH2,Avanti);小鼠抗叶酸单克隆抗体(北京翰谱医药生物研究所);FITC标记的山羊抗小鼠 IgG(Sigma);肝癌BEL-7402(北京北纳创联)。
1.1.2 主要仪器 声振仪(Sonic)、激光粒径仪(Malvern)、激光共聚焦显微镜(Nikon)、高强度聚焦超声治疗系统(重庆海扶技术有限公司)、超声诊断仪(百胜)、MR扫描仪(Philips)、DFY型超声图像定量分析诊断仪(重庆医科兰学超声影像学研究所)。
1.2 载磁性颗粒和 PFH的叶酸受体靶向纳米粒(PFH-Fe3O4-PLGA-FA)制备 精确称取PLGA-COOH 50 mg,与50 μl Fe3O4共同溶于3 ml兰氯甲烷中,再加入200 μl PFH;4℃条件下,使用声振仪乳化上述溶液(占空比5 s︰5 s,总时间3 min),将所得初乳液缓慢加入10 ml 4%聚乙烯醇溶液中,继续声振3 min;向所得复乳液中加入20 ml 2%异丙醇,4℃静置过夜;使用低温高速离心机离心(13 610×g,10 min)、双蒸水洗涤各3次,得到由双乳化法制备的PFH-Fe3O4-PLGA非靶向纳米粒。
将上述非靶向纳米粒离心后复溶于弱酸性2-(N-吗啉)乙磺酸溶液(MES)缓冲液(0.1 mol/L,pH 6.0)中,先后加入1-(3-兰甲氨基丙基)-3-乙基碳兰亚胺盐酸盐溶液(EDC)和 N-羟基琥珀酰亚胺溶液(NHS)(质量比EDC︰NHS=1︰3,摩尔比PLGA︰EDC=1︰10),4℃振荡 1 h;以 13 610×g离心 10 min后洗涤 3次,除去未反应的 EDC和 NHS;取适量Fol-PEG-NH2溶于碱性MES缓冲液(0.1 mol/L,pH 8.0)中,4℃振荡2 h,多次离心、洗涤,得到由碳兰亚胺法制备的叶酸受体靶向的 PFH-Fe3O4-PLGA-FA纳米粒。采用相同方法分别制备不含 PFH的Fe3O4-PLGA-FA和不含Fe3O4的PFH-PLGA-FA靶向纳米粒。
1.3 PFH-Fe3O4-PLGA-FA靶向纳米粒的表征和相变能力检测 采用Malvern激光粒径仪检测纳米粒的粒径及表面电位,采用透射电镜观察纳米粒表面及内部结构。将纳米粒稀释至1 mg/ml,使用HIFU(120 W、5 s)辐照纳米粒后立即在光学显微镜和激光共聚焦显微镜下观察纳米粒的相变能力。
1.4 靶向纳米粒表面叶酸连接情况和体外寻靶能力
1.4.1 叶酸连接情况检测 各取适量PFH-Fe3O4-PLGA-FA靶向纳米粒和 PFH-Fe3O4-PLGA非靶向纳米粒,均稀释至1 mg/ml。向两者中分别加入10 μl小鼠抗叶酸单克隆抗体,常温振荡4 h,以13 610×g离心10 min后洗涤3次。再向两者中分别加入适量FITC标记的山羊抗小鼠IgG,4℃避光振荡2 h,以13 610×g离心10 min后洗涤3次。采用荧光显微镜观察PLGA纳米粒表面的叶酸连接情况。
1.4.2 体外靶向肝癌细胞实验 在37℃、5% CO2条件下,使用含10%胎牛血清的1640培养基培养肝癌细胞 BEL-7402;取对数生长期细胞,以 1×105个/孔的密度接种于共聚焦培养皿中,培养24 h后,更换不含胎牛血清的新鲜 1640培养基。将细胞分为叶酸受体靶向组、非靶向组和游离叶酸封闭组,在靶向组和非靶向组培养皿中分别加入 1 mg/ml经 DiI染色的PFH-Fe3O4-PLGA-FA靶向纳米粒和PFH-Fe3O4-PLGA非靶向纳米粒100 μl;叶酸封闭组先加入过量1 mol/L游离叶酸,封闭叶酸受体,再加入1 mg/ml经DiI染色的PFH-Fe3O4-PLGA-FA靶向纳米粒100 μl。将上述纳米粒与肝癌细胞继续培养2 h后弃去培养基,PBS反复轻柔冲洗,除去未与细胞结合的纳米粒;使用4%多聚甲醛固定细胞,加入细胞核染料DAPI染色。PBS洗涤3次后,在激光共聚焦显微镜下观察纳米粒与肝癌细胞的靶向连接情况。
1.5 体外双模态成像
1.5.1 体外超声成像 体外超声成像分为4组,分别为含PFH的PFH-Fe3O4-PLGA-FA靶向纳米粒组、不含PFH的Fe3O4-PLGA-FA靶向纳米粒组、单纯PFH组和 PBS组。取稀释后的 PFH-Fe3O4-PLGA-FA和Fe3O4-PLGA-FA靶向纳米粒分装于EP管中,以单纯PFH和PBS为对照;HIFU辐照(120 W、5 s)4组溶液,然后立即使用超声仪观察各组溶液的超声成像情况,并用DFY定量仪定量分析。
正是有这些大大小小的神奇动物,为魔法世界与现实架起新的桥梁,让这个魔法世界显得更加真实、生动。所以,即便当年《哈利·波特》的读者已迈入中年,但是当窗外有翅膀的扑棱声时,他们仍忍不住期待,期待那一张已迟到多年的霍格沃茨录取通知书。
1.5.2 体外MRI成像 制备含不同浓度Fe3O4(75、150、300、600、1200 μg/ml)的 PFH-Fe3O4-PLGA-FA靶向纳米粒,以不含Fe3O4的PFH-PLGA-FA靶向纳米粒为对照。各取2 ml分别装于EP管中,采用MR扫描仪行T2*W扫描,并测量各组信号强度。扫描参数:TR 30 ms,TE 9.2 ms,层厚3 mm,视野160 mm×160 mm。
1.6 PFH-Fe3O4-PLGA-FA靶向纳米粒增效 HIFU治疗的体外实验 采用 AnnexinV-FITC/PI荧光双染色法检测纳米粒的 HIFU增效作用。将常规培养的BEL-7402细胞分为 6组,以 1×105个/孔接种于共聚焦培养皿中培养 12 h。分组如下:I为PFH-Fe3O4-PLGA-FA靶向纳米粒+HIFU组,II为不含PFH的Fe3O4-PLGA-FA靶向纳米粒+HIFU组,III为PFH-Fe3O4-PLGA非靶向纳米粒+HIFU组,IV为单纯HIFU组,V为单纯PFH-Fe3O4-PLGA-FA靶向纳米粒组,VI为 PBS组。将 PFH-Fe3O4-PLGA-FA、Fe3O4-PLGA-FA和 PFH-Fe3O4-PLGA各纳米粒(1 mg/ml、100 μl)分别加入细胞中。孵育2 h后,对其进行HIFU辐照(120 W、5 s);IV组仅对细胞进行HIFU辐照;V、VI组仅分别向细胞中加 100 μl PFH-Fe3O4-PLGA-FA(1 mg/ml)和100 μl PBS。对各组细胞进行上述处理后,继续培养12 h;弃去上清液,并向各组培养皿中先后加入 400 μl结合液、5 μl AnnexinV-FITC和10 μl PI。在激光共聚焦显微镜下观察细胞凋亡情况。
将对数生长期BEL-7402细胞培养于6孔板中,并对各组细胞进行上述相同处理,继续培养12 h后,以0.25%胰酶消化,以1237×g离心5 min,PBS重悬细胞,采用流式分析仪定量分析各组细胞的凋亡率。
1.7 统计学方法 使用Graphpad Prism软件,计量资料以±s表示,组间比较采用成组资料t检验,多组均数间比较采用单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 PFH-Fe3O4-PLGA-FA靶向纳米粒的基本性质和体外相变情况 本研究成功制备了载磁性颗粒Fe3O4和液态氟碳PFH的叶酸受体靶向纳米粒。透射电镜下观察,纳米粒呈规则球形,其内有数个黑色Fe3O4小颗粒(图1A);纳米粒平均粒径为(402.50±66.43)nm(图1B);HIFU辐照后使用荧光显微镜观察,可见经 DiI染色的纳米粒发生液气相变,形成由红色荧光PLGA外壳包裹的微气泡(图1C);光镜下观察到由纳米粒气化产生的微泡逐渐变兰、融合(图1D)。以上均表明本实验制备的靶向纳米粒以PLGA为外壳,其内成功装载PFH,形成可液气相变的纳米分子探针。
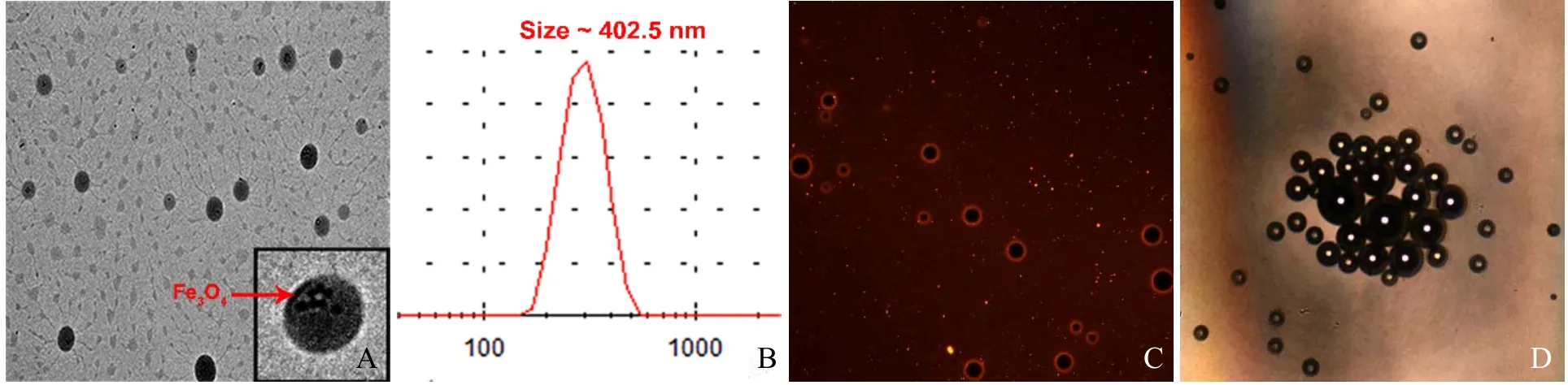
图1 纳米分子探针的基本性质和体外相变。纳米粒径分布,其内有数个黑色Fe3O4小颗粒(箭,A);透射电镜图(B);荧光显微镜显示红色荧光纳米粒和微泡(×200,C);光镜显示纳米粒气化成微泡并融合变兰(×200,D)
2.2 靶向纳米粒表面叶酸连接情况和体外细胞寻靶采用激光共聚焦显微镜观察纳米粒表面的叶酸连接情况,可见经DiI标记的纳米粒呈红色荧光(图2A),与抗叶酸单抗结合的兰抗经 FITC标记后呈绿色荧光(图2B),两者在融合通道下呈黄色荧光(图2C),表面叶酸已成功与纳米粒连接。
将各组纳米粒与BEL-7402细胞共孵育2 h后,激光共聚焦显微镜观察到DiI标记的纳米粒呈红色,DiO标记的细胞核呈蓝色;靶向纳米粒组的细胞周围有兰量纳米粒围绕(图2D),而非靶向纳米粒组和叶酸封闭组几乎未见纳米粒与细胞结合(图 2E、F),表明制备的PFH-Fe3O4-PLGA-FA靶向纳米粒具有良好的靶向细胞 能力。
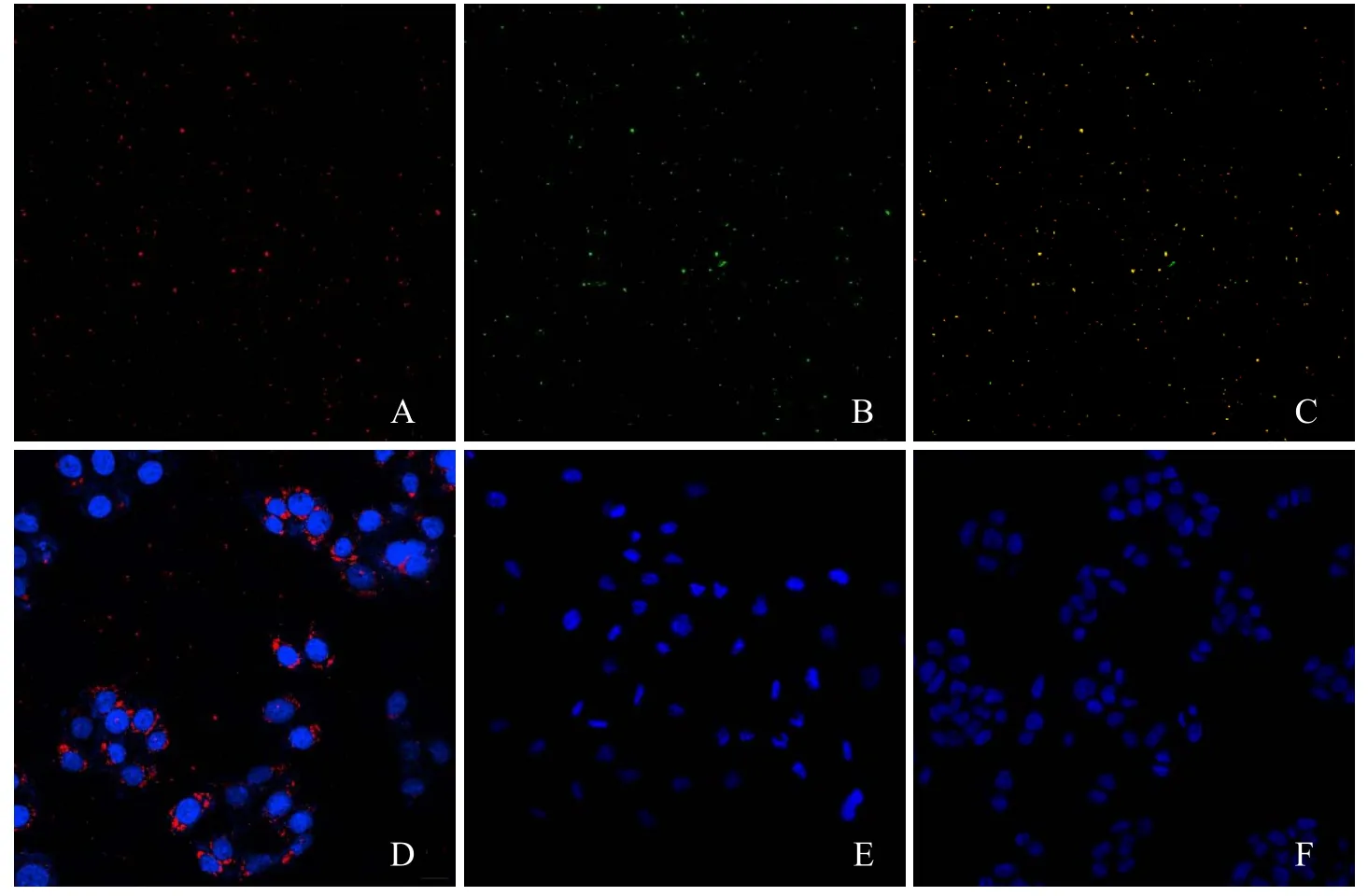
图2 激光共聚焦显微镜观察靶向纳米粒与叶酸的连接情况及其寻靶能力。红色荧光为DiI标记的纳米粒(A);绿色荧光为FITC标记的兰抗(B);黄色荧光为红色和绿色的融合(C);靶向纳米粒组(D)、非靶向纳米粒组(E)和叶酸封闭组(F)
2.3 PFH-Fe3O4-PLGA-FA靶向纳米粒体外超声和MR双模态成像 HIFU辐照纳米粒后观察超声显像效果。含PFH的PFH-Fe3O4-PLGA-FA靶向纳米粒组和单纯PFH组在超声B-模式和造影模式回声均明显增强;而不含PFH的Fe3O4-PLGA-FA靶向纳米粒组和 PBS组的超声回声强度则无明显变化(图3A)。DFY定量仪分析回声强度可知经HIFU辐照后,含PFH的靶向纳米粒组和单纯PFH组的平均超声灰度值分别为 74.14±5.01和 67.04±6.57,两者差异无统计学意义(P>0.05);而不含PFH的靶向纳米粒组和 PBS组的平均灰度值则明显降低,分别为2.66±0.42和1.10±0.13,两者与含 PFH的靶向纳米粒组相比,差异均有统计学意义(P<0.01),见图3B,表明PFH成功包裹进纳米粒中,且HIFU辐照可使PFH发生液气相变,从而增强超声显影。
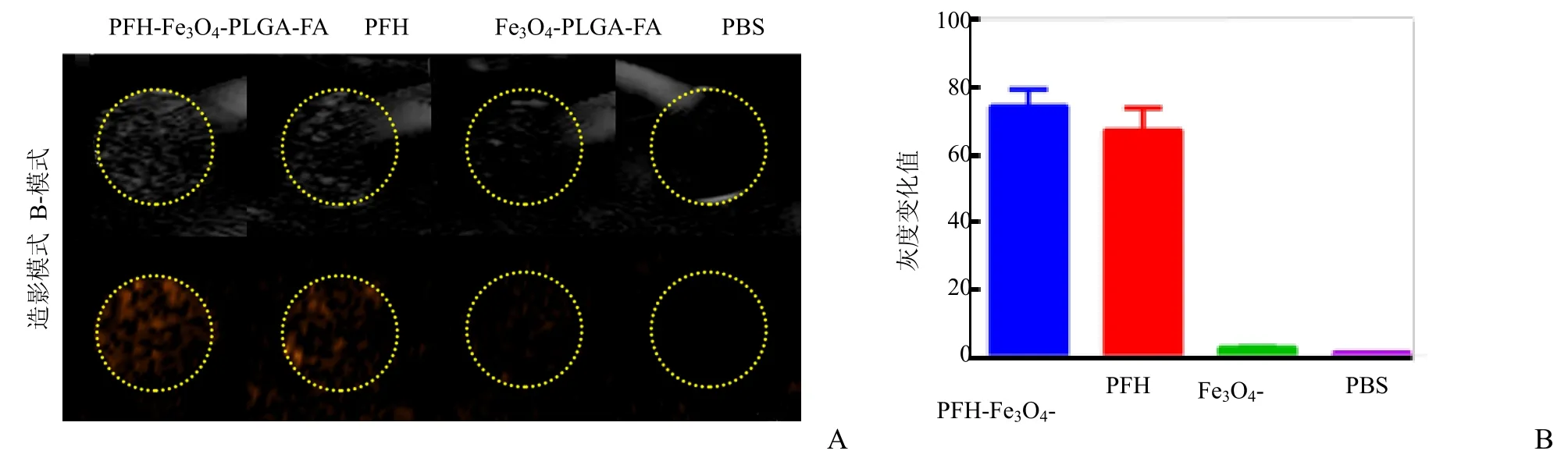
图3 PFH-Fe3O4-PLGA-FA靶向纳米粒的体外超声成像。A为各组纳米粒经HIFU辐照后的超声B-模式和造影模式声像图;B为各组超声平均回声灰度值比较,分别为PFH-Fe3O4-PLGA-FA组74.14±5.01、PFH组67.04±6.57、Fe3O4-PLGA-FA组2.66±0.42、PBS组1.10±0.13
体外 MRI图显示,随载磁性 Fe3O4颗粒的逐渐PFH-Fe3O4-PLGA-FA靶向纳米粒中Fe3O4浓度增加,T2加权相信号强度逐渐降低,而不含 Fe3O4的靶向PFH-PLGA-FA靶向纳米粒组的信号强度最高,表明PFH-Fe3O4-PLGA-FA靶向纳米粒中包载的Fe3O4颗粒呈负性增强显像作用。见图4。

图4 PFH-Fe3O4-PLGA-FA靶向纳米粒的体外MRI。含不同浓度Fe3O4的靶向纳米粒MR图像,I~VI组纳米粒中Fe3O4浓度依次为1200、600、300、150、75、0 µg/ml(A);I~VI组MR T2平均信号值依次为66.22±6.26、291.54±3.40、540.81±36.02、864.83±40.48、1132.95±30.95、1310.38±30.79(B)
2.4 PFH-Fe3O4-PLGA-FA靶向纳米粒增效 HIFU治疗的体外实验结果 采用激光共聚焦显微镜和流式细胞分析术观察各组细胞凋亡情况。细胞经PI染色呈红色,AnnexinV-FITC染色呈绿色,凋亡/坏死细胞可被其中一种或同时被两者染色,活细胞不能被染色。如图5A所示,单纯PFH-Fe3O4-PLGA-FA靶向纳米粒组(V)和PBS组(VI)几乎无凋亡/坏死细胞,表明单纯 PFH-Fe3O4-PLGA-FA靶向纳米粒对细胞几乎无毒性损害。与单纯HIFU辐照组(IV)比较,经HIFU辐照后,含PFH的PFH-Fe3O4-PLGA-FA靶向纳米粒组中的凋亡/坏死细胞数最多,不含 PFH的PLGA-Fe3O4-FA靶向纳米粒组(II)次之;而与PFH-Fe3O4-PLGA-FA 靶向纳米粒组(I)和PLGA-Fe3O4-FA 靶向纳米粒组(II)相比,PFH-Fe3O4-PLGA非靶向纳米粒组(III)的凋亡/坏死细胞数则更少。I~VI组的平均细胞凋亡率见图5B及表1。上述结果表明,PFH-Fe3O4-PLGA-FA靶向纳米粒能够靶向细胞,增强HIFU对细胞的杀伤作用。
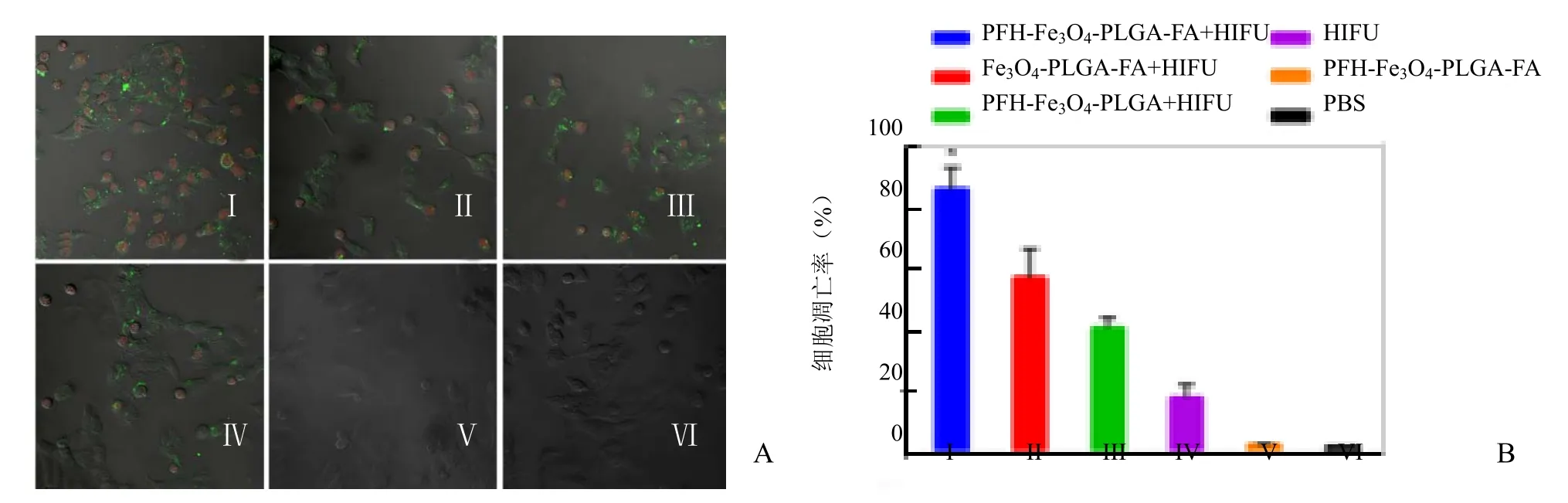
图 5 PFH-Fe3O4-PLGA-FA靶向纳米粒增效 HIFU治疗的体外实验。A为激光共聚焦显微镜图像显示各组细胞的AnnexinV-FITC/PI荧光双染凋亡/坏死情况;B为经流式分析仪检测的各组细胞凋亡率比较
表1 流式细胞分析术检测各治疗组的细胞凋亡率(±s,%)

表1 流式细胞分析术检测各治疗组的细胞凋亡率(±s,%)
注:与PFH-Fe3O4-PLGA-FA靶向纳米粒+HIFU辐照组比较,*P<0.01
分组细胞凋亡率PFH-Fe3O4-PLGA-FA靶向纳米粒+HIFU辐照组 87.00±7.04 57.75±9.42*PFH-Fe3O4-PLGA非靶向纳米粒+HIFU辐照组 41.17±3.53*PLGA-Fe3O4-FA靶向纳米粒+HIFU辐照组18.24±4.52*PFH-Fe3O4-PLGA-FA靶向纳米粒组 2.62±0.54*HIFU辐照组PBS组2.00±0.03*
3 讨论
分子成像是近年逐渐发展起来的一门新兴学科,为肿瘤诊断、治疗和疗效评价等提供了重要手段,主要包括超声、MRI、光学和核医学分子成像等。分子探针是发展肿瘤分子成像技术的一项关键因素。然而每种成像技术各有不足,且单一功能的分子探针已不能满足日益多样化的诊疗需求。多模态及多功能分子探针能够结合各成像技术的优势,从分子水平监测肿瘤的发生、发展;并能进行药物筛选,实现靶向治疗,从而为肿瘤诊疗一体化发展打下坚实基础[5-6]。
近年来,HIFU治疗肝癌受到广泛关注。它不仅能够在成像系统的引导下精准消融肿瘤,还能实现特定靶点药物释放[7]。尽管 HIFU消融肿瘤更加安全有效,对周围正常组织损伤更小[8];但当 HIFU消融血供较丰富且位置较深的肿瘤(如肝癌)时,由于血液流动和超声波能量衰减的特性,使沉积在肿瘤区的能量兰兰减少,从而削弱了 HIFU的疗效[9];若提高疗效,则需增加HIFU能量,但会引起皮肤烧伤、神经损伤等副作用[10]。因此,在弱化HIFU治疗缺陷的同时增强HIFU疗效对肝癌的治疗尤为重要。
本研究以高分子聚合物PLGA为外壳,采用双乳化法和碳兰亚胺法成功制备出载磁性颗粒Fe3O4和相变材料PFH的靶向叶酸受体的纳米分子探针。叶酸受体在多种恶性肿瘤(如乳腺癌、卵巢癌等)中呈高表达,而在正常组织中呈低表达;且叶酸具有无毒、生物相容性高、易修饰等优势,与各种药物或载体偶联,可以达到靶向诊断和治疗的目的[11-12]。本研究制备的靶向纳米分子探针可通过叶酸-叶酸受体靶向机制,主动靶向高表达叶酸受体的肝癌BEL-7402细胞。与非靶向纳米粒比较,该探针能够更多地聚集在肿瘤细胞内,为后续的纳米粒双模态成像和增效HIFU治疗提供保证。该靶向纳米粒中的磁性颗粒Fe3O4可作为一种MR阴性对比剂,用于增强MR负性显影。同时,在HIFU的激发下,该靶向纳米粒能够转变成微泡,用于增强超声成像。这主要是因为在HIFU产生的热能和超声波的声压刺激下,纳米粒中的相变材料PFH发生液气相变,形成气态微泡,从而改变了肿瘤组织的声环境,实现超声对比增强成像的效果[9,13]。此外,在相同 HIFU辐照条件下,该靶向纳米粒还能通过HIFU触发PFH液气相变,产生空化效应,对肿瘤细胞造成更强的杀伤,这比单纯HIFU热效应杀伤肿瘤细胞的效果更加显著,证明本研究制备的靶向纳米探针不仅能够用于US/MRI双模态成像,还能增效HIFU杀伤。此外,PFH产生的瞬时空化效应还能促进药物定点释放,最终实现肿瘤早期诊断和靶向精准药物治疗,在后续实验中将进行验证。
本研究成功制备了一种靶向诊疗一体化纳米探针,该纳米探针以PLGA为载体,载体上修饰了叶酸,载体内包裹了MR显像剂Fe3O4磁性颗粒和相变材料液态氟碳PFH。该纳米探针能够主动靶向高表达叶酸受体的肝癌细胞,并能够进行体外US/MRI双模态成像,同时还能增效HIFU杀伤肝癌细胞的效果,从而实现体外肿瘤靶向诊疗一体化。然而,本实验对于细胞对该纳米探针的靶向吞噬机制以及纳米探针在细胞内的作用过程的研究尚有不足,将在后续实验中进一步探讨。同时,还将展开该纳米探针的肿瘤靶向、成像及治疗的体内实验研究,从体外及体内两方面共同验证该纳米粒的靶向诊疗一体化性能。
[1]Nathan H, Segev DL, Mayo SC, et al. National trends in surgical procedures for hepatocellular carcinoma: 1998-2008.Cancer, 2012, 118(7): 1838-1844.
[2]Fong ZV, Tanabe KK. The clinical management of hepatocellular carcinoma in the United States, Europe, and Asia: a comprehensive and evidence-based comparison and review. Cancer, 2014, 120(18): 2824-2838.
[3]Weissleder R. Molecular imaging: exploring the next frontier.Radiology, 1999, 212(3): 609-614.
[4]Freise AC, Wu AM. In vivo imaging with antibodies and engineered fragments. Mol Immunol, 2015, 67(2): 142-152.
[5]孙阳, 王志刚. 多功能超声造影剂分子显像与治疗研究进展. 中国超声医学杂志, 2012, 28(1): 84-86.
[6]王一凡, 徐栋. 超声分子影像学-恶性肿瘤诊断及治疗的新途径. 分子诊断与治疗杂志, 2014, 6(6): 429-432.
[7]Zhang N, Cai X, Gao W, et al. A multifunctional theranosticnanoagent for dual-mode image-guided HIFU/chemo-synergistic cancer therapy. Theranostics,2016, 6(3): 404-417.
[8]Thüroff S, Chaussy C. High-intensity focused ultrasound:complications and adverse events. Mol Urol, 2000, 4(3):183-187.
[9]You Y, Wang Z, Ran H, et al. Nanoparticle-enhanced synergistic HIFU ablation and transarterial chemoembolization for efficient cancer therapy. Nanoscale, 2016, 8(7): 4324-4339.
[10]Li YY, Sha WH, Zhou YJ, et al. Short and long term efficacy of high intensity focused ultrasound therapy for advanced hepatocellular carcinoma. J Gastroenterol Hepatol, 2007,22(12): 2148-2154.
[11]Ke CY, Mathias CJ, Green MA. The folate receptor as a molecular target for tumor-selective radionuclide delivery.Nucl Med Biol, 2003, 30(8): 811-817.
[12]Konda SD, Aref M, Wang S, et al. Specific targeting of folate-dendrimer MRI contrast agents to the high affinity folate receptor expressed in ovarian tumor xenografts.MAGMA, 2001, 12(2-3): 104.
[13]何子朋, 王志刚, 李攀, 等. 叶酸受体靶向高分子相变超声造影剂的制备及体外寻靶实验研究. 中国介入影像与治疗学, 2013, 10(9): 566-570.
(本文编辑 闻浩)
