水稻纹枯病拮抗细菌7-5的鉴定及其生防机制初步研究
2018-05-25张清霞张迎何玲玲陈夕军童蕴慧纪兆林
张清霞 张迎 何玲玲 陈夕军 童蕴慧 纪兆林
由立枯丝核菌(Rhizoctonia solani)引起的水稻纹枯病是一种世界性病害,在世界各主要水稻产区都有发生且危害严重。近年来,随着矮秆多蘖品种的推广,水稻密集型栽培方式的采用,以及氮肥施用量的不断增加,纹枯病的危害逐年加重,在我国各稻区已经成为最严重的水稻病害之一。目前,对于该病害的防治主要是以化学防治为主,但随着近年来该病害发生的不断加重,对于药剂的使用量也逐年增加,导致农药残留日趋严重[1]。尽管井冈霉素对纹枯病防治效果较好,但经过长期使用在田间也发现了抗药性菌株[2]。因此,寻找安全有效的防治技术和方法迫在眉睫。生物防治具有对人畜安全、对环境压力小、不易诱导病菌产生抗药性等优点,有的生防菌还可以促进农作物生长,因而具有广阔的发展前景。
许多微生物对水稻纹枯病菌有较强的拮抗能力,如链霉菌(Streptomyces)[3]、禾长蠕孢菌(Helminthosporium gramineum)[4]、假紫色色杆菌(Chromobacterium pseudoviolaceum)[5]、芽孢杆菌(Bacillus)[6]、假单胞菌(Pseudomonas)和木霉(Trichoderma)[7]等。不同微生物对水纹枯病菌作用机制差异明显。Duan等[4]用禾长蠕孢产生的粗毒蛇孢假壳素来防治水稻纹枯病,发现该物质能明显减轻水稻纹枯病,而且对水稻的生长无任何副作用,亦不影响产量和品质。稠李链霉菌JAU4234对水稻纹枯病菌作用机制是抑制菌丝生长、抑制致病因子表达和蛋白质合成[3]。陈思宇报道荧光假单胞菌XF-174对水稻纹枯病的盆栽和田间小区防效均为40%以上,该细菌主要产生蛋白酶、嗜铁素、赤霉素等次生代谢产物,不产生几丁质酶、纤维素酶和吲哚乙酸[8]。
已报道的生防细菌中,假单胞菌由于其独特的种群优势,应用其防治植物病害已成为当前研究的热点。假单胞菌属细菌是植物根际土壤微生态的优势微生物种群之一,具有分布广、数量多、营养要求简单、繁殖快、竞争定殖力强的特点[9]。而在众多的假单胞属细菌中分离得到最多且研究比较深入的有绿针假单胞菌(P.chlororaphis)、荧光假单胞菌(P.fluorescens)以及铜绿假单胞菌(P.aeruginosa)。其作用机制主要产生次生代谢产物包括抗生素吩嗪-1-羧酸(phenazine-1-carboxylic acid,PCA)、2,4-二乙酰基间苯三酚(2,4-diacetylphloroglucinol,PHL)、硝吡咯菌素(pyrrolnitrin,PRN)、藤黄绿脓菌素(pyoluterorin,PLT)、假单胞菌酸(pseudomonic acid)、氢氰酸和植物生长素吲哚乙酸(indole-3-acetic acid,IAA),挥发性有机化合物如3-羟基-2-丁酮及2R,3R-丁二醇等[10-11]。在水稻纹枯病生物防治中,利用生防细菌抑制病原物侵染提高植物抗病能力是一条有效途径。为挖掘更多的生防资源,我们从实验室保存的生防菌中筛选对水稻纹枯病防病效果强的拮抗细菌,通过16S rDNA序列分析和生理生化性状测定,明确菌株7-5的分类地位,并对其可能的生防性状进行初步探索。
1 材料与方法
1.1 材料
供试水稻为纹枯病感病品种Lemont。供试细菌为 4-78、10-3、12-4、7-5、4-74、HTC-1、HTC-5、W10,均为本实验室保存。其中,解淀粉芽孢杆菌(Bacillus amyloliquefaciens)W10是本实验室保存的一株抑菌谱广、对多种植物病害都有较好防病效果的生防细菌,本研究中以该细菌作为参照菌株。
供试真菌包括病原真菌水稻纹枯病菌(Rhizoctonia solani)、油菜菌核病菌(Sclerotinia sclerotiorum)、桃褐腐病菌(Monilinia fructicola)、稻瘟病菌(Pyricularia grisea)、草莓灰霉病菌(Botrytiscinerea)、辣椒疫霉病菌(Phytophthora capsici),均由本实验室保存。
所用试剂TaqDNA聚合酶、dNTP,购于TaKaRa公司;2,4-二乙酰基间苯三酚、乙酰丙酮铜和4,4’-对二甲氨基二苯基甲烷由中国农业大学张力群教授馈赠;藤黄绿脓菌素和吩嗪-1-羧酸纯品由上海交通大学张雪洪教授馈赠;其他试剂均为国产分析纯。
所用培养基包括金氏B培养基[12]、几丁质酶检测培养基[13]、蛋白酶检测培养基[14]、纤维素酶检测培养基[15]、嗜铁素检测培养基[16]、PPM培养基[17]。
1.2 苗期防病试验
参考陈夕军[18]的方法略作修改。将水稻纹枯病感病品种Lemont种子经1%双氧水浸泡1 d后,再用清水浸泡2 d左右,浸种温度为30℃。待绝大多数种子发芽后分别播于直径20 cm的塑料盆中,每盆栽种10粒种子,待水稻长成4叶1心时接种,去除大于4叶和小于3叶的植株,各重复均保留7株苗。采用牙签嵌入法接种。将火柴棒剪成0.8~1.0 cm长后劈分为二,每个PDA培养皿称放1.5 g火柴棒并浸湿,灭菌后接种纹枯病病菌,培养3 d后可用于接种。将新活化的供试生防细菌接种于50 mL LB液体培养基中,在28℃摇床170 r/min下摇培48 h后喷雾处理水稻,24 h后用镊子将带菌的火柴棒紧贴在植株基部,接种后移至温室内,再用塑料薄膜覆盖保温保湿,温度和湿度分别控制在28℃和85%,接种后7 d测量病斑高度(最高病斑的上界距土表的高度)和植株高度(秧苗最高叶尖距土表的高度),根据公式计算病级及防病效果,每处理3次重复。试验重复2次。
病级=病斑高度/苗挺高×9;
病情指数=∑(各级病株数×该病级值)/(调查总株数×最高级值)×100;
防治效果(%)=(对照组病情指数—处理组病情指数)/对照组病情指数×100。
1.3 抑菌谱测定
采用平板对峙培养法略作修改。在PDA平板中央接种病原真菌菌碟(直径0.5 cm)25℃培养1 d,在距离菌块25 mm 处接种细菌悬浮液3 μL,置于25℃恒温箱培养2~7 d测定抑菌带宽。
1.4 菌株鉴定
采用CTAB/NaCl法提取菌株7-5的基因组DNA。采用16S rDNA保守引物16S-63F和16S-1387R[19]进行PCR扩增。PCR扩增反应条件如下:94℃下变性5 min,68℃下退火40 s,56℃下复性40 s,72℃下延伸10 min,循环35次;72℃下充分延伸10 min。引物合成和测序由上海生工生物工程有限公司完成。采用BLASTn程序在GenBank数据库中进行同源序列搜索。用MEGA 5.05软件进行多重序列比对及系统发育分析(邻接法),并用Bootstrap软件对进化树进行1000次可信度分析。
依据《常见细菌系统鉴定手册》中的假单胞菌属内特征进行生理生化鉴定[12]。
1.5 生防作用机制分析
1.5.1 拮抗细菌抗生素合成相关基因检测及其鉴定
利用表1中引物phl2a/phl2b、PCA2a/PCA3b、prnCF/prnCR、pltcf/pltcr扩增抗生素PHL、PCA、PRN和PLT合成基因簇对应的片段,各个基因退火温度见表1。其中荧光假单胞菌(P.fluorescens)FD6作为PHL、PLT和PRN阳性对照以及PCA的阴性对照;荧光假单胞菌PAO1作为PCA阳性对照;荧光假单胞菌2P24作为PLT、PCA和PRN的阴性对照,PCR产物经1%琼脂糖凝胶电泳检测。
将新鲜7-5细菌划线接种到PDA平板上,置于28℃下培养5 d,将培养基切碎后转移到100 mL三角瓶中,加入50 mL乙酸乙酯,将其放在37℃下振荡90 min,室温静置5 min,收集上清,移到蒸馏瓶中旋转蒸发,用100 μL甲醇溶解,获得PRN和PHL粗提物,抗生素展开剂为氯仿与丙酮混合物(19∶1);取单菌落置于5 mL金氏B培养液,在28℃下振荡培养9 h,分别取2.5 mL悬浮液转移到50 mL PPM培养液及金氏B培养液28℃下振荡培养84 h。分别将细菌液8 000 r/min下离心10 min,收集上清液,用1 mol/L盐酸酸化至pH 2.0,用0.4倍体积的乙酸乙酯萃取,连续振荡10 min,收集乙酸乙酯相,真空抽干,用100 μL甲醇溶解,获得PCA和PLT粗提物[17]。

表1 本研究所用引物Table 1.Primers used in this study.
1.5.2 拮抗细菌其他代谢产物检测
氢氰酸的检测:制氢氰酸敏感试纸,将新鲜的待测菌穿刺接种于盛有5mL固体金氏B培养基的试管中,培养基上方悬挂小片氢氰酸敏感试纸,密封28℃培养48 h后观察试纸显色情况。
几丁质酶检测[13]:在几丁质检测平板上,将活化的待测菌穿刺接种于平板上。28℃培养3~7 d后测量菌落外围透明圈的大小。
蛋白酶的检测[14]:在蛋白酶检测平板上,将已活化2 d的细菌接于培养基平板上。置于28℃下培养2 d,观察菌落周围的透明圈。
纤维素酶检测[15]:在纤维素酶检测平板上,将活化的待测菌穿刺接种于平板上。28℃下培养3~4d,用0.9%NaCl溶液清洗平板,每2 h除去NaCl溶液1次,冲洗并重新倒入新的NaCl溶液。6 h后观察菌落周围黄色晕圈并计算大小。

图1 拮抗细菌对水稻纹枯病的防治效果Fig.1.Control effects of antagonistic bacteria on rice sheath blight.
嗜铁素的检测[16]:在嗜铁素检测平板上,将活化的待测菌穿刺接种于平板上。28℃培养48 h后测量菌落外围黄色晕圈的大小。

图2 拮抗细菌对水稻纹枯病菌的抑菌活性Fig.2.Inhibition abilities of antagonistic bacteria to R.solani.
1.6 数据分析
采用统计软件DPS 6.55统计软件中的LSD多重比较法对数据进行差异显著性分析。
2 结果与分析
2.1 对水稻纹枯病的防效测定
温室盆栽试验结果表明,对照的病情指数为85.80,其次为HTC-5、10-3、12-4、HTC-1,病情指数分别为74.90、71.62、69.14、68.31,菌株7-5、4-74、4-78、W10病情指数较低,分别为26.34、25.27、21.85、20.99,可见菌株7-5、4-74、4-78与W10防病效果接近,防效均达到60%以上,且与对照差异极显著。
2.2 抑菌谱测定
以供试的7种病原真菌为指示菌,检测菌株7-5、4-74、4-78的抑菌谱。结果表明,4-74与4-78仅对水稻纹枯病菌有较强的抑菌能力,而菌株7-5的抑菌谱广,对多种病原真菌均有不同程度的拮抗效果,尤其对水稻纹枯病菌和桃褐腐病菌拮抗能力最强,抑菌圈带宽分别为1.27 cm和1.24 cm,其次是草莓灰霉病菌、稻瘟病菌、辣椒疫霉病菌和油菜菌核病菌,抑菌圈带宽分别为0.96、0.95、0.88和0.79 cm。因此,后续的研究主要围绕菌株7-5开展。
2.3 菌株7-5的鉴定
PCR扩增产物片段经测序拼接后大小为1.3 kb。将获得序列在GenBank中进行比对分析,菌株7-5与所有的绿针假单胞菌(P.chlororaphis)属细菌16S rDNA序列的相似性均为99%,系统进化树也聚成一簇(图3)。
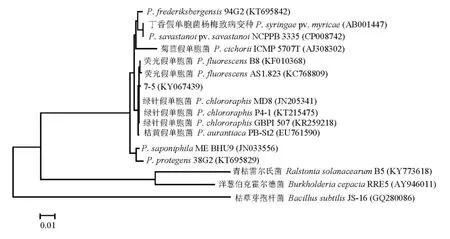
图3 拮抗细菌7-5菌株16S rDNA系统发育树Fig.3.Phylogenetic tree based on 16S rDNAsequence homology of antagonistic bacteria strain 7-5.
菌株7-5菌体杆状,菌落为黄色、光滑、边缘整齐、稍凸起。革兰氏染色阴性,能运动,不能水解淀粉,在4℃下可生长,41℃下不能生长,可产生能扩散的色素,可液化明胶,氧化酶、脂酶、精氨酸双水解酶均呈阳性,反硝化反应阴性。这些生理生化性状符合绿针假单胞菌属细菌特征。结合细菌16S rDNA序列分析结果,将其初步鉴定为绿针假单胞菌(P.chlororaphis),序列登录号为KY067439。

图4 抗生素基因的PCR检测Fig.4.PCR amplification of antibiotics gene from bacterial strain 7-5.
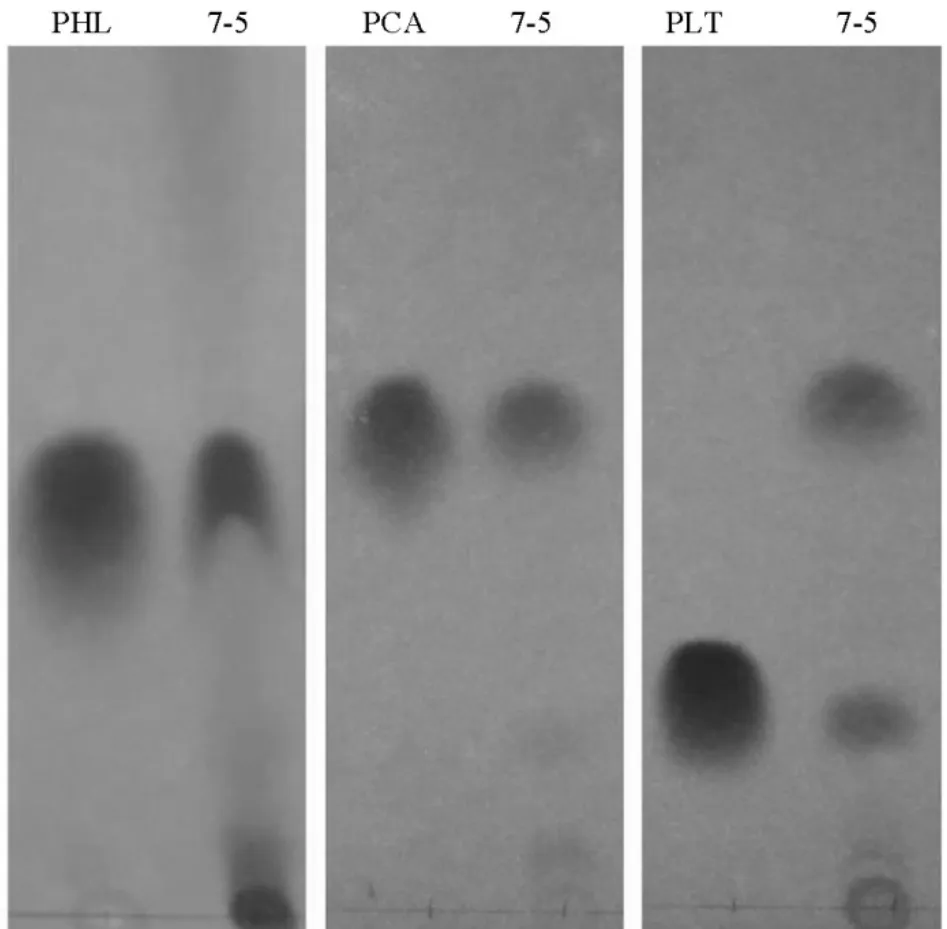
图5 7-5产生抗生素的薄层层析鉴定Fig.5.Detection of antibiotics produced by strain 7-5 through TLC.
2.4 抗菌物质的检测
抗生素合成基因PCR扩增结果显示,菌株7-5基因组中可扩增到720 bp的prn基因、750 bpphl基因、450 bpplt基因和1400 bppca基因,且4种抗生素的阳性对照菌株均可扩增到目的片段,而阴性对照菌株未检测到,说明该细菌可能产生硝吡咯菌素、吩嗪-1-羧酸,2,4-二乙酰基间苯三酚和藤黄绿脓菌素(图4)。以PHL、PLT和PCA纯品为标准品,将提取的抗生素进行薄层层析,层析结果进一步证实绿针假单胞菌7-5可产生上述三种抗生素(图5)。以荧光假单胞菌FD6产生的硝吡咯菌素作为参照进行薄层层析,结果表明尽管7-5基因组含有720 bp的prnC基因,但并没有检测到该物质(数据未显示)。解淀粉芽胞杆菌W10基因组中均不能扩增到上述四种抗生素合成相关基因。
2.5 拮抗细菌7-5的代谢分泌物
绿针假单胞菌7-5除产生多种抗生素以外,还可以产生氢氰酸和蛋白酶等抗菌代谢物,其中嗜铁素黄色透明圈半径仅为0.2 cm,而蛋白酶透明圈半径为0.8 cm,不产生几丁质酶和纤维素酶。
3 讨论
近年来,随着化学药剂的大量使用,其不仅破坏生态环境,而且危害人类健康。因此,越来越多的科研工作者将研究方向转向开发研制新型无毒副作用且绿色环保的生物农药。从许多植物根围分离到的假单胞菌如绿针假单胞菌(P.chlororaphis)、P.protegens和荧光假单胞菌(P.fluorescens)抑菌谱广,对植物病原真菌、细菌和线虫都有拮抗能力[10]。P.chlororaphis7-5分离自内蒙古黄瓜根围土壤,研究结果表明该细菌作用谱广,尤其对水稻纹枯病防病效果好,具有应用前景。许多微生物产生的抗菌物质对真菌菌丝形态有明显破坏作用。如P.chlororaphisCY02处理水稻稻瘟病菌后,导致分生孢子干瘪畸形,菌丝肿胀,隔膜不清晰[22]。假紫色色杆菌的菌株发酵液处理纹枯菌菌丝后,菌丝变形扭曲,萎缩并局部肿胀[5]。本研究发现经菌株7-5处理后的病菌菌丝形态未出现异常,说明7-5对病原真菌的作用方式与CY02不同。
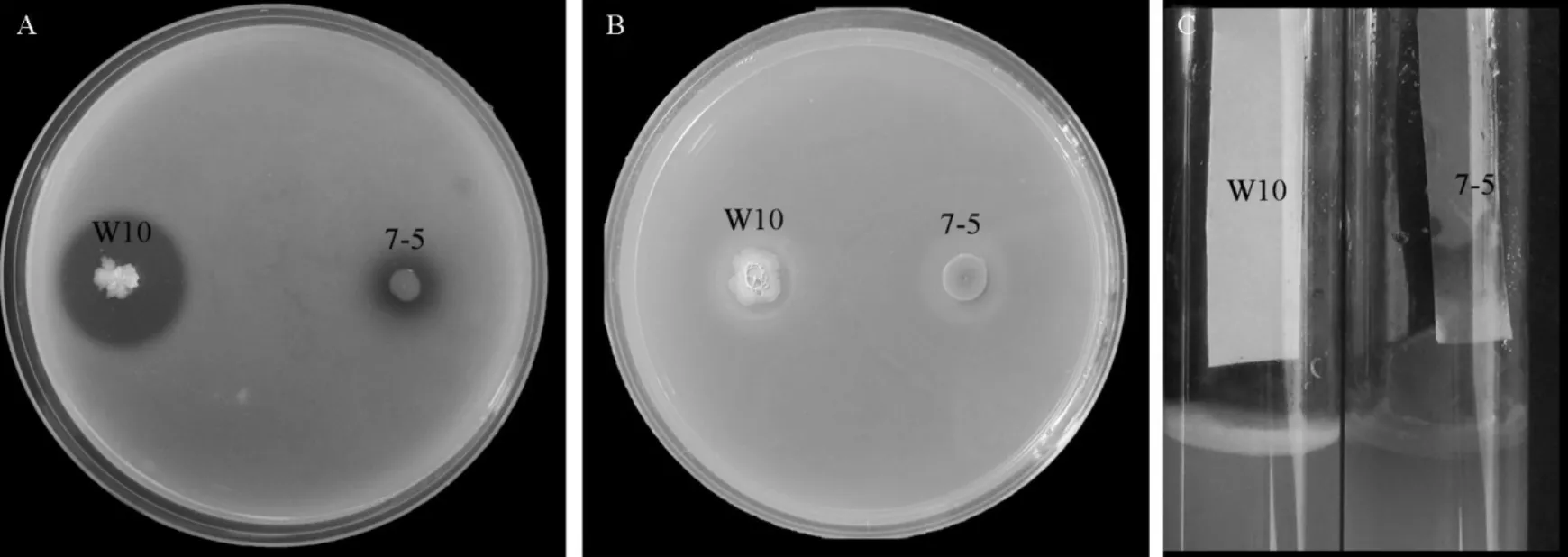
图6 7-5产生代谢分泌物鉴定Fig.6.Assay of antifungal compounds produced by strain 7-5.
抗生素通常被认为是假单胞菌产生的最重要抗菌物质,在植物病害生物防治中起主导作用。如绿针假单胞菌Pcho10主要通过产生吩嗪-1-甲酰胺有效防治小麦赤霉病[23];绿针假单胞菌PCL1606可以产生抗生素2-己基-5-丙基间苯二酚抑制许多土传病原真菌生长[24]。其中,有些菌株已开发为商用生防产品,如瑞士BioAgriAB公司研制的基于绿针假单胞菌的生防药剂Cedomon,主要用于大麦和燕麦种子处理,可防治苗期多种真菌病害[25];上海交通大学与上海农乐生物制品股份有限公司联合研制的申嗪霉素,有效成分为吩嗪-1-羧酸,2011年已被中国农业部登记为人工合成的生物杀菌剂,主要防治西瓜枯萎病和甜椒疫病[26]。本研究结果显示,7-5也可产生多种抗菌物质,包括吩嗪-1-羧酸,2,4-二乙酰基间苯三酚和藤黄绿脓菌素、氢氰酸、嗜铁素和蛋白酶,不产生纤维素酶和几丁质酶。而Nagarajkumar等[27]从水稻根际土壤中分离的荧光假单胞菌PfMDU2对纹枯病菌的拮抗活性与β-1,3-葡聚糖酶、水杨酸和氢氰酸的水平关系密切。2,4-二乙酰基间苯三酚、藤黄绿脓菌素和吩嗪-1-羧酸都是广谱抗生素,对许多植物病原真菌、细菌都有抑菌活性。其中,藤黄绿脓菌素尤其对卵菌纲真菌引起的病害防病效果好。尽管这些抗生素已经进行多年研究,但人们对它们作用的机制并不完全清楚。Kwak等以Saccharomyces cerevisiae为指示菌,筛选对抗生素PHL敏感的缺失突变体文库,研究结果证实PHL可影响细胞膜的功能、活性氧调控及细胞内稳态等多个基本的细胞进程[28]。吩嗪抗生素是核黄素辅酶的类似物,它可抑制电子传递,并对许多动物细胞有毒性作用。同时具有氢氧根离子的吩嗪可破坏类脂和其他一些高分子化合物。PCA可通过诱导Aspergillus fumigatus活性氧的产生,尤其是超O2-·、RNS和ONOO-,抑制真菌生长[29]。菌株7-5可产生上述三种广谱抗生素,究竟是单一抗生素抑制纹枯病菌还是三种抗生素复合起作用仍需进一步研究。
[1]Pan X B,Zou H J,Chen Z X,Lu J F,Yu H X,Li H T,Wang Z B,Pan X Y,Rush MC,Zhu L H.Tagging major quantitative trait loci for sheath blight resistance in a rice variety Jasmine85.ChinSciBull,1999,44(19):1783-1789.
[2]杨媚,杨迎青,李明海,舒灿伟,周而勋.井冈霉素对水稻纹枯病菌生长发育的影响.华中农业大学学报,2012,31(4):313-317.Yang M,Yang Y Q,Li M H,Shu C W,Zhou E X.Effects of Jinggangmycin on the growth and development of rice sheath blight.J Huazhong Agric Univ,2012,31(4):313-317(in Chinese with English abstract)
[3]魏赛金,杜亚楠,李昆太,涂国全,潘晓华.稠李链霉菌JAU4234代谢产物对水稻纹枯病菌的作用机制.植物保护学报,2012,39(5):411-417.Wei S J,Du Y N,Li K T,Tu G Q,Pan X H.Effect of metabolin fromStreptomyces padanusJAU4234 againstRhizoctonia solani.J Plant Prot,2012,39(5):411-417(in Chinese with English abstract)
[4]Duan G F,Zhang Z B,Zhang J P,Zhou Y J,Yu L Q,Yuan Q S.Evaluation of crude toxin and metabolite produced byHelminthosporium gramineumRabenh for the control of rice sheath blight in paddy fields.Crop Prot,2007,26:1036-1041.
[5]谢宗华,高健,王金宇,彭喜旭,唐新科,王海华.一株水稻纹枯菌拮抗细菌的分离与鉴定.微生物学通报,2012,39(4):477-485.Xie Z H,Gao J,Wang J Y,Peng X X,Tang X K,Wang H H.Isolation and identification ofan antagonistic bacterium againstRhizoctonia solani,the causing agent of rice sheath blight.Microbiol China,2012,39(4):477-485(in Chinese with English abstract)
[6]陈刘军,俞仪阳,王超,柯红娇,刘红霞,郭坚华.蜡质芽胞杆菌AR156防治水稻纹枯病机理初探.中国生物防治学报,2014,30(1):107-112.Chen L J,Yu Y Y,Wang C,Ke H J,Liu H X,Guo J H.Preliminary research of mechanisms underlyingBacillus cereusAR156-mediated resistance toRhizoctonia solaniin rice.Chin J Biol Control,2014,30(1):107-112(in Chinese with English abstract)
[7]Singh U B,Malviya D,Wasiullah,Singh S,Pradhan J K,Singh B P,Roy M,Imram M,Pathak N,Baisyal B M,Rai J P,Sarma B K,Singh R K,Sharma P K,Kaur S D,Manna M C,Sharma S K,Sharma A K.Bio-protective microbial agents from rhizosphere eco-systems trigger plant defense responses provide protection against sheath blight disease in rice(Oryza sativaL.).Microbiol Res,2016,192:300-312.
[8]陈思宇,陈志宜,张荣胜.水稻纹枯病菌拮抗细菌的筛选及鉴定.植物保护学报,2013,40(3):211-218.Chen S Y,Chen Z Y,Zhang R S.Screening and evaluation of antagonistic bacteria againstRhizoctonia solani.J Plant Prot,2013,40(3):211-218(in Chinese with English abstract)
[9]严婉荣,赵廷昌,肖彤斌,肖敏,赵志祥,陈绵才.生防细菌在植物病害防治中的应用.基因组学与应用生物学,2013,32(4):533-539.Yan W R,Zhao T C,Xiao D B,Xiao M,Zhao Z X,Chen M C.Applications of biocontrol bacteria in plant disease control.Genom Appl Biol,2013,32(4):533-539(in Chinese with English abstract)
[10]张力群,张俊威.假单胞菌产生的抗生素.中国生物防治学报,2015,31(5):750-756.Zhang L Q,Zhang J W.Antibiotics produced byPseudomonasspp..Chin J Biol Control,2015,31(5):750-756(in Chinese with English abstract)
[11]Yu YY,Jiang C H,Wang C,Chen L J,Li H Y,Xu Q,Guo J H.An improved strategy for stable biocontrol agents selecting to controlrice sheath blightcaused byRhizoctonia solani.Microbiol Res,2017,203:1-9.
[12]东秀珠,蔡妙英.常见细菌系统鉴定手册.北京:科学出版社,2001:166-169.
[13]张清霞,李世俊,徐敬友,纪兆林,陈夕军,童蕴慧.中华根瘤菌L03几丁质酶纯化及其酶学性质研究.中国生物防治学报,2011,27(2):241-245.Zhang Q X,Li S J,Xu J Y,Ji Z L,Chen X J,Tong Y H.Purification and characterization of chitinase produced bySinorhizobiumsp.Strain L03.Chin J Biol Control,2011,27(2):241-245.(in Chinese with English abstract)
[14]Reimmann C,Beyeler M,Latifi A,Winteler H,Foglino M,Lazdunski A,Haas D.The global activator GacA ofPseudomonas aeruginosaPAO positively controls the production oftheautoinducerN-butyryl-homoserine lactone and the formation of the virulence factors pyocyanin,cyanide and lipase.Mol Microbiol,1997,24(2):309-319.
[15]侯进慧,刘彤,李同祥.产纤维素酶菌株Pantoea ananatisP5的筛选鉴定和活性研究.徐州工程学院学报:自然科学版.2013,28(4):80-84.Hou J H,Liu D,Li T Y.Screening,identification and activity analysis of a cellulase producing strainPantoea ananatisP5.J Xuzhou Inst Technol:Nat Sci Ed,2013,28(4):80-84(in Chinese with English abstract)
[16]Schwyn B,Neilands J B.Universal chemical assay for the detection and determination of siderophores.Anal Biochem,1987,160:47-56.
[17]Liu H M,Dong D X,Peng H S,Zhang X,Xu Y.Genetic diversity of phenazine- and pyoluteorin-producing pseudomonads isolated from green pepper rhizosphere.Arch Microbiol,2006,185:91-98.
[18]陈夕军,王玲,左示敏,王子斌,陈宗祥,张亚芳,鲁国东,周而勋,郭泽建,黄世文,潘学彪. 水稻纹枯病寄主-病原物互作鉴别品种与菌株的筛选.植物病理学报,2009,39(5):514-520.Chen X J,Wang L,Zuo S M,Wang Z B,Chen Z X,Zhang Y F,Lu G D,Zhou E X,Guo Z J,Huang S W,Pan X B.Screening of varieties and isolates for identifying interaction between host and pathogen of rice Sheath blight.Acta Phytopathol Sin,2009,39(5):514-520(in Chinese with English abstract)
[19]Marchesi J R,Sato T,Weightman A J,Martin T A,Fry J C,Hiom S J,Dymock D,Wade W G.Design and evaluation of useful bacterium-specific PCR primers that amplify genes coding for bacterial 16s rRNA.Appl Environ Microbiol,1998,64(2):759-799.
[20]Raaijmakers J M,Weller D M,Thomashow L S.Frequency of antibiotic-producingPseudomonasspp.in natural environments.Appl Environ Microbiol,1997,63(3):881-887.
[21]Mavrodi O V,Gardener B B M,Mavrodi D V,Bonsall RF,Weller D M,Thomashow LS.Genetic diversity of phlD from 2,4-diacetylphloroglucinol-producing f l uorescent pseudomonas spp.Phytopathology,2001,91:35-43.
[22]张望月,高健,张超,张友明,胡胜标,李岚岚,孙运军,丁学知,夏立秋.五种假单胞菌的分离鉴定及其生物活性.微生物学报,2013,53(9):957-965.Zhang W Y,Gao J,Zhang C,Zhang Y M,Hu S B,Li L L,Sun Y J,Ding X Z,Xia L Q.Isolation,identification and characterization offivePseudomonasstrains.Acta Microbiol Sin,2013,53(9):957-965(in Chinese with English abstract)
[23]Hu W Q,Gao Q X,Hamada M S,Dawood D H,Zheng J,Chen Y,Ma Z.Potential ofPseudomonas chlororaphissubsp.aurantiacastrain Pcho10 as a biocontrol agent againstFusarium graminearum.Biol Con,2014,104(12):1289-1297.
[24]Calderón C E,Vicente A D,Cazorla F M.Role of 2-hexyl,5-propyl resorcinol production byPseudomonas chlororaphisPCL1606 in the multitrophic interactions in the avocado rhizosphere during the biocontrol process.Fems Microbiol Ecol,2014,89(1):20-31.
[25]LatourX,DelormeS,Mirleau P,Lemanceau P.Identification of traits implicated in the rhizosphere competence of fluorescent pseudomonads:description of a strategy based on population and model strain studies.Biom Life Sci,2009,3:285-296.
[26]Du X L,Li Y Q,Zhou W P,Zhou Q,Liu H M,Xu Y Q.Phenazine-1-carboxulic acid production in a chromosomally non-scar tripe-deleted mutantPseudomonas aeruginosausing statistical experimental designs to optimize yield.Appl Microbiol Biotechnol,2013,97:7767-7778.
[27]Nagarajkumar M, Bhaskaran R, Velazhahan R.Involvement of secondary metabolites and extracellular lytic enzymes produced byPseudomonas fluorescensin inhibition ofRhizoctonia solani,the rice sheath blight pathogen.Microbiol Res,2004,159:73-81.
[28]Kwak Y,Han S,Thomashow L S,Rice J T,Paulitz T C,Kim D,WellerD M.Saccharomyces cerevisiaegenome-wide mutant screen for sensitivity to 2,4-diacetylphloroglucinol,an antibiotic produced byPseudomonas fluorescens.Appl Environ Microbiol,2011,77(5):1770-1776.
[29]Briard B,Bomme P,Lechner B E,Mislin G,Lair V,Prevost M,Latge J,Haas H,Beauvais A.Pseudomonas aeruginosamanipulates redox and iron homeostasis of its microbiota partnerAspergillus fumigatusvia phenazines.Scient Rep,2015,5(2):8220.
