大鲵体表黏液透明质酸提取及其抗氧化活性的研究
2018-05-25于海慧佟长青
于海慧,李 伟,佟长青
(大连海洋大学食品科学与工程学院,辽宁大连 116023)
0 引言
大鲵具有极高的经济价值,随着水生野生动物特许利用政策的出台,养殖大鲵在我国各地得到普遍推广,逐渐成为一种极具市场前景的新兴养殖品种[1-2]。大鲵真皮内分布有大量的多细胞腺体,主要为黏液腺和颗粒腺,其中黏液腺遍布全身,可分泌出大量的湿滑黏液。陈德经等人[3]采用水提取、碱提取、酸提取和酶提取等方法,从大鲵黏液中提取出粗多糖,其单糖组分为甘露糖、葡萄糖醛酸、半乳糖醛酸、氨基葡萄糖、葡萄糖、半乳糖。葡萄糖醛酸和氨基葡萄糖为透明质酸(Hyaluronic acid,HA)的组成单元。因此,大鲵皮肤及其黏液是透明质酸的潜在来源。不同来源的纯的HA结构完全相同,仅在相对分子量大小上存在差异,具有良好的生物相容性,作为一种可吸收、可降解的生物材料,已在药物、化妆品等领域有着广泛的应用[4]。
自由基具有极强的氧化性,生物体生化反应常常会导致自由基的产生[5],进而造成重要的生物大分子的损伤,使机体承担患病风险[6]。关于透明质酸抗氧化作用的相关报道已有很多。例如,李密等人[7]从乌贼眼中提取出的HA-1和HA-2,在质量浓度为1~5 mg/mL时,随着质量浓度的增加,其清除·OH和DPPH·的能力也增强。于乐惠等人[8]监测了关节腔内注射透明质酸钠4周后患者关节液中超氧化物歧化酶(SOD) 和丙二醛(MDA) 含量的变化,发现SOD含量明显上升,MDA含量明显下降(p<0.05或p<0.01)。冯宁等人[9]研究了口服HA后血清SOD活性,发现HA具有体内抗氧化作用。
以往对大鲵的研究,主要集中在肉、皮的粗加工和酶解获取活性肽等,而对从大鲵中提取HA及其抗氧化活性的研究报道较少。以大鲵体表黏液为原料,进行大鲵体表黏液中透明质酸提取工艺研究,同时对大鲵体表黏液透明质酸进行体外抗氧化评价,以期更好地利用大鲵资源,为大鲵深加工提供重要的基础数据。
1 材料与方法
1.1 材料与试剂
大鲵黏液,张家界(中国)金驰大鲵生物科技有限公司提供;TSK-gel G4000 PWXL型色谱柱,日本TOSOH公司提供;2,2-二苯基-1-苦肼基自由基(2,2-diphenyl-1-picrylhydrazyl,DPPH·) (AR)、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2'-Azino-bis(3-ethylbenzthiazoline-6-sulphonic acid) diammonium salt,ABTS) (AR),美国 Sigma公司提供;DEAE-纤维素DE-52,北京索莱宝科技有限公司提供;胰蛋白酶,上海阿拉丁生化科技股份有限公司提供;其他试剂为国产分析纯。
1.2 试验方法
1.2.1 大鲵黏液预处理
冷冻保藏的大鲵黏液解冻后,加入生理盐水(1∶2,m/V),匀浆后备用。
1.2.2 酶解提取透明质酸的方法
匀浆后的大鲵黏液,调节溶液pH值,加入蛋白酶酶解,酶解后于100℃条件下处理5 min。冷却至室温后,以转速9 000 r/min离心15 min,上清液加入2倍体积95%的乙醇,于3℃条件下沉淀24 h。沉淀用0.1 mol/L NaCl溶解,调pH值至4.5,加入1/4体积氯仿/正丁醇(4∶1,V/V) 混合液除蛋白3次。上清液加入2倍体积的95%乙醇,于3℃条件下静置12 h后离心,沉淀以蒸馏水溶解,冷冻干燥,得大鲵透明质酸粗提物。
1.2.3 DE-52分离透明质酸
以去离子水洗脱DEAE-纤维素DE-52柱(φ15×150)至平衡。将5.0 mg/mL的大鲵透明质酸粗提物溶液通过孔径0.45μm针筒式无机膜过滤后,取2.0 mL滤液上样,以1 mL/min去离子水洗脱,40管后,以0~1 mol/L NaCl进行梯度洗脱。以间羟基联苯法[10]和苯酚-硫酸法分别检测各接收管溶液中葡萄糖醛酸、总糖量,收集葡萄糖醛酸/总糖为35%~48%洗脱液,透析冻干,得到纯化后的大鲵HA样品。
1.2.4 HA得率的测定
HA得率(湿基)计算公式如下:
HA得率=葡萄糖醛酸质量/0.483 8/大鲵黏液质量×100%.
1.2.5 透明质酸性质
将干燥的HA样品与KBr混匀后压片,并通过Frontier FT-IR光谱仪(Perkin-Elmer) 测定样品的FT-IR光谱。
HA样品以D2O溶解,样品质量浓度为20 mg/mL,于25~28℃,500 MHz条件下,在Varian Unity 500核磁共振谱仪上进行13CNMR检测。
使用双蒸水配制5 mg/mL分子量分别为10 000,70 000,500 000,2 000 000 Da的标准葡聚糖溶液和大鲵HA溶液,以孔径0.45μm无机膜过滤后,使用TSK-gel G4000 PWXL色谱柱,通过高效液相色谱仪,以0.6 mL/min双蒸水洗脱,以标准葡聚糖绘制标准曲线,并计算大鲵HA分子量。
1.2.6 抗氧化活性测定
DPPH·清除能力测定采用Cotelle N等人[11]的方法,·OH清除能力测定采用赵翾等人[12]的方法,ABTS+·清除能力测定采用Miller N等人[13]的方法,还原力测定采用Hinneburg I等人[14]的方法。
2 结果与分析
2.1 酶添加量、酶解pH值、酶解温度和酶解时间对大鲵HA得率的影响
胰蛋白酶添加量、酶解pH值、酶解温度和酶解时间对大鲵HA得率的影响见图1。
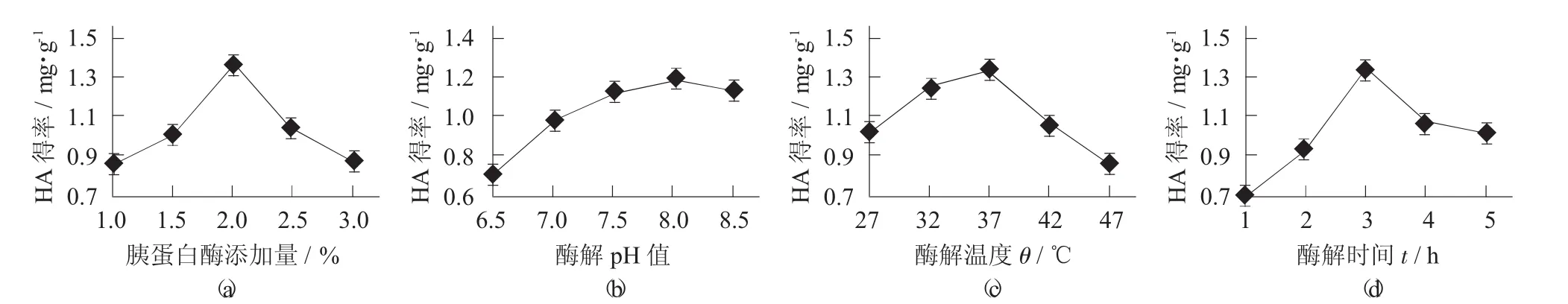
图1 胰蛋白酶添加量、酶解pH值、酶解温度和酶解时间对大鲵HA得率的影响
由图1(a)可知,随着胰蛋白酶添加量的增加,HA得率也随之增加,这是因为酶添加量的增加会增大其相互作用的接触面积,也就使酶解速率加快。当酶添加量为2%时,HA得率达到最大值,但酶添加量继续增加时HA得率反而减少。由图1(b) 可知,随酶解pH值的增加HA得率也逐渐增加,当pH值为8时HA得率最大,这是由于在pH值8时,胰蛋白酶处于一种解离状态,最有利于与大鲵黏液中蛋白质的结合并发生催化作用,活力最高。随着pH值继续增加HA得率逐渐减少,可能是由于溶液碱性过大而破坏HA的稳定性。由图1(c)可知,HA得率会随着酶解温度的升高而逐渐升高,这是由于温度的升高可以增加反应速率,当酶解温度为37℃,HA得率达到最大值,当温度继续增加时,HA得率逐渐下降。从图1(d) 可以看出,随着酶解时间的增加,HA得率出现先升高后降低的趋势,在3 h时,HA得率为最大值。这可能是由于时间过长,使透明质酸被降解。
2.2 最佳提取工艺的优化
根据单因素试验的结果,在pH值8.0时,考查酶解时间、酶解温度、酶添加量3个因素对HA得率的影响,并在单因素试验的基础上设计L9(34)正交试验。
正交试验结果见表1,显著性检验见表2。

表1 正交试验结果
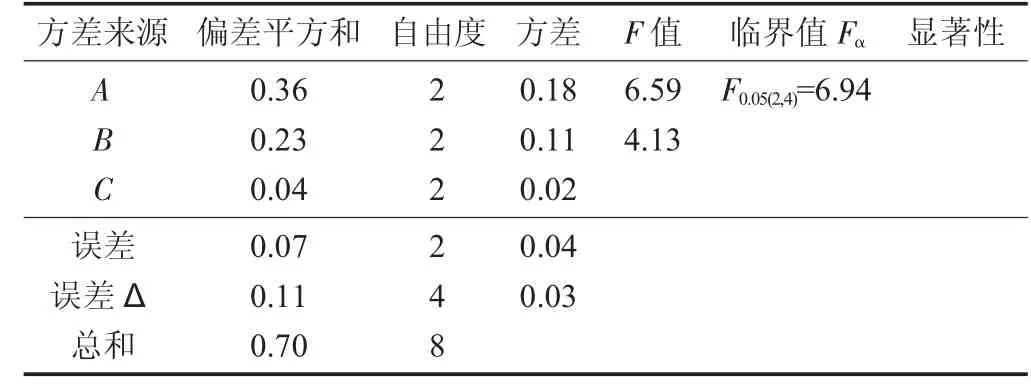
表2 显著性检验
极差分析结果表明,正交试验中最佳因素组合为A3B2C1,即酶解时间4 h,酶解温度37℃,酶添加量1.5%。显著性检验结果表明,酶添加量对于大鲵HA得率影响小,作为误差项,而酶解温度和酶解时间影响较大,但不显著。
2.3 大鲵透明质酸粗提物纯化
大鲵黏液透明质酸DE-52阴离子交换层析见图2。

图2 大鲵黏液透明质酸DE-52阴离子交换层析
由图2可以看出,在以0~1 mol/L NaCl进行洗脱时,总糖曲线有2个主要峰。这2个峰的葡萄糖醛酸占总糖分别为44.76%和12.94%。100 mg透明质酸完全水解,可以得到48.38 mg葡萄糖醛酸,因此,粗大鲵透明质酸经DE-52分离后,收集梯度洗脱第1个峰,经透析冻干后,得到的透明质酸相对较纯。
2.4 大鲵HA性质
大鲵HA的FT-IR见图3。

图3 大鲵HA的FT-IR
由图3可以看出,在波数3 400~3 230 cm-1有较强的吸收峰,峰值处于3 319 cm-1,为醇羟基的O-H伸缩振动特征峰,在1 171 cm-1处的吸收峰为醇羟基的C-OH伸缩振动特征峰,在波数3 570~3 050 cm-1出现了宽的吸收带,表明存在多个O-H伸缩振动吸收峰的叠加,表明存在多个醇羟基;在波数1 420~1 390 cm-1的吸收峰峰值处于1 396 cm-1,为羧基的对称伸缩峰;在波数1 560~1 530 cm-1处有强吸收峰,主要为仲酰胺R1-NH-CO-R2中NH面内变角振动;在波数1 239 cm-1的吸收峰为仲酰胺R1-NH-CO-R2的特征吸收峰,即酰胺III吸收带,为C-N伸缩振动特征峰,表明存在仲酰胺基团。与标准物质透明质酸钠相比,大鲵HA各基团出峰位置基本一致,这与阴离子柱DE-52结果(即葡萄糖醛酸占总糖44.76%)一致,也说明了所提取到的为较纯的大鲵透明质酸。
大鲵HA13C-NMR见图4。

图4 大鲵HA13C-NMR
δ100.2×10-6为异头碳信号,δ55.34×10-6为C2信号,δ84.75×10-6为C3信号,δ70.29×10-6为C4信号,δ76.41×10-6为C5信号,δ61.34×10-6为 C6信号,δ174.83×10-6反映 C=O信号,δ24.99 ppm为CH3信号[15]。
通过HPLC,以保留时间为横坐标,以标准葡聚糖分子量的对数为纵坐标,得标准曲线Y=-0.244 1X+8.700 9(R2=0.997),进而得出大鲵HA分子量为4.85×106Da。
2.5 抗氧化活性
大鲵透明质酸清除DPPH·能力见图5。
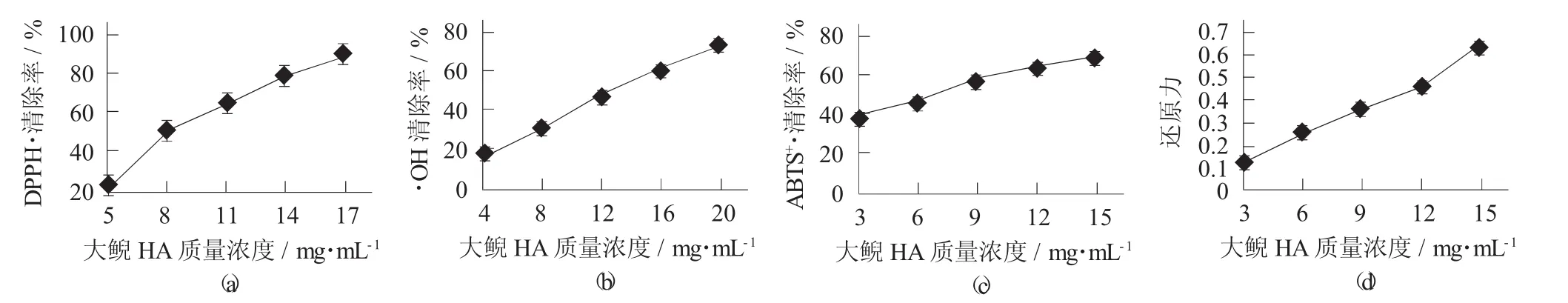
图5 大鲵透明质酸清除DPPH·能力
由图5可以看出,大鲵HA清除DPPH·,·OH,ABTS+·和还原Fe3+能力具有浓度依赖性,即随着HA质量浓度的增加而增强,其清除自由基IC50分别为8.13,12.10,7.00 mg/mL。Sadhasivam G 等人[16]发现海洋黄貂鱼(Aetobatus narinari)肝脏中分离的HA具有清除DPPH·的能力。Kanchana等人发现Amussium pleuronectus(Linnaeus,1758) 也具有清除DPPH·的能力。
3 结论
通过单因素试验和正交试验确定了从大鲵黏液中提取透明质酸的最佳工艺条件为使用胰蛋白酶,酶添加量1.5%,pH值8.0,酶解温度37℃,酶解时间4 h。在该工艺条件下,HA得率为1.704 1 mg/g,分子量约为4.85×106Da。红外光谱分析表明大鲵HA与透明质酸钠标准品的出峰位置基本一致。13C-NMR谱表明大鲵透明质酸含有异头碳。大鲵黏液透明质酸具有一定的体外抗氧化活性,能够清除DPPH·,·OH,ABTS+·和还原 Fe3+。
参考文献:
[1]刘绍,刘卉琳,周治德,等.饲养中国大鲵肝脏与肌肉中几种重要脂肪酸的测定与分析 [J].食品与机械,2009 (3):21-22,26.
[2]刘鉴毅,谭永安,卢兴孙,等.中国大鲵子二代规模化人工孵化技术的研究 [J].经济动物学报,2005(3):152-155,159.
[3]陈德经,徐伟良,苏文,等.大鲵皮肤粘液多糖的提取及单糖组成分析 [J].天然产物研究与开发,2015(10):1 700-1 705.
[4]Beer K R,Julius H,Dunn M,et al.Remodeling of periorbital, temporal, glabellar, and crow's feet areas with hyaluronic acid and botulinum toxin[J].Journal of Cosmetic Dermatology,2014,13 (2):143-150.
[5]Fan L,Zhang S,Yu L,et al.Evaluation of antioxidant property and quality of breads containing Auricularia auricula polysaccharide flour[J].Food Chemistry,2007 (3):1 158-1 163.
[6]许海顺,蒋剑平,徐攀,等.红参多糖抗氧化活性的研究 [J].浙江中医药大学学报,2011(6):909-912.
[7]李密,李和生,张丽媛,等.乌贼眼透明质酸的体外抗氧化性及对小鼠创愈性质的研究 [J].中国食品学报,2017 (10):30-36.
[8]于乐惠,郑锦辉.透明质酸联合加味阳和汤对膝骨性关节炎患者脂质过氧化损伤的保护作用 [J].中国现代医生,2017(21):118-120,127.
[9]冯宁,石艳丽,郭风仙,等.口服透明质酸对皮肤水分的改善作用及体内抗氧化作用研究 [J].食品与药品,2016 (6):386-390.
[10]Blumenkrantz N,Asboe-Hansen G.New method for quantitative determination of uronic acids[J].Analytical Biochemistry,1973,54 (2):484-489.
[11]Cotelle N,Bernier J L,Catteau J P,et al.Antioxidant properties of hydroxy-flavones[J].Free Radical Biology&Medicine,1996,20 (1):35-43.
[12]赵翾,李红良,叶倩雯.芡实多糖的粗提取及其对羟自由基的清除效果 [J].食品与发酵工业,2010,36(11):177-182.
[13]Miller N, Riceevans C, Davies M J, et al.A novel method for measuring antioxidant capacity and its application to monitoring the antioxidant status in premature neonates[J].Clinical Science,1993 (4):407-412.
[14]Hinneburg I,Damien Dorman H J,Hiltunen R.Antioxidant activities of extracts from selected culinary herbs and spices[J].Food Chemistry,2006(1):122-129.
[15]Bociek SM,Darke A H,Welti D,et al.The 13C-NMR spectra of hyaluronate and chondroitin sulphates[J].European Journal of Biochemistry,1980 (2):447-456.
[16]Sadhasivam G, Muthuvel A, Pachaiyappan A, et al.Isolation and characterization of hyaluronic acid from the liver of marine stingray Aetobatus narinari[J].International Journal of Biological Macromolecules,2013 (3):84-89.◇
