TLR4信号通路介导DIO 小鼠脂肪局部RAS激活机制
2018-05-24王梅麦旭东邓兴锋孙嘉陈宏
王梅 麦旭东 邓兴锋 孙嘉 陈宏
南方医科大学珠江医院1呼吸内科,2内分泌科,3消化内科(广州 510280)
慢性炎症是肥胖导致动脉硬化、糖尿病、脂肪肝等疾病的主要因素,脂肪细胞是肥胖致炎作用的主要途径[1]。肾脏、心脏、脂肪组织等许多组织部位存在肾素-血管紧张素系统(renin-angiotensin system,RAS)成分,包括肾素、血管紧张素原(angiotensinogen,AGT)、血管紧张素转换酶(angiotensin converting enzyme,ACE)和血管紧张素Ⅰ(angiotensinⅠ,AngⅠ)、血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)[2-3]。脂肪组织存在局部RAS系统,参与局部组织的炎症反应,但活体肥胖状态下激活脂肪组织局部RAS系统的确切机制尚未明确。
Toll样受体4(Toll like receptor4,TLR4)是Toll样受体(Toll like receptor,TLRs)家族中的一员,是一种病原相关模块识别受体。TLR4可以与配体结合后激活丝裂原活化蛋白激酶和核因子κB(nuclear factorκB,NF-κB)介导炎症反应相关通路[4-6]。在细胞水平研究中有证据表明肝细胞中存在TLR4和血管紧张素Ⅱ相互作用,并参与肝脏炎症的发生[7],而心肌细胞中激活TLR4信号通路可激活RAS[8]。脂肪细胞RAS系统研究中,细胞水平研究证实3T3-L1脂肪细胞存在TLR4通路并且能被脂多糖(lipopolysaccharide,LPS)所激活[9-10]。本研究选取6周龄雄性C57BL/6小鼠高脂饮食喂养14周构建DIO小鼠动物模型,予TLR4阻断剂 TAK-242(Resatorvid),非诺贝特(fenofibrate)分别治疗DIO小鼠,检测小鼠皮下脂肪的RAS成份、TLR4受体表达情况,在动物水平探讨TLR4信号通路与脂肪组织局部RAS激活的可能机制。
1 材料与方法
1.1 材料
1.1.1 动物 6周龄雄性C57BL/6小鼠33只,购自南方医科大学动物实验中心(合格证编号为:NO.44002100005087),体重(17.2 ± 0.3)g,饲养条件:在恒定的温度(24℃)和12 h光/暗周期的SPF(specific pathogen free)动物级实验室(南方医科大学,广州)。
1.1.2 试剂和仪器 高脂饲料(MD12033)购于江苏美迪森生物医药有限公司;普通饲料购于南方医科大学动物实验中心;非诺贝特(fenofibrate)购于法国利博福尼制药公司;TAK-242(Resatorvid)购于上海皓元生物医药科技有限公司);试剂盒:RNAiso Reagent(TaKaRa,Janpan),ELISA Kit(TaKaRa,Janpan);引物购于上海生工生物工程有限公司;磷酸盐缓冲液(PBS),油红O染料购于美国sigma公司;全自动生化分析仪(深圳市库贝尔生物科技有限公司)。其余试剂为分析纯。
1.2 方法
1.2.1 建立饮食诱导肥胖小鼠模型及药物治疗6周龄雄性C57BL/6小鼠适应性喂养正常饲料1周后,分为正常饮食组(normal diet,ND,n=5)和高脂饮食组(high-fat diet,HFD,n=28),喂养14周,每周称重。正常饮食包含20%kcal来源于脂肪,60%kcal来源于蛋白质,20%kcal来源于碳水化合物。高脂饮食主要包含60%kcal来源于脂肪,20%kcal来源于蛋白质,20%kcal来源于碳水化合物。21周龄时选定体重超过正常饮食组平均体重20%的小鼠为肥胖小鼠。将符合要求的小鼠重新随机分为肥胖空白组(obesity,OB,n=5),非诺贝特治疗组(fenofibrate,FF,n=5)、TAK-242治疗组(TAK-242,TAK,n=5)。FF组予100 mg/(kg·d)治疗2周,TAK组腹腔注射TAK242,3 mg/(kg·d)治疗2周。
1.2.2 生化指标测定 23周龄各组小鼠颈椎脱臼处死前禁食12 h,心脏取血,离心留取血清后,-20℃冰箱保存。采用全自动生化分析仪检测各标本的三酰甘油(triglyceride,TG),游离脂肪酸(nonesterified fatty acid,NEFA),丙氨酸氨基转移酶(alanine aminotransferase,ALT),天冬氨酸氨基转移酶(aspartate aminotransferase,AST)。
1.2.3 ELISA法检测游离脂肪酸 小鼠处死后小心切除皮下白色脂肪和肝脏,称重。取等质量肝脏组织后,按照小鼠游离脂肪酸ELISA Kit说明书的步骤用检测标本游离脂肪酸含量。
1.2.4 油红O染色观察皮下脂肪、肝脏组织切片 油红O染色法分别对脂肪组织、肝脏组织染色,并用PBS洗涤3次。再用4%的甲醛溶液固定。PBS再洗涤2次后,取适量新制的改良油红O染色剂染色30 min,显微镜下开始作动态观察。若镜下观察到脂肪滴颜色逐渐加深,呈鲜红的、大小不一的串珠样时,即可吸尽油红O染液终止染色,并用磷酸盐缓冲液小心漂洗后,加入苏木素液淡染胞核,再次予PBS漂洗,在镜下显微成像观察。
1.2.5 RT-PCR (1)细胞总RNA的抽提:按照TaKaRa公司RNAiso Reagent说明书提取总RNA,分装后置-80℃冰箱保存待用;(2)检测RNA完整性:取1.5 μL RNA样品,drop one紫外分光光度仪检测260 nm和280 nm处的OD值,OD260/280比值在1.8~2.0之间,说明RNA纯度较高;(3)逆转录反应:将1 μg模板RNA、250 μmol/L随机引物加入反应体系,按照说明书操作,将总RNA逆转录为cDNA,置-20℃冰箱保存待用;(4)RT-PCR反应设计引物:血管紧张素原基因引物上游5′-CTGCTCCAGGCTTTCGTCTA-3′,下游:5′AACTGGGTCAGTGGATAAATCC-3′;血管紧张素Ⅱ1型受体(angiotensinⅡtype 1 receptor,AT1R)基因引物:上游5′-CGGTATCCGAATCTGAATGT-3′,下游5′-GCCCCAATCCTACTGTTAGT-3′;TLR4基因引物:上游5′-ACCTGGAATGGGAGGACAAT-3′,下游 5′-GTCCAAGTTGCCGTTTCTTG-3′;GAPDH 为内参基因引物:上游:5′-GGCCTCCAAGGAGTAAGAAA-3′,下游:5′-GCCCCTCCTGTTATTATGG-3′;以逆转录反应所得cDNA为模板,用上、下游引物PCR扩增目的片段。参照说明书建立Real-time PCR反应体系,反应条件:95℃ 10 min;95℃10 s、60℃20 s,72℃ 15 s,40个循环;95℃ 15 s,55℃45 s,95℃15 s。据溶解曲线判断引物特异性,单峰说明引物特异性佳,多峰说明引物特异性差,需重新设计引物;(5)据ΔΔCT法计算基因的相对表达量。
1.2.6 统计学处理 采用IBM SPSS Statistics 22统计软件进行统计学分析,所有定量结果用均数±标准差表示。数据先进行正态检验及方差齐性检验,符合则多组间比较采用单因素方差分析的LSD法进行多重比较;不符合则多组间比较采用非参数检验的Kruskal-WallisH方法,若检验结果显著(P<0.05),再进行多组间两两比较。P<0.05认为差异有统计学意义。
2 结果
2.1 小鼠各项生理基础指标比较 OB组、FF组、TAK组各组小鼠体重、皮下脂肪重量与正常饮食组比较,有明显差异。OB组TG、血清NEFA含量较正常饮食组明显升高。予非诺贝特治疗后,FF组小鼠肝内NEFA及ALT、AST含量较OB组高,且小鼠肝脏重量显著增加,皮下脂肪质量和TG含量均较OB组明显降低,而血清NEFA含量并没有明显变化。予TAK-242治疗后,TAK组肝内NEFA含量降低,余数据无明显改变。见表1,图1。
表1 各组小鼠各项生理及代谢指标比较Tab.1 Physiological and metabolic changes of the groups ±s
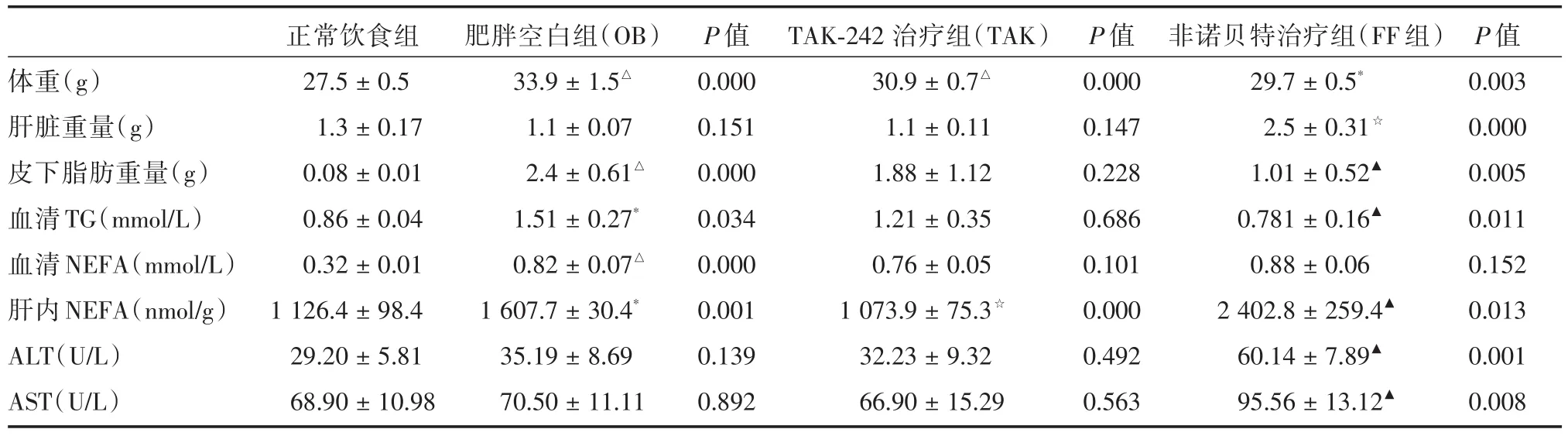
表1 各组小鼠各项生理及代谢指标比较Tab.1 Physiological and metabolic changes of the groups ±s
注:OB组、TAK组、FF组与正常饮食组比较,*P<0.05,△P<0.001;TAK组、FF组与OB组比较,▲P<0.05,☆P<0.001
体重(g)肝脏重量(g)皮下脂肪重量(g)血清TG(mmol/L)血清NEFA(mmol/L)肝内NEFA(nmol/g)ALT(U/L)AST(U/L)正常饮食组27.5±0.5 1.3±0.17 0.08±0.01 0.86±0.04 0.32±0.01 1 126.4±98.4 29.20±5.81 68.90±10.98肥胖空白组(OB)33.9±1.5△1.1±0.07 2.4±0.61△1.51±0.27*0.82±0.07△1 607.7±30.4*35.19±8.69 70.50±11.11 P值0.000 0.151 0.000 0.034 0.000 0.001 0.139 0.892 TAK-242治疗组(TAK)30.9±0.7△1.1±0.11 1.88±1.12 1.21±0.35 0.76±0.05 1 073.9±75.3☆32.23±9.32 66.90±15.29 P值0.000 0.147 0.228 0.686 0.101 0.000 0.492 0.563非诺贝特治疗组(FF组)29.7±0.5*2.5±0.31☆1.01±0.52▲0.781±0.16▲0.88±0.06 2 402.8±259.4▲60.14±7.89▲95.56±13.12▲P值0.003 0.000 0.005 0.011 0.152 0.013 0.001 0.008

图1 血清及肝脏组织中游离脂肪酸含量Fig.1 Concentration of NEFA in liver and serum
2.2 脂肪组织和肝脏组织RAS成分表达变化脂肪组织中,OB组小鼠AT1R、AGT表达量均显著高于正常饮食组,给予TAK-242药物治疗后,TAK组小鼠AT1R,AGT表达量均明显低于OB组;给予非诺贝特治疗后的FF组小鼠AT1R、AGT表达量较OB组均无明显改变。在肝脏组织中,OB组小鼠AT1R、AGT表达量对比正常饮食组升高不明显,但予TAK-242药物治疗后,能明显下调AT1R表达量;予非诺贝特组治疗后,FF组小鼠AT1R、AGT,TLR4表达量对比正常饮食组均明显升高。见图2。
2.3 脂肪组织和肝脏组织TLR4受体表达变化脂肪组织中,OB组小鼠TLR4表达量显著高于正常饮食组,予TAK-242药物治疗后,TAK组小鼠TLR4表达量显著低于OB组;给予非诺贝特治疗后的FF组小鼠TLR4表达量较OB组有下降趋势。在肝组织中,OB组小鼠TLR4表达量同样高于正常饮食组,TAK组小鼠TLR4表达量没有明显改变;而非诺贝特干预后的FF组小鼠TLR4表达量较OB组高。见图3。
2.4 脂肪组织和肝脏组织油红O染色 图4A示200×高倍视野下正常饮食组小鼠肝脏切片未见肝脏脂肪沉积,OB组小鼠肝脏可见有沉积的脂肪小滴,TAK-242组小鼠肝脏脂肪小滴略少,FF组小鼠肝脏沉积的脂肪小滴比OB组大。图4B示200×高倍视野下正常饮食组小鼠脂肪组织脂肪细胞较小,OB组与TAK组小鼠脂肪细胞明显增大,而FF组小鼠脂肪组织中脂肪细胞与OB组相比堆积较少。见图4。

图2 脂肪组织和肝脏组织RAS成分表达变化Fig.2 Expression of local rennin-angiotensin system in adipose and liver tissues

图3 脂肪组织和肝脏组织TLR4受体表达变化Fig.3 Expression of local rennin-angiotensin system in adipose and liver tissues
3 讨论
肾素-血管紧张素系统是人体内重要的体液调节系统。在心脏、血管壁、脂肪等局部组织或细胞表达的RAS称为局部RAS,RAS主要的效应分子为AngⅡ,其由AGT经过肾素、血管紧张素转换酶等催化生成,并通过旁分泌或自分泌主要结合AT1R发挥作用,并且与系统RAS相互影响,与多种疾病密切相关[5]。TLR4是一种病原相关模块识别受体,介导激活NF-κB 炎症反应相关通路[4-6]。前期研究发现脂肪细胞具有完整的RAS成分,TLR4受体激动剂LPS能够激活3T3-L1脂肪细胞的TLR4信号通路,通路激活后能够刺激脂肪细胞RAS成分表达增加分泌更多AGT和AngⅡ,预先予AT1R受体阻滞剂厄贝沙坦预处理,能阻断RAS的作用,提示LPS所致的TLR4-NF-κB的激活包含激活RAS后AngⅡ/AT1R的致炎作用[10]。活体小鼠中NEFA与胎球蛋白A(Fetuin-A,Fet-A)结合体(NEFA/Fetuin-A)是激活TLR4信号通路的关键[11]。前期研究还发现3T3-L1脂肪细胞在Fet-A存在的前提下,NEFA中的棕榈酸(palmitic acid,PA)能够上调表达AngⅡ、AGT、AT1R,并且该作用能被TLR4阻断剂TAK-242和NF-κB阻断剂BAY117082所抑制,证实NEFA/TLR4-NF-κB信号通路是脂肪组织局部RAS激活的重要信号通路[12]。
我们研究发现,C57BL/6小鼠喂养高脂饲料14周后,小鼠整体表现出DIO的特点:体重明显增加,高甘油三脂血症,高游离脂肪酸血症,皮下脂肪大量堆积,肝脏脂肪含量增加。在肥胖的状态下,未经药物治疗的小鼠脂肪组织的AGT、AT1R、TLR4 mRNA均明显高于正常饮食对照组,RAS成分AGT、AT1R和TLR4受体表达量升高,说明肥胖可导致RAS系统成分高表达[13],活体小鼠脂肪组织存在局部肾素-血管紧张素系统,并可在肥胖状态下被激活。
肥胖小鼠脂肪中RAS成分及TLR4受体表达量确有升高,激活TLR4信号通路可能从配体及受体两方面同时影响脂肪组织RAS,但两者相互作用如何,需要进一步证实。TLR4受体抑制剂TAK-242是一种TLR4信号通路小分子抑制剂,通过cys747结合TLR4胞内段TIR结构域而发挥作用[14-15]。予TAK组小鼠腹腔注射TAK-242 3 mg/(kg·d)持续治疗2周后,AGT、AT1R、TLR4表达量均明显降低。说明TLR4阻断剂可能一方面直接阻断TLR4配体受体结合作用,阻断TLR4通路,另一方面可能通过抑制TLR4受体表达量,从而下调RAS成分的表达。我们首次在动物实验上发现阻断TLR4配体受体结合作用是下调脂肪组织局部RAS成分表达的关键。

图4 脂肪组织和肝脏组织油红O染色(×200)Fig.4 Oil-Red-O staining of liver and adipose tissues
研究表明过氧化物酶增殖体激活受体α(PPARα)基因能负向调节TLR4受体表达[16]。激活PPARα,调节血脂TG、NEFA可能影响TLR4信号通路,从而影响RAS成分的表达。非诺贝特是氯贝丁酸衍生物类血脂调节药,通过激活PPARα,激活脂解酶和减少载脂蛋白CIII合成,使血浆中脂肪降解和三酰甘油清除明显增加。我们发现FF组小鼠TG明显降低,而血清中NEFA并没有明显下降,这可能与药物增加脂肪组织中脂质氧化酶相关基因的表达相关[17]。在脂肪组织中,TLR4受体表达量有下降趋势,然而RAS成分AGT、AT1R并没有明显改变,说明在脂肪组织中通过激活PPARα从而抑制TLR4受体表达量对RAS成分表达作用并不明显。
皮下脂肪和内脏脂肪组织具有不同的分子、细胞和解剖特征[18],同时肝脏是体内脂肪代谢重要枢纽。有研究表明TLR4-RAS参与肝脏炎症的发生[5],且在高脂饮食诱导的非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)模型小鼠发现肝脏中TLRs受体通过NF-κB通路,上调TNF-α等炎症因子[19]。因此我们还观察小鼠药物治疗后肝脏组织中局部RAS成分变化。小鼠肝脏组织RAS成分及TLR4受体均有所升高,予TLR4阻断剂治疗后,除AT1R表达量下调外,AGT、TLR4无明显改变。此外,非诺贝特干预后肝内NEFA的含量增加,AGT、AT1R、TLR4表达量亦增加。说明肝组织内RAS成分激活途径与皮下脂肪组织激活途径可能不同,非诺贝特可能通过增加NEFA与Fet-A结合体该配体的含量,影响肝脏组织中局部RAS成分表达,但具体机制仍需进一步探究。
本研究首次利用TLR4抑制剂(TAK-242,Resatorvid)在动物水平探讨局部RAS成分激活与TLR4/NF-κB信号通路的关系,为脂肪组织局部RAS与相关疾病关系的动物水平研究提供依据。但是本研究局限于单一的Toll样受体及信号通路,未从多方面多通路探讨TLRs与脂肪组织局部RAS激活的作用机制。本课题拟下一步实验中,进一步探讨RAS成分激活与TLR4/NF-κB信号通路下游分子的关系,以及探讨不同TLRs对不同组织局部RAS成分激活的影响。
综上所述,DIO状态下可通过TLR4信号通路介导激活脂肪组织RAS系统,TAK-242特异性的阻断TLR4信号通路,能下调RAS成分表达,提示抑制TLR4配体受体结合作用是阻断脂肪组织局部RAS激活的重要途径。TLR4/NF-κB信号通路可作为揭示肥胖患者慢性炎症发病机制研究的切入点,为将来对肥胖慢性炎症研究提供依据。
参考文献
[1]IANTORNO M,CAMPIA U,DI DANIELE N,et al.Obesity,inflammation and endothelial dysfunction[J].J Biol Regul Homeost Agents,2014,28(2):169-176.
[2]KALUPAHANA N S,MASSIERA F,QUIGNARD-BOULANGE A,et al.Overproduction of angiotensinogen from adipose tissue induces adipose inflammation,glucose intolerance,and insulin resistance[J].Obesity(Silver Spring),2012,20(1):48-56.
[3]KALUPAHANA N S,MOUSTAID-MOUSSA N.The adipose tissue renin-angiotensin system and metabolic disorders:a review of molecular mechanisms[J].Crit Rev Biochem Mol Biol,2012,47(4):379-390.
[4]PERRET-GUILLAUME C,JOLY L,JANKOWSKI P,et al.Benefits of the RAS blockade:clinical evidence before the ONTARGET study[J].J Hypertens Suppl,2009,27(2):S3-S7.
[5]THATCHER S,YIANNIKOURIS F,GUPTE M,et al.The adipose renin-angiotensin system:role in cardiovascular disease[J].Mol Cell Endocrinol,2009,302(2):111-117.
[6]YE J.Mechanisms of insulin resistance in obesity[J].Front Med,2013,7(1):14-24.
[7]HIRAI Y,YOSHIJI H,NOGUCHI R,et al.Cross talk between toll-like receptor-4 signaling and angiotensin-II in liver fibrosis development in the rat model of non-alcoholic steatohepatitis[J].J Gastroenterol.Hepatol,2013,28(4):723-730.
[8]HA T,LI Y,HUA F,et al.Reduced cardiac hypertrophy in tolllike receptor 4-deficient mice following pressure overload[J].Cardiovasc Res,2005,68(2):224-234.
[9]JING F,MOGI M,HORIUCHI M.Role of renin-angiotensin-aldosterone system in adipose tissue dysfunction[J].Mol Cell Endocrinol,2013,378(1-2):23-28.
[10]罗金花,孙嘉,蔡德鸿.Toll样受体4信号激动对脂肪细胞肾素-血管紧张素系统的影响[J].南方医科大学学报,2014(6):787-791.
[11]PAL D,DASGUPTA S,KUNDU R,et al.Fetuin-A acts as an endogenous ligand of TLR4 to promote lipid-induced insulin resistance[J].Nat Med,2012,18(8):1279-1285.
[12]SUN J,LUO J,RUAN Y,et al.Free Fatty Acids Activate Renin-Angiotensin System in 3T3-L1 Adipocytes through Nuclear Factor-kappa B Pathway[J].J Diabetes Res,2016,2016:1587594.
[13]FRIGOLET M E,TORRES N,TOVAR A R.The renin-angiotensin system in adipose tissue and its metabolic consequences during obesity[J].J Nutr Biochem,2013,24(12):2003-2015.
[14]II M,MATSUNAGA N,HAZEKI K,et al.A novel cyclohexene derivative,ethyl(6R)-6-[N-(2-Chloro-4-fluorophenyl)sulfamoyl]cyclohex-1-ene-1-carboxylate(TAK-242),selectively inhibits toll-like receptor 4-mediated cytokine production through suppression of intracellular signaling[J].Mol Pharmacol,2006,69(4):1288-1295.
[15]MATSUNAGA N,TSUCHIMORI N,MATSUMOTO T,et al.TAK-242(resatorvid),a small-molecule inhibitor of Toll-like receptor(TLR)4 signaling,binds selectively to TLR4 and interferes with interactions between TLR4 and its adaptor molecules[J].Mol Pharmacol,2011,79(1):34-41.
[16]SHEN W,GAO Y,LU B,et al.Negatively regulating TLR4/NF-κB signaling via PPARα in endotoxin-induced uveitis[J].Biochim Biophys Acta,2014.1842(7):1109-1120.
[17]FERREIRA A V,MENEZES-GARCIA Z,MARIO E G,et al.Increased expression of oxidative enzymes in adipose tissue following PPARalpha-activation[J].Metabolism,2014,63(4):456-460.
[18]WAJCHENBERG B L.Subcutaneous and visceral adipose tissue:their relation to the metabolic syndrome[J].Endocr Rev,2000,21(6):697-738.
[19]白纪红,梁志清,赵日红,等.银杏黄酮对非酒精性脂肪肝小鼠肝脏Toll样受体-4和核因子-κB表达的影响[J].实用医学杂志,2015,31(7):1091-1095.
