LASP-1对不同来源成骨细胞的运动、成骨功能及细胞周期分布的影响
2018-05-24贾芳赖春花周震高岩郭泽鸿徐淑兰
贾芳 赖春花 周震 高岩 郭泽鸿 徐淑兰
南方医科大学口腔医院(广州510082)
口腔种植体植入后,成骨细胞迁移并吸附至种植体表面的时效性可极大程度地影响种植体负重的时间,影响治疗进度[1-5]。影响细胞支架的LASP-1(LIM and SH3 protein)被多数研究证明可促进肿瘤细胞迁移[6-9]。NISHIKAWA等[10]认为LASP-1在膀胱癌中高表达,可促进肿瘤细胞运动。MG-63作为研究成骨细胞生物学行为的良好细胞模型,在各项研究中被广泛使用,但其作为肿瘤来源细胞,我们推测其可能与非肿瘤来源细胞在某些生物学功能方面具有差异。因此,本研究拟比较并干扰小鼠骨髓间充质干细胞(BMMSC)、人成骨细胞(hOB)以及人骨肉瘤细胞(MG-63)中LASP-1的表达,初步验证其在非肿瘤来源细胞(BMMSC及hOB)和肿瘤来源细胞(MG-63)的表达差异,比较其对该两大类细胞的运动迁移性能、成骨性能、增殖能力及细胞周期分布比例的影响,以推测LASP-1是否通过影响细胞迁移导致以上各性能差异。为今后研究LASP-1对在非肿瘤来源细胞的其他功能提供指导。
1 材料与方法
1.1 细胞培养与诱导分化
1.1.1 小鼠骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSC)的分离及培养 采用6%水合氯醛,以浓度为0.5 mL/100 g,对6~8周裸鼠进行麻醉,分别延双侧股骨长轴行纵向切口,分离表皮、肌层及筋膜层,暴露骨端,分离股骨,采用含抗生素的无血清培养基浸泡。使用手术刀切去两端骨骺端,暴露骨髓腔,采用含20%胎牛血清的培养基冲洗至骨质透明,于37℃,5%CO2培养3 d后换液。
1.1.2 实验细胞 本实验采用人骨肉瘤细胞(MG-63)及人成骨细胞(hOB)作为实验细胞,均购于中科院上海细胞库。MG-63、hOB置于37℃、5%CO2恒温细胞培养箱中进行孵育。
1.2 各细胞中LASP-1 mRNA的表达检测 (1)将BMMSC的细胞密度调整为1×105个/mL,移入1 mL至6孔板,加入骨诱导培养基(抗坏血酸60 mg/L,15 mmol/L磷酸甘油,12 nmol/L地塞米松,以及20%FBS的DMEM培养基)诱导分化7 d,再将BMMSC、hOB以及MG-63分别以1×106个/mL移入 10 cm2的培养板中,加入 Trizol(Invitrogen,15596026)进行总RNA提取,纤维素柱(dT)(Thermo,69702)进行mRNA分离,采用随机引物,Super-ScriptⅢ反转录酶(Invitrogen,18080093)合成cDNA第一链;再采用核酸内切酶H(上海君瑞)以及T4DNA ligase(Thermo Fisher,15224017)合成第二链cDNA,合成dsDNA使用Light Cycler H 480反应系统进行实时聚合酶链反应(Real time-PCR)。引物序列为:F:5′-ACGATCGGTACCTAAGT TCGATA-3′,R:3′-TAATACGTCTGACCGAATCAGA-5′,LASP-1的引物、探针的设计及合成由Invitrogen完成。反应体系为:LASP-1上下游引物0.4 μL,cDNA 2.5 μL,DEPC 水 ,引 物 GAPDH 0.4 μL,Buffer(10 ×)4 μL,50 mmol/L dNTP 4 μL,Taq酶0.3 μL,MgCl22 μL,总体系 20 μL,以评价 LASP-1 在BMMSC,MG-63和hOB中的表达,初始变性为95 ℃ 10 min;95 ℃ 10 s,进行45个循环扩增;55℃变性,30 s退火;42℃冷却30 s,延伸72℃ 3 min。LASP-1的定量计算通过3-磷酸甘油醛脱氢酶(GAPDH:序列:F:5′GAGACCTTCAACACCCCAGC-3′;R:5′CCACAGGATTCCATACC CAA-3′)为基准进行计算。反应结束后,确认扩增及溶解曲线,进行定量分析。实验重复3次。
1.3 Western Blot检测BMMSC、hOB以及MG-63中LASP-1的表达 分别将上述经骨诱导培养的BMMSC、MG-63和hOB以1×105个/mL移入6孔板,各加入150 μL RIPA裂解液(Thermo,89901),提取总蛋白后,使用BCA蛋白定量试剂盒(ab102536,Abcam)测量蛋白浓度,按操作说明进行。计算各浓度蛋白标准的平均吸光度,绘制标准曲线。提取的总蛋白,加入2×SDS蛋白上样缓冲液(1∶1),100℃下煮沸 5 min,-20℃保存备用。再通过SDS-PAGE胶制作、电泳、转膜、4℃封闭过夜。将膜取出放入抗小鼠单克隆LASP-1抗体(ab130109,Abcam)(1 μg/mL)中,4 ℃封闭过夜;PBST洗膜,5 min×4次;将膜转入二抗(1∶5 000,山羊抗鼠单克隆抗体A00160,南京金斯瑞)中,37℃反应1 h;PBST洗膜,5 min×5次;用化学发光法显影。
1.4 shLASP-1的转染 将1.2中获取的cDNA采用末端转移酶TdT(Invitrogen 16314015)进行修饰,形成黏性末端。反应体系为:cDNA 1 pmol/L;5 × Reaction buffer 4 μL;dATP 130 pmol;TdT 1.5 μL,加入ddH2O 至20 μL于37℃反应20 min,5 μL 0.5 mol/L EDTA终止反应。将质粒载体pLV[shLASP]-EGFP(Vector builder)进行双酶切反应,酶切体系包括以下试剂:10×LA Buffer(Tris-HCl pH8.5100mmol/L,KCl500nmol/L,MgCl215nmol/L)5 μL,100 × BSA 0.5 μL,pLV[shLASP]-EGFP 2 μL,限制性核酸内切酶PvuI 1 μL,NcoI 1 μL(Takara),加入ddH2O,总体系共50 μL,于37℃反应3 h。再将已修饰的dsDNA及经酶切的质粒载体于T4DNA ligase的连接反应体系中进行连接反应,水浴16℃过夜。将重组质粒转化DB3.1感受态细胞(北京华越洋),体积比均为1∶15。加入LB培养基(不含抗生素),于摇床上培养1 h,加入链霉素,将平板倒置,37℃培养24 h,筛选阳性克隆菌群。宿主细胞筛选稳定后,收集细菌,采用质粒小量提取试剂盒(Invitrogen,K210002)进行质粒抽提,再行双酶切反应鉴定DNA重组是否成功,酶切体系包括以下试剂:10 × LA Buffer 2 μL,重组质粒DNA 10 μL,限制性核酸内切酶(同上),ddH2O 6 μL,总体系共20 μL,于37℃下孵育3 h;同时采用琼脂糖凝胶电泳实验检测酶切结果;将重组质粒转染293T细胞,当其密度为6×106个/mL,达到70%融合时,进行转染12 h,更换为常规培养基,于37℃,5%CO2中培养48 h,收集慢病毒颗粒后,于-80℃保存。采用10倍有限稀释法进行病毒滴度检测。确定后,采用MOI=65感染BMMSC,hOB和MG-63(均达到30%汇合度)各12 h后,更换病毒液为常规培养基,继续培养至48 h;附以阴性LASP-1 negative control(LASP-1 NC)及阳性对照组(shMOCK)。采用qRT-PCR进行转染效率的检测,剩余转染细胞储存于1 μg/mL的嘌呤霉素中(Thermo Fisher)。见图1。

图1 pLV[shLASP]-EGFP质粒DNA结构图Fig.1 Structure diagram of pLV[shLASP]-EGFP plasmid DNA
1.5 细胞划痕实验 于细胞6孔培养板背面标记穿过培养孔圆心的水平直线,将已转染shLASP-1的BMMSC、hOB以及MG-63细胞以2.2×104个/mL的密度加入6孔板中100 μL,形成单细胞层,采用200 μL枪头于培养孔内垂直于标记线划痕,加入无血清培养基培养12 h,观察细胞运动迁移状态。
1.6 Western Blot检测LASP-1对OCN表达的影响 采用成功转染shLASP-1的BMMSC和MG-63,以1×105个/mL接种,两种细胞均采用RIPA裂解液(Thermo,89901)及BCA蛋白定量试剂盒(Thermo,23235),提取细胞总蛋白并进行定量检测。常规进行SDS-PAGE凝胶电泳,具体方法如1.3,加入抗小鼠单克隆OCN抗体(ab13420),封闭洗膜后转入二抗(1∶5 000,山羊抗鼠单克隆抗体A00160,南京金斯瑞)中,37℃反应1.5 h;洗膜并过夜进行免疫反应,显影。
1.7 XTT法检测LASP-1对细胞增殖性能的影响 按1.4将经过转染shLASP-1的BMMSCs,hOB以及MG-63细胞密度固定为2.2×104个/mL,于96孔板中分别加入100 μL细胞悬液,于5%CO2,37℃培养3 d,于倒置显微镜下观察,每48 h换液1次,设置空白对照组、阴性对照组、处理组以及调零组,每个处理组设置3个复孔,加入新鲜配制的XTT与电子偶联剂的混合液(50∶1),50 μL/孔,培养4 h,置入酶标仪450 nm处检测吸光值。见表1。

表1 XTT实验96孔板各组分布情况Tab.1 Distribution of each group in 96-well plate in XTT experiment
1.8 LASP-1对细胞周期的影响 采用200 μg/mL诺考达唑(Sigma)将经shLASP-1转染的MG-63和hOB分别处理20 h,使细胞停留在G2/M期。PBS清洗,并采用CycleTest试剂盒(碧云天C1052)检测实验细胞所处的细胞周期。400×g离心5 min后,加入250 μL的A溶液(胰蛋白酶缓冲液)至细胞中,室温下孵育10 min后,加入200 μL溶液B(胰蛋白酶抑制剂和核糖核酸酶),在室温下孵育10 min。最后,加入200 μL溶液C(碘化丙啶染色液),避光于冰上孵育10 min。采用Accuri C6流式细胞仪分析(Becton Dickinson)检测DNA含量。用FCS Express 4对细胞周期分布进行定量分析。
1.9 统计学方法 采用SPSS 13.0软件进行单因素方差分析行整体差异比较,两组之间的比较采用LSD检验,P<0.05被认为差异有统计学意义。
2 结果
2.1 LASP-1在BMMSC、hOB及MG-63中的表达 LASP-1在BMMSC及hOB中的表达未见明显差异,而MG-63者则高于前两者(P<0.05)。经琼脂糖凝胶电泳检测,经双酶切后的质粒载体获得三段分子,其大小分别为:1 198、1 897、6 812 bp,与理论值大小一致。表明重组载体构建成功。见图2、3。
2.2 经shLASP-1转染的各细胞迁移性能改变由图4可见,经转染shLASP-1,BMMSC及hOB(非肿瘤来源细胞)的细胞迁移距离较MG-63(肿瘤来源细胞)者稍远,但未见明显统计学差异(P>0.05);细胞形态未见明显差异。
2.3 shLASP-1转染 经转染shLASP-1,LASP-1在BMMSC和hOB中的表达未见明显变化,但MG-63者则可见表达降低;shMOCK组者,LASP-1在MG-63中明显升高,但在BMMSC和hOB中仍未见明显变化。图5。

图2 qRT-PCR检测LASP-1在BMMSC、hOB及MG-63中的表达Fig.2 Expression of LASP-1 in BMMSC,hOB and MG-63 by qRT-PCR

图3 Western Blot检测LASP-1在BMMSC、hOB及MG-63中的表达Fig.3 LASP-1 expression of BMMSC,hOB and MG-63 by western blot

图4 经shLASP-1转染,BMMSC、hOB以及MG-63培养12 h的细胞迁移状态Fig.4 Cell migration of BMMSC,hOB and MG-63 been cultured for 12h after been transfected with shLASP-1

图5 qRT-PCR检测BMMSC、hOB及MG-63经shLASP-1转染后LASP-1的表达Fig.5 Expression of LASP-1 of BMMSC,hOB and MG-63 been transfected with shLASP-1
2.4 LASP-1对细胞增殖能力的影响 经XTT检测显示肿瘤来源的MG-63在经shLASP-1转染条件下,细胞数量降低,增殖能力下降;而shMOCK组则显示细胞增殖能力明显上升,细胞数量升高。而随LASP-1表达量的改变,BMMSC的细胞数量未见明显变化。见图6。
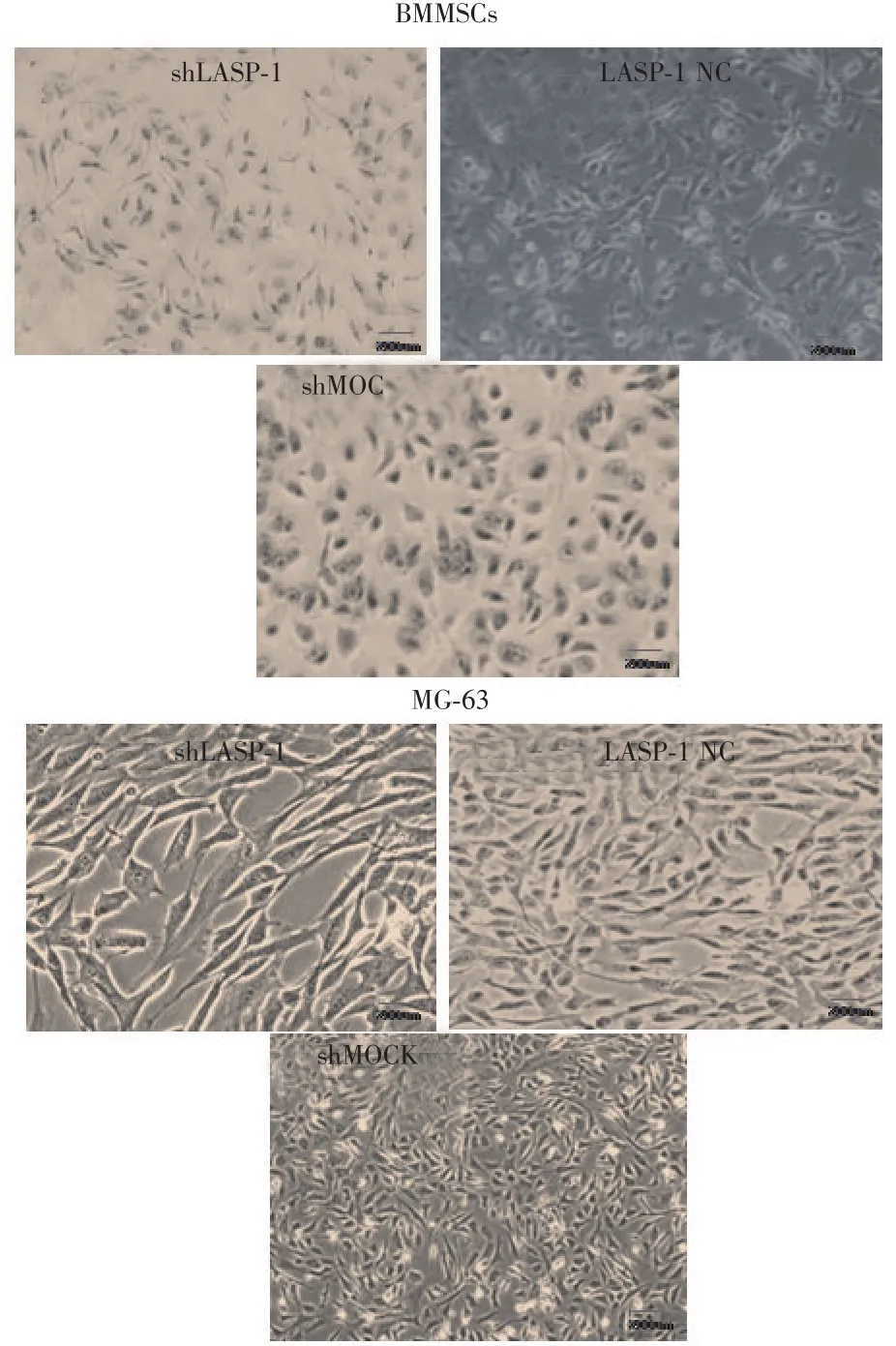
图6 XTT检测经转染后BMMSC以及MG-63的细胞增殖情况(200×)Fig.6 XTT result of the cell proliferation of BMMSC and MG-63 after transfection(Amplification of 200)
2.5 LASP-1对OCN表达的影响 经转染shLASP-1,改变LASP-1的表达,检测其对BMMSC以及MG-63的OCN(骨钙素)表达的影响显示:BMMSC的OCN表达未受影响;而MG-63者则发生明显变化:shLASP-1组的OCN表达降低,而shMOCK组表达含量明显升高。见图7。
2.6 LASP-1对细胞周期的影响 LASP-1的表达改变对hOB及MG-63的细胞分布周期的影响见图8:hOB在不同细胞周期的分布比例未见明显变化,而MG-63者,shLASP-1组,处于G2/M期的细胞比例有所上升,处于G0/G1期的细胞含量下降;shMOCK组则处于G2/M期的细胞比例下降,处于G0/G1期的细胞比例明显上升。见图8。

图7 LASP-1对BMMSC及MG-63的OCN表达的影响Fig.7 OCN expression of BMMSC and MG-63 after been transfected with shLASP-1

图8 LASP-1对hOB及MG-63细胞周期的影响Fig.8 Affect of LASP-1 on cellcycle of hOB and MG-63
3 讨论
骨组织再生修复过程主要包括:在破骨活动进行的前提下,骨髓间充质干细胞分化为成骨前体细胞及成骨细胞、在骨诱导因子作用下迁移至骨缺损区、分泌骨基质蛋白,并促进后期的基质矿化[12]。因此,骨诱导分化过程中,破骨细胞导致骨吸收,成骨前体细胞迁移至骨缺损区是成骨细胞最终分化成熟并发挥作用的重要前提[13]。
LASP-1为肌动蛋白骨架蛋白,Targetscan数据库分析并验证在乳腺癌细胞中,LASP-1对于肿瘤细胞迁移和侵袭有明显促进作用[14-16],并对肌动蛋白纤维束的稳定有重要作用[17-18]。有研究采用KEGG(京都基因及基因组百科全书)分析LASP-1可能参与的细胞通路,发现与之相关性很大的通路:粘附通路:KEGG(04510)[10],表明其与细胞运动具有重大关联性。然而,关于其对正常组织细胞迁移影响的研究甚少,因此有必要研究其在正常组织中的表达及功能,以进一步完善对其的了解。基于以上背景,本课题组通过对BMMSC,hOB及MG-63中LASP-1的表达变化以及其对以上各细胞运动性能、增殖性能、OCN表达以及细胞周期分布规律影响的研究,验证其是否与正常骨组织的分化及功能发挥过程具有相关性,并比较其在非肿瘤细胞及肿瘤细胞中的表达区别。
如图3所示,LASP-1在未经诱导的BMMSC及hOB中的表达明显较MG-63者低,这可能与BMMSC和hOB为非肿瘤来源,MG-63为肿瘤来源细胞有关。基因水平qRT-PCR检测与蛋白水平WB的检测结果一致。分别转染BMMSC、hOB及MG-63后,发现BMMSC和hOB的LASP-1表达未见明显改变,且在不同细胞周期的细胞分布比例未见显著变化;而采用shLASP-1转染后,MG-63的细胞迁移距离较BMMSC及hOB肉眼观下略低,但未见统计学差异(P>0.05);在G2/M期的分布比例明显升高,在G0/G1期的分布降低,表明其处于DNA合成前期的细胞数量降低,而处于DNA合成后期的细胞数量上升,细胞增殖分裂数量降低;但shMOCK组该细胞系在G2/M期的分布降低,G0/G1期的分布比例升高,细胞增殖分裂数量升高。即LASP-1与BMMSC的传代、运动及分化无明显相关,亦对hOB者亦无明显影响,但对MG-63的基因表达及细胞分裂有影响,对之迁移能力未见明显影响。
骨钙素OCN可维持骨的正常矿化速率,是骨形成的重要生化标志。通过检测LASP-1上调及下调后对OCN表达的影响,可见LASP-1确可调节MG-63的成骨相关蛋白的表达,但对经骨诱导培养的BMMSC者则无显著影响。因此,鉴于LASP-1对该实验中各细胞的运动能力未见显著差异性影响,推测LASP-1可能参与介导MG-63的其他因素而影响其成骨过程,因此有待进一步证实;而其对正常骨组织的影响则较小。因此,拟通过调整LASP-1的表达来改变人成骨细胞的生化功能,则不易实现。有必要通过对其他信号通路的进一步研究,以探索LASP-1与非肿瘤来源组织细胞之间的关联,证明其间是否存在相互作用。
LASP-1在肿瘤来源的MG-63细胞中表达较在非肿瘤来源的BMMSC及hOB中的表达高;通过干扰LASP-1在MG-63中的表达,可见LASP-1表达的改变对细胞增殖能力、成骨能力以及细胞周期的分布比例均发生明显变化,但对细胞迁移运动未见明显影响;在BMMSC及hOB中无此变化。可见,LASP-1对肿瘤来源的成骨细胞有调控作用,而对非肿瘤来源细胞则无明显影响。
参考文献
[1]FU J H,RIOS,HECTOR,et al.A randomized clinical trial evaluating the efficacy of the sandwich bone augmentation technique in increasing buccal bone thickness during implant placement[J].Clin Oral Implants Res,2015,26(10):1150-1157.
[2]PARK S Y,KIM K H,GWAK E H,et al.Ex vivo bone morphogenetic protein 2 gene delivery using periodontal ligament stem cells for enhanced re-osseointegration in the regenerative treatment of peri-implantitis[J].J Biomed Mater Res A,2015,103(1):38-47.
[3]KANCZLER J M,OREFFO R O.Osteogenesis and angiogenesis:the potential for engineering bone[J].Eur Cell Mater,2008,15:100-114.
[4]SVERZUT A T,RODRIGUES D C,LAURIA A,et al.Clinical,radiographic,and histological analyses of calcium phosphate cement as filling material in maxillary sinus lift surgery[J].Clin Oral Implants Res,2015,26(6):633-638.
[5]ZHANG W J,LI Z H,HUANG Q F,et al.Effects of a hybrid micro/nanorod Topography-modified titanium implant on adhesion and osteogenic differentiation in rat bone marrow mesenchymal stem cells[J].Int J Nanomedicine,2013,8:257-265.
[6]GRUNEWALD T G,BUTT E.The LIM and SH3 domain protein family:structural proteins or signal transducers or both?[J].Mol Cancer,2008,7:31.
[7]ZHANG H,CHEN X,BOLLAG W B,et al.Lasp-1 gene disruptionis linked to enhanced cell migration and tumor formation[J].Physiol Genomics,2009,38(3):372-385.
[8]WANG C,ZHENG X,SHEN C.MicroRNA-203 suppresses cell proliferation and migration by targeting BIRC5 and LASP1 in human triple-negative breast cancer cells[J].J Exp Clin Cancer Res,2012 ,31:58.
[9]HAILER A,GRUNEWALD T G,ORTH M,et al.Loss of tumor suppressor mir-203 mediates overexpression of LIM and SH3 Pro-tein 1(LASP1)in high-risk prostate cancer thereby increasing cell proliferation and migration[J].Oncotarget,2014,5(12):4144-4153.
[10]NISHIKAWA R,GOTO Y,SAKAMOTO S,et al.Tumor-suppressive microRNA-218 inhibits cancer cell migration and invasion via targeting of LASP-1 in prostate cancer[J].Cancer Sci,2014,105(7):802-811.
[11]金科华,刘洁.质粒抽提策略对双酶切鉴定的影响[J].山西医科大学学报,2015,46(6):559-561.
[12]袁林,钱钧,杨征毅,等.不同来源骨髓间充质干细胞成骨能力的比较[J]. 口腔疾病防治,2017,25(9):554-559.
[13]张苍宇,王栓科,任广铁,等.组织工程骨膜同种异体体内成骨修复兔肩胛骨缺损的初步研究[J].中国修复重建外科杂志,2014,28(31):384-388.
[14]SHIMIZU F,SHIIBA MASASHI,OGAWARA K,et al.Overexpression of LIM and SH3 Protein 1 leading to accelerated G2/M phase transition contributes to enhanced tumourigenesis in oral cancer[J].PLoS One,2013,8(12):e83187
[15]TANG R X,KONG F Y,HU L N,et al.Role of hepatitis B virus X protein in regulating LIM and SH3 protein 1(LASP-1)expression to mediate proliferation and migration of hepatoma cells[J].Virol J,2012,9:163.
[16]GRUNEWALD T G,KAMMERER U,WINKLER C,et al.Overexpression of LASP-1 mediates migration and proliferation of human ovarian cancer cells and influences zyxin localisation[J].Br J Cancer,2007,96(2):296-305.
[17]孔凡运,胡丽娜,张海清,等.特异性si RNA沉默LASP-1对Hep G2细胞增殖和迁移的影响[J].苏州大学学报(医学版),2012,32(2):184-188.
[18]CHIYOMARU T,ENOKIDA H,KAWAKAMI K,et al.Functional role of LASP1 in cell viability and its regulation by microRNAs in bladder cancer[J].Urol Oncol,2012,30(4):434-443.
