中药催情散的急性和亚慢性毒性研究
2018-05-24蒋瑞东任书男祁生旺李云章查斯图
刘 伟,程 波,蒋瑞东,任书男,祁生旺,李云章,查斯图
(1内蒙古农业大学 兽医学院,内蒙古 呼和浩特 010018;2 巴林左旗动物卫生监督所,内蒙古 赤峰 025450)
不孕症作为奶牛场的四大疾病之一,是影响奶牛繁殖和养殖业经济效益的主要因素,其中卵巢疾病是导致奶牛不孕的主要原因,而奶牛持久黄体是最常见的卵巢疾病[1-2]。持久性黄体可持续分泌孕酮,抑制卵泡发育,从而使发情周期停止循环而出现乏情现象,导致奶牛空怀时间及产犊间隔延长[3],最终降低奶牛场经济效益。临床上往往使用外源激素对卵巢疾病进行治疗,由于激素的长期及不当使用,容易造成奶牛性周期紊乱和激素在牛奶中的残留,进而危害人类健康。
由于中药具有副作用小、药物残留量少的特点逐渐受到人们的青睐[4]。闫宝琪等[4]用一定剂量的藿芪灌注液治疗奶牛持久黄体取得不错的疗效;梁光华等[5]用中药促孕散治疗奶牛持久黄体,发情有效率较高,并且治疗后奶牛血清中生殖激素、微量元素及白介素也有相应的变化。
中药方剂催情散由“内蒙古奶牛不孕症的病因调查及中西医综合治疗集成”课题组相关人员根据中兽医理论研制而成,由淫羊藿、阳起石、菟丝子、当归、川芎、熟地等12味中药组成,具有温肾补肾、壮阳固精、活血祛瘀、行气解郁的作用[6]。本试验以小鼠和大鼠为试验动物,研究了催情散的急性毒性和亚慢性毒性,以期对该方剂的安全性进行科学评价,并为其临床应用提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 试验药物 中药催情散由淫羊藿、阳起石、菟丝子、当归、川芎、肉苁蓉、熟地、陈皮、木香、厚朴、香附、甘草等12味中药组成,中药材购自内蒙古惠丰堂大药房连锁有限公司。将催情散制备成含生药1 g/mL的水煎剂:取催情散散剂315 g,混匀后装入自制药袋中,再将药袋放入煎药器中,加水浸泡2 h后加热煮沸。开始用武火,沸腾后改用文火,保持微沸30 min,趁热倒出药液,再加水同法煎药2次。将3次药液合并后浓缩成1 g/mL,4 ℃密封保存备用。灌胃时可依据试验设计的灌胃剂量及体积,对药液稀释后使用。
1.1.2 试验动物 健康昆明系雌性小鼠(约5周龄,体质量18~22 g)60只及健康雌性Wistar大鼠(约7周龄,体质量110~130 g)40只,由内蒙古大学动物实验中心提供,合格许可证号为SCXK(蒙)2016-0001号。试验前室温条件下常规饲养7 d,自由采食与饮水,每周更换3次垫料,观察健康状况。
1.1.3 主要仪器及试剂 BC-2800vet全自动血液细胞分析仪,北京曼程科技有限公司;奥林帕斯(OLYMPUS)系列的全自动生化分析仪、奥林帕斯(OLYMPUS)光学显微镜、SC-04型低速离心机,安徽中科中佳科学仪器有限公司。天门冬氨酸氨基转移酶(AST,批号:140216017)、丙氨酸氨基转移酶(ALT,批号:140116022)、谷氨酰转移酶(r-GGT,批号:140916015)、碱性磷酸酶(ALP,批号:140316003)、总胆固醇(TC,批号:141616018)、葡萄糖(GLU,批号:141516018)、白蛋白(ALB,批号:140916013)、总蛋白(TP,批号:140816010)、尿素(UREA,批号:141316019)、肌酐(CREA,批号:141016003)试剂盒,均购自内蒙古精壹试剂耗材有限公司。灌胃针、一次性采血针及配套真空采血管,购自内蒙古呼和浩特市泽生试剂耗材有限公司。
1.2 半数致死量(LD50)的测定
取健康雌性昆明小鼠60只,随机平均分为6组,1~5组为试验组,第6组为对照组,各组小鼠禁食8 h后灌胃给药,给药4 h后复食,试验组按组间剂量比为1∶0.8 一次性灌胃给药,第1~5组的给药剂量分别为20 000,16 000,12 800,10 240和8 192 mg/kg,对照组灌服等体积的自来水,各组小鼠药液灌胃体积为每20 g体质量 0.4 mL。小鼠给药后常规饲养7 d,逐日观察精神、食欲、饮水及其活动情况,记录中毒症状、死亡时间和数目,并对死亡动物及时剖检、记录眼观病理变化,按改良寇式法计算LD50[7]。如小鼠未出现死亡,且无法继续给药(测不出LD50)[8-12],需进行最大耐受量试验[13]。
1.3 最大耐受量试验
取雌性小鼠 20只 ,分为给药组与对照组,每组10只,禁食8 h(不禁水)。试验组小鼠于12 h内分3次灌服1 g/mL催情散药液,每次灌胃体积为每20 g体质量0.8 mL(最大灌胃体积);对照组小鼠灌服等体积的自来水。小鼠灌胃后常规饲养7 d,逐日观察小鼠精神、食欲、饮水及其活动情况,记录小鼠的中毒症状、死亡时间及数目,并计算最大耐受量及耐受倍数,之后颈椎脱臼处死小鼠并剖检,观察2组小鼠的心、肝、脾、胃、肺、肾、卵巢、子宫等器官有无肉眼可见的病理变化[14-15]。小鼠的最大耐受量倍数=(小鼠耐受药量/小鼠平均体质量)×(奶牛平均体质量/奶牛每天用药量),其中奶牛平均体质量取450 kg/头,奶牛每天用药量取临床推荐量315 g。
1.4 亚慢性毒性试验
取雌性大鼠40只,随机平均分为催情散高、中、低剂量给药组和对照组,高、中、低剂量给药组灌胃剂量分别为10 000,5 000和2 500 mg/kg,每天1次,对照组每日定时灌服等体积自来水。各组连续灌胃30 d(每7 d称一次体质量调整灌胃体积),整个试验期间,每天早晚观察并记录动物的行为情况、外观体征、有无中毒反应以及死亡情况等[16]。给药期结束后各组大鼠心脏采血,检测血常规和血液生化指标。
1.4.1 体质量的测定 于灌药前及给药第7,14,21,28和30天,测定并记录大鼠体质量[17]。
1.4.2 血常规及血液生化指标的测定 采用全自动血液细胞分析仪测定血液的主要生理指标,包括血红蛋白(HGB)含量、红细胞数目(RBC)、白细胞数目(WBC)及各类白细胞(淋巴细胞(Lym)、单核细胞(Mon)、中性粒细胞(Neu)、嗜酸性粒细胞(Eo)、嗜碱性粒细胞(Ba))占白细胞总数的比例。分离血清后采用自动血液生化指标分析仪测定血液生化指标,包括天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、谷氨酰转移酶(r-GGT)、碱性磷酸酶(ALP)活性及总蛋白(TP)、白蛋白(ALB)含量和肌酐(CREA-J)、尿素(UREA)、葡萄糖(GLU)、总胆固醇(TC)浓度[18-19]。
1.4.3 病理变化观察及脏器系数的测定 4组大鼠采血后立即剖检,观察心、肝、脾、胃、肾、肺等器官的眼观病理变化,并对每组大白鼠的心、肝、脾、胃、肺、肾、卵巢、子宫器官称质量后用10%福尔马林固定,经不同梯度酒精脱水、浸蜡包埋后切片,HE染色后在光学显微镜下观察各器官组织病理学变化[20-23],计算心、肝、脾、胃、肺、肾、卵巢、子宫等器官的脏器系数(脏器系数=脏器质量/体质量×100%)[24]。
1.5 数据处理
各项试验数据用“平均值±标准差”表示,应用SPSS 20.0进行各组数据间的差异显著性比较及统计与分析。
2 结果与分析
2.1 中药催情散的LD50
经口1次灌服给药后,各组小鼠由于灌胃应激会呆立2~3 min,之后精神状态逐步恢复正常,活动自如,皮毛光滑,排粪、排尿正常且无异常分泌物,无不良反应。连续观察7 d,各组小鼠精神、食欲、饮水、活动程度均无异常,经大体剖检和病理检查,主要脏器无异常变化。由本试验可知,按改良寇式法不能计算出该药物的LD50(LD50>20 000 mg/kg),按毒理学评价标准及药物毒性分级标准,当LD50>16 000 mg/kg时,可认为该药物无毒性。由于受给药体积和药物浓度的限制,难以测出LD50,故进行小鼠的最大耐受量试验。
2.2 中药催情散的最大耐受量
小鼠于12 h内分3次最大体积连续灌服中药催情散后,试验组累计药量达到120 g/kg,2组小鼠在灌胃后由于灌胃应激出现蜷缩呆立、活动减少现象,5 min后活动和饮食情况恢复正常。经7 d观察未见死亡和异常状况,剖检后各器官未出现眼观病理变化。经计算,小鼠(体质量20 g/只)的最大耐受药量为2.4 g/只。小鼠灌服催情散的最大耐受量倍数=2.4/20×450 000/315=171.5,即按体质量计算小鼠1 d最大耐受量是奶牛临床推荐剂量的171.5 倍,而此剂量下小鼠未出现异常变化,说明中药催情散按临床推荐剂量使用对奶牛是安全的。
2.3 中药催情散的亚慢性毒性
2.3.1 一般状况观察及体质量的测定 试验期间4个处理组大鼠除在前3 d有灌胃应激,但不到3 min就可恢复正常状态。除此之外,整个灌胃期间大鼠精神状态、活动程度和饮食情况均无异常变化,排粪、排尿正常,无异常分泌物。由表1可知,3个催情散剂量组大鼠体质量与对照组相比差异不显著(P>0.05),说明催情散水煎剂对大鼠生长发育无明显影响。
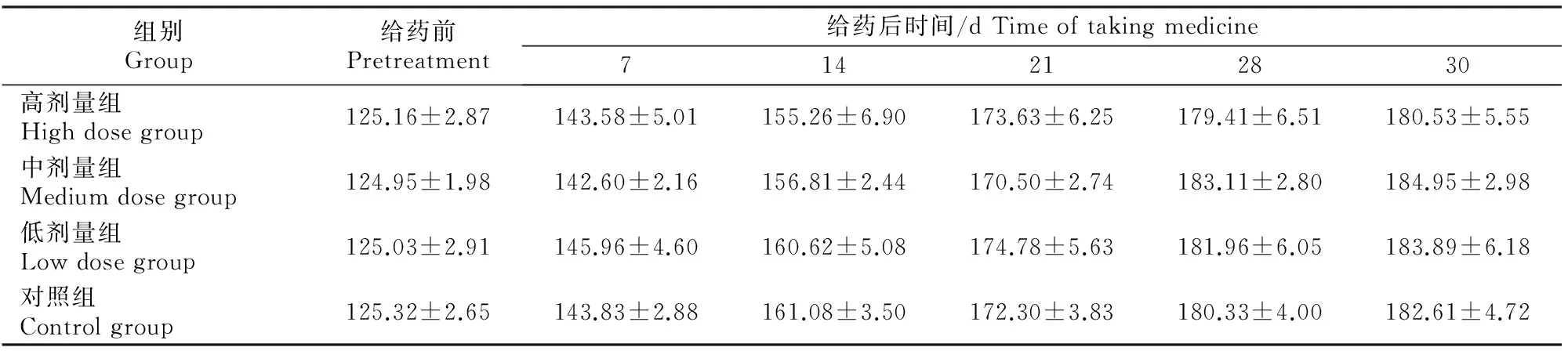
表1 不同剂量催情散对大鼠体质量的影响Table 1 Effect of different doses on weight of rats g/只
2.3.2 血常规及血液生化指标检查 由表2,3可知,各组大鼠血常规和血液生化指标均无显著差异(P>0.05),说明催情散口服灌药过程中,对血常规及肝、肾功能无明显影响。
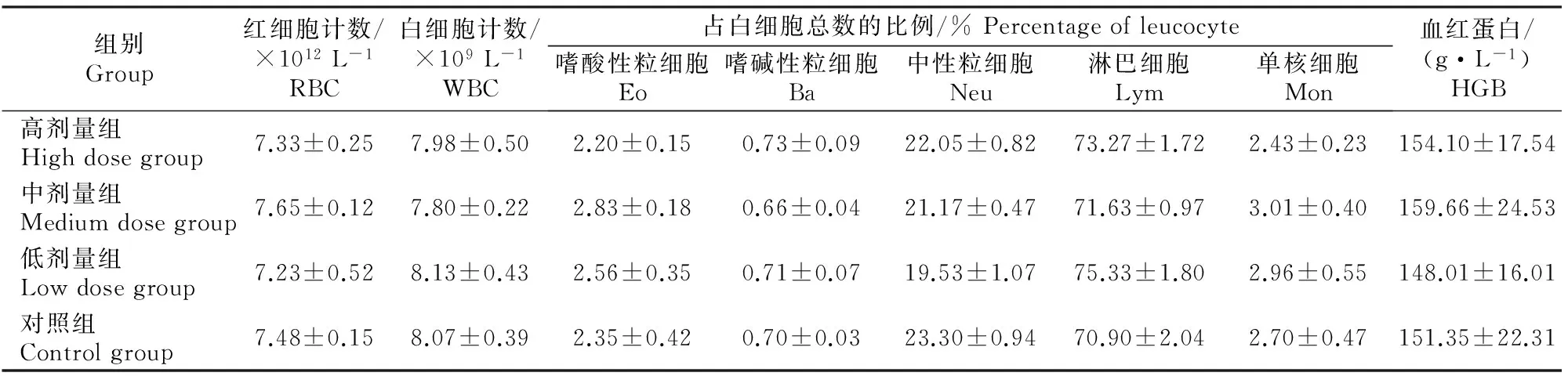
表2 不同剂量催情散对大鼠血常规的影响 Table 2 Effect of different doses on blood routine examination of rats

表3 不同剂量催情散对大鼠血液生化指标的影响Table 3 Effect of different doses on blood biochemical indexes of rats
2.3.3 病理剖检变化及脏器系数 由表4可知,4个处理组大鼠各脏器系数均无显著差异(P>0.05),表明中药催情散对大鼠各器官组织无实质性损害。

表4 不同剂量催情散对大鼠脏器系数的影响Table 4 Effect of different doses on organ coefficients of rats %
2.3.4 组织病理学变化 将催情散高、中、低剂量组和对照组大鼠各组织于光学显微镜(400倍)下观察,其中高剂量组和对照组大鼠心、卵巢的观察结果见图1。

A.高剂量组:箭头示心肌纤维坏死;B.对照组:上方箭头示间质血管出血,下方箭头示心肌纤维坏死;C.高剂量组:卵泡结构清晰无病变;D.对照组:卵巢髓质皮质无异常变化A.High dose group:the arrow shows myocardial fiber necrosis;B.Control group:the above arrow shows interstitial vascular hemorrhage,and the bottom arrow shows myocardial fiber necrosis;C.High dose group:follicle structure clearly no pathological changes;D.Control group:no abnormal change in ovarian medulla and cortex图1 催情散高剂量组和对照组大鼠心脏、卵巢的切片观察结果(HE染色,×400)Fig.1 Heart and ovarian slice observation of mice in high dose group and control group (HE stain,×400)
显微观察显示,各组大鼠心肌细胞排列整齐,心内膜、心外膜结构清晰,有部分心肌纤维坏死、间质血管出血,这是大鼠心脏采血所致;肝小叶由以中央静脉为中心放射排列的肝板组成且肝细胞完整,肝小叶间的界限可以分清但不明显,小叶内及汇管区未见坏死和炎性细胞浸润,胆管未见异常;脾脏实质无异常变化,白髓、红髓及小梁、淋巴小结和静脉窦结构清晰可见,未见明显异常变化;肺内支气管、肺泡结构清晰完整,各级支气管及周围肺泡间隔未见变性坏死,支气管腔及肺泡腔内未见炎性渗出物;肾脏组织形态结构完整,肾单位清晰可见,肾小球及肾小管未见异常变化,肾小囊腔内未见炎性渗出物和细胞浸润,近曲、远曲小管及集合管结构完整,未见异常变化;胃组织的黏膜层完整,黏膜下层、肌层组织清晰且未见异常变化,表层黏液细胞、颈黏液细胞及主细胞结构完整,未见炎性变化;子宫组织完整,子宫内膜及内膜腺未见异常变化,子宫肌层未见坏死,血管层内未见充血等异常变化;卵巢髓质、皮质形态完整,卵母细胞的细胞核、细胞质、放射冠及颗粒细胞清晰可见,未见异常变化,部分大鼠卵巢皮质部可见完整的黄体组织,说明本试验中药对大鼠的主要脏器和靶器官无毒性作用。
3 讨 论
3.1 中药催情散的急性毒性评价
急性毒性是新药安全性评价的重要指标。本试验中,急性毒性试验因受药液质量浓度及灌胃体积的影响,无法计算出该药物的LD50,按毒理学评价标准及药物毒性分级标准,LD50>16 000 mg/kg时可认为该药物无毒性[25],据此可判断催情散无毒。根据中国新兽药研发规范与申报指南,对无法测出LD50的药物需分析其最大耐受量,一般检测动物单次或一天内2~3次服用最大剂量药物后的反应[15]。本试验中,小鼠经3次最大剂量药液灌服后的累积剂量达到120 g/kg,并且2组小鼠1周内未见异常变化,剖检后各脏器均无眼观病理变化。按体质量计算小鼠1 d最大耐受量是奶牛每天临床推荐剂量的171.5倍,而此剂量下小鼠未出现异常变化,说明中药催情散按临床推荐剂量使用对奶牛是安全的[26]。
3.2 中药催情散的亚慢性毒性评价
本药物的亚慢性毒性评价以连续30 d灌服不同剂量催情散后大鼠的反应和相应指标变化为依据。试验结果显示,3个剂量组大鼠的体质量、血常规、血液生化指标及脏器系数与对照组相比差异不显著(P>0.05),各脏器除了因心脏采血导致部分心肌纤维坏死和间质血管出血外,再无其他异常变化,表明该药物按临床推荐剂量使用不会对受试动物产生慢性毒性作用。
[参考文献]
[1] Gilbert R O.Management of reproductive disease in dairy cows [J].Vet Clin North Am Food Anim Pract,2016,32(2):387-410.
[2] Struve K,Herzog K,Magata F,et al.The effect of metritis on luteal function in dairy cows [J].BMC Vet Res,2013,9:244.
[3] 赵兴绪.兽医产科学 [M].北京:中国农业出版社,2010.
Zhao X X.Veterinary obstetrics [M].Beijing:China Agriculture Press,2010.
[4] 闫宝琪,王东升,张世栋,等.藿芪灌注液治疗奶牛卵巢静止和持久黄体的临床试验 [J].动物医学进展,2016,37(12):122-125.
Yan B Q,Wang D S,Zhang S D,et al.Clinical trials on Huoqi perfusate treatment of cow inactive ovary and persistent corpus luteum [J].Journal of Animal Medical Progress,2016,37(12):122-125.
[5] 梁光华,邓 敏,刘贤侠,等.促孕散对持久黄体和卵巢静止奶牛血清生殖激素的影响 [J].中国农业科学,2012,45(15):3182-3188.
Liang G H,Deng M,Liu X X,et al.A study on the impact of reproductive hormones in serum by using fertility-promoting powder for treating infertility caused by persistent corpus luteum and ovary sandstill of dairy cattle [J].Scientia Agricultura Sinica,2012,45(15):3182-3188.
[6] 刘钟杰,许剑琴.中兽医学 [M].北京:中国农业出版社,2014.
Liu Z J,Xu J Q.Traditonal chinese veterinary [M].Beijing:China Agriculture Press,2014.
[7] 王 静,蒋 万,何生虎,等.自制中药复方片剂对小鼠的急性毒性试验 [J].动物医学进展,2015,36(2):120-124.
Wang J,Jiang W,He S H,et al.Acute toxicity test of Self-made Traditional Chinese herbal compound tablet in mice [J].Progress in Veterinary Medicine,2015,36(2):120-124.
[8] 朱智德,蒋 林,罗宇东,等.六味葛蓝降脂片对小鼠急性经口毒性及遗传毒性的试验研究 [J].中国当代医药,2016,23(12):4-7.
Zhu Z D,Jiang L,Luo Y D,et al. Study on the acute and genetic toxicities of Liuwei Gelan lipid-lowering tablets in mice [J].China Modern Medicine,2016,23(12):4-7.
[9] 翁 蓓.固本抗癌颗粒急性毒性试验研究 [J].黑龙江医药,2015,28(2):304-305.
Weng B.Acute toxicity test research thrift anticancer granule [J].Heilongjiang Medicine Journal,2015,28(2):304-305.
[10] Li F,He X,Niu W,et al.Acute and sub-chronic toxicity study of the ethanol extract from leaves of Aralia elata in rats [J].J Ethnopharmacol,2015,175:499-508.
[11] 赵桂英,彭 诚,郑 雪,等.乌腺金丝桃急性毒性试验及对小白鼠血液部分指标的影响 [J].黑龙江畜牧兽医,2015,11(22):134-135.
Zhao G Y,Peng C,Zheng X,et al.Hypericum attenuatum acute toxicity test and the influences on part blood of the rats [J].Heilongjiang Animal Husbandry and Veterinary,2015,11(22):134-135.
[12] Zhou X R,Li P,Qu X L.Acute toxicity test of Chinese herbal compound Tongmai tangyanming capsule [J].Agricultural Science & Technology,2016,17(10):2332-2433.
[13] 郭时金,徐倩倩,付石军,等.清瘟败毒颗粒的急性和亚慢性毒性试验研究 [J].家畜生态学报,2014,35(1):61-64.
Guo S J,Xu Q Q,Fu S J,et al.Study on the acute and sub-chronic toxicity of Qingwen Baidu granules [J].Acta Ecologiae Animalis Domastici,2014,35(1):61-64.
[14] 卢婉怡.姜黄素毒性作用研究 [J].亚太传统医药,2014,10(12):12-14.
Lu W Y.Study on the toxicity of Curcumin [J].Asia-pacific Traditional Medicine,2014,10(12):12-14.
[15] 权晓弟,郝宝成,薛慧文,等.速康解毒口服液对小白鼠的急性毒性试验和亚慢性毒性试验 [J].西北农业学报,2014,23(8):20-24.
Quan X D,Hao B C,Xue H W,et al.Acute toxicity and chronic toxicity test of Sukang detoxification oral liquid in mice [J].Acta Agriculturae Boreali-occidentalis Sinica,2014,23(8):20-24.
[16] 姜玲玲,陈泓宇,史开宇,等.一种新兽用止泻中药复方制剂对大鼠的急性及亚慢性毒性试验 [J].中国畜牧兽医,2016,43(11):3073-3079.
Jiang L L,Chen H Y,Shi K Y,et al.Acute and sub-chronic toxicity test on rats of a new kind of antidiarrheal Chinese Herbal Medicine compound preparation for livestock [J].China Animal husbandry &Veterinary Medicine,2016,43(11):3073-3079.
[17] 彭文静,辛蕊华,任丽花,等.紫菀不同极性段提取物对SD大鼠亚慢性毒性试验研究 [J].中国畜牧兽医,2016,43(1):147-156.
Peng W J,Xin R H,Ren L H,et al.Study on subchronic toxicity test of different polarity section extracts fromAstertataricusL.F.on SD rats [J].China Animal Husbandry & Veterinary Medicine,2016,43(1):147-156.
[18] 王国庆,王旭荣,张 凯,等.“乳宁散”对小鼠急性和大鼠亚慢性毒性的试验研究 [J].中国畜牧兽医,2013,40 (5):129-132.
Wang G Q,Wang X R,Zhang K,et al.Study on acute toxicity test in mice and sub-chronic toxicity test in rats of “Runingsan” [J].China Animal husbandry &Veterinary Medicine,2013,40(5):129-132.
[19] Xu K,He Y,Zhang R,et al.Evaluation of safety of iridoids rich fraction from Valeriana jatamansi jones:acute and sub-chronic toxicity study in mice and rats [J].J Ethnopharmacol,2015,172:386-394.
[20] Wang L,Li Z,Li L,et al.Acute and sub-chronic oral toxicity profiles of the aqueous extract of Cortex Dictamni in mice and rats [J].J Ethnopharmacol,2014,158:207-215.
[21] 于 珊,张凤清,解耸林.五味贞甘饮品对化学性肝损伤有辅助保护作用功能学评价 [J].食品工业科技,2015,3(3):360-362.
Yu S,Zhang F Q,Xie C L,et al.Evaluation of the effect of mixed Zhengan drinks on chemical liver injury [J].Science and Technology of Food Industry,2015,3(3):360-362.
[22] 闫会晶.益气活血中药对缺血心肌的保护作用及其机制研究 [D].北京:中国中医科学院,2016.
Yan H J.Study the mechanism on which supplementing qi and activating blood Chinese drugs protect the ischemic myocardium [D].Beijing:China Academy of Chinese Medical Sciences,2016.
[23] Wang L,Lu J,Sun W,et al.Hepatotoxicity induced by radix sophorae tonkinensis in mice and increased serum cholinesterase as a potential supplemental biomarker for liver injury [J].Experimental & Toxicologic Pathology,2017,69(4):193-202.
[24] 刘晓磊,郑继方,辛蕊华,等.桑杏平喘颗粒的亚慢性毒性研究 [J].中国畜牧兽医,2013,40(6):199-202.
Liu X L,Zheng J F,Xin R H,et al.Study on subchronic toxicity of Sangxing pingchuan granules [J].China Animal husbandry &Veterinary Medicine,2013,40(6):199-202.
[25] 沈建忠.动物毒理学 [M].北京:中国农业出版社,2011.
Shen J Z.Animal toxicology [M].Beijing:China Agriculture Press,2011.
[26] 谢秀琼.中药新制剂开发与应用 [M].北京:人民卫生出版社,2006.
Xie X Q.Development and application of traditional Chinese medicine preparations [M].Beijing:People’s Medical Publishing House,2006.
