慢性阻塞性肺疾病合并肺动脉高压患者的临床特征与危险因素分析
2018-05-24沈奕播聂洪玉李琦
沈奕播,聂洪玉,李琦
(1自贡市第四人民医院呼吸科,自贡 643000;2陆军军医大学第二附属医院呼吸与危重症科, 重庆 400037)
慢性阻塞性肺疾病(chronic obstructive pulmo-nary disease,COPD)是目前发病率和病死率极高的慢性呼吸系统疾病,而肺动脉高压(pulmonary hypertension,PH)是COPD患者并发症之一,它可导致患者住院时间延长以及病死率上升,本研究旨在探讨COPD患者合并PH患者的临床特征及危险因素。
1 对象与方法
1.1 研究对象
回顾性分析2015年1月至2016年1月自贡市第四人民医院呼吸科住院COPD患者702例,根据是否并发PH分为PH组279例和无PH组423例,其中PH组男性255例,女性24例,年龄40~88(64.4±23.8)岁;无PH组男性380例,女性43例,年龄41~84(61.5±20.1)岁。纳入标准:符合《中国COPD诊治指南(2013年修订版)》COPD诊断标准[1]。超声心动图显示患者有PH,病程5~30年。排除标准:肺栓塞、间质性肺病、特发性肺动脉高压(idiopathic pulmonary arterial hypertension,IPAH)、左心疾病、活动性肺结核、免疫缺陷性疾病以及先天性心脏病等。世界卫生组织定义PH为收缩期肺动脉压(systolic pulmonary arterial pressure,SPAP)>40 mmHg(1 mmHg=0.133 kPa,彩色多普勒超声三尖瓣反流速度>3.0 m/s)[2-4]。PH组患者根据SPAP值又分为轻度PH亚组188例(40 mmHg
1.2 监测指标
收集患者性别、年龄、体质量指数(body mass index,BMI)、B型脑钠肽(type B brain natriuretic peptide,BNP)、红细胞沉降率(erythrocyte sedimentation rate,ESR)、红细胞压积(hematocrit,HCT)、C-反应蛋白(C-reactive protein,CRP)、白蛋白(albumin,ALB)、氧合指数(oxygenation index,OI)、D-二聚体(D-dimer,D-D)、纤维蛋白原(fibrinogen,FIB)、乳酸(lactic acid,LA)、第1 秒用力呼气末容积(first second forced expiratory volume,FEV1)、糖类抗原125(carbohydrate antigen 125,CA125)以及超声心动图检查结果。
1.3 统计学处理
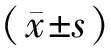
2 结 果
2.1 PH组和无PH患者临床特征比较
PH组和无PH组患者BMI、HCT、ALB、CRP、ESR、D-D、FIB和LA差异无统计学意义(P>0.05)。相比无PH组患者,PH组患者FEV1/预计值和OI值下降,BNP、CA125 和SPAP值增高,差异具有统计学意义(P<0.05;表1)。
2.2 轻度和重度PH组患者临床特征比较
轻度和重度PH组患者BMI、HCT、ALB、CRP和ESR差异无统计学意义(P>0.05)。相比轻度PH组患者,重度PH组患者FEV1/预计值和OI值下降,BNP、D-D、FIB、LA、CA125 和SPAP值增高,差异具有统计学意义(P<0.05;表2)。
2.3 Pearson相关分析SPAP的影响因素
Pearson相关分析结果表明SPAP与OI(r=-0.459,P=0.021)、FEV1/预计值至呈负相关(r=-0.442,P=0.035),与BNP(r=0.507,P=0.012)、CA125(r=0.375,P=0.048)和D-D(r=0.401,P=0.030)呈正相关。
2.4 多因素logistic回归分析
以是否存在PH为因变量,以年龄、BNP、ESR、CRP、OI、D-D、FIB、CA125、FEV1/预计值、BMI、HCT、LA为自变量建立logistic回归模型,结果表明BNP、CA125、D-D、FEV1/预计值和OI是PH的危险因素,具体结果见表3。

表1 PH和无PH组患者临床特征比较
PH: pulmonary hypertension; FEV1: first second forced expiratory volume; BMI: body mass index; HCT: hematocrit; ALB: albumin; BNP: type B brain natriuretic peptide; CRP: C-reactive protein; ESR: erythrocyte sedimentation rate; OI: oxygenation index; D-D: D-dimer; FIB: fibrinogen; LA: lactic acid; CA125: carbohydrate antigen 125; SPAP: systolic pulmonary arterial pressure.1 mmHg=0.133 kPa

表2 轻度和重度PH组患者临床特征比较
PH: pulmonary hypertension; FEV1: first second forced expiratory volume; BMI: body mass index; HCT: hematocrit; ALB: albumin; BNP: type B brain natriuretic peptide; CRP: C-reactive protein; ESR: erythrocyte sedimentation rate; OI: oxygenation index; D-D: D-dimer; FIB: fibrinogen; LA: lactic acid; CA125: carbohydrate antigen 125; SPAP: systolic pulmonary arterial pressure.1 mmHg=0.133 kPa
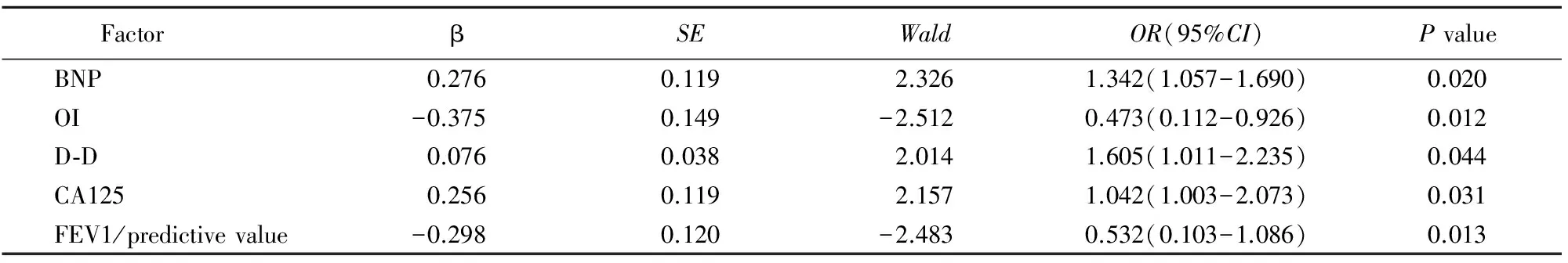
表3 多因素logistic回归分析PH影响因素
PH: pulmonary hypertension; BNP: type B brain natriuretic peptide; OI: oxygenation index; D-D: D-dimer; CA125: carbohydrate antigen 125; FEV1: first second forced expiratory volume
3 讨 论
本研究分析的均是住院患者,不包括非住院患者,且均采用多普勒超声诊断仪计算肺动脉压力,未能行右心导管检查,因此COPD合并PH患者的比例为39.7%(279/702),高于Cuttica等[5]通过右心导管评估得出的30.4%及Gologanu等[6]通过彩色多普勒超声评估得出的36.7%。
COPD合并PH患者早期无明显临床表现,仅有血流动力学改变,随着疾病进展,患者逐渐出现呼吸困难[7,8]。目前研究表明长期大量吸烟、持续性气道慢性炎症和低氧血症等可造成肺血管损伤、收缩、形成血栓和重塑,从而使肺动脉内膜增厚,平滑肌细胞增生,毛细血管缺失,细胞外基质合成及沉积,最终进展为PH[9]。严重时造成右心室肥厚及扩张,右心负荷增加可使BNP代偿性分泌增加,最终导致慢性肺源性心脏病发生[10]。Chen等[11]发现COPD合并PH患者BNP值显著高于单纯COPD患者,且与PH的严重程度相关,这与我们的研究结果一致。
CA125属于膜结合型黏蛋白,呼吸道杯状上皮细胞和黏膜下黏液腺细胞可分泌。气道炎症可促使杯状上皮细胞增生和黏液腺细胞增生,从而导致CA125合成和分泌增加[12]。研究表明COPD患者血清CA125值高于健康人群[13]。同时研究亦证实,COPD合并PH患者体内炎症因子的水平更高[14]。本研究表明COPD合并PH患者CA125值明显高于无PH患者,且随PH严重程度增加而显著升高,其机制可能与炎症因子过度表达及黏液腺细胞合成与分泌CA125增加有关。
D-D是纤维蛋白降解的最终衍生物之一,是机体呈高凝状态及纤溶系统亢进的标志。研究表明COPD患者血液处于高凝状态,合并PH时则更突出[15],其机制可能与患者肺血管微小血栓形成有关[16]。亦有研究表明上述机制可能是PH形成和发展的重要因素[17]。本研究亦表明重度PH组比轻度PH组患者D-D值高,这可能预示患者的危险程度。总之,COPD合并PH患者治疗时间长,预后差,动态检测和评估患者的BNP、CA125、D-D、FEV1/预计值和OI对临床诊疗具有一定的指导意义。
【参考文献】
[1] 中华医学会呼吸病学分会慢性阻塞性肺疾病学组. 慢性阻塞性肺疾病诊治指南(2013 修订版)[J]. 中华结核和呼吸杂志, 2013, 36(4): 255-264. DOI: 264.10.3760/cma.j.issn.1001- 0939.2013.04.007.
Chronic Obstructive Pulmonary Disease Group of Chinese Thoracic Society. Guidelines for the diagnosis and treatment of chronic obstructive pulmonary disease (2013 Revised Edition)[J]. Chin J Tuberc Respir Dis, 2013, 36(4): 255-264. DOI: 264.10.3760/cma.j.issn.1001-0939.2013.04.007.
[2] Hayes D Jr, Daniels CJ, Mansour HM,etal. Right heart catheterization measuring central hemodynamics in cystic fibrosis during exercise[J]. Respir Med, 2013, 107(9): 1365-1369. DOI: 10.1016/j.rmed.2013.02.020.
[3] Lau EM, Tamura Y, Mcgoon MD,etal. The 2015 ESC/ERS guidelines for the diagnosis and treatment of pulmonary hypertension: a practical chronicle of progress[J]. Eur Respir J, 2015, 46(4): 879-882. DOI: 10.1183/13993003.01177-2015.
[4] 翟振国, 陈新旺, 王辰. ESC/ERS《肺动脉高压诊断和治疗指南》制定过程中的方法学及主要变化[J]. 中华医学杂志, 2016, 96(4): 315-317. DOI: 10.3760/cma.j.issn.0376-2491.2016.04. 019.
Zhai ZG, Chen XW, Wang C. Methodology and main changes in ESC/ERS guidelines for the diagnosis and treatment of pulmonary hypertension[J]. Natl Med J China, 2016, 96(4): 315-317. DOI: 10.3760/cma.j.issn.0376-2491.2016.04.019.
[5] Cuttica MJ, Kalhan R, Shlobin OA,etal. Categorization and impact of pulmonary hypertension in patients with advanced COPD[J]. Respir Med, 2010, 104(12): 1877-1882. DOI: 10.1016/j.rmed. 2010.05.009.
[6] Gologanu D, Stanescu C, Ursica T,etal. Prevalence and characteristics of pulmonary hypertension associated with COPD — a pilot study in patients referred to a Pulmonary Rehabilitation Program Clinic[J]. Maedica (Buchar), 2013, 8(3): 243-248.
[7] Hoeper MM, Bogaard HJ, Condliffe R,etal. Definitions and diagnosis of pulmonary hypertension[J]. J Am Coll Cardiol, 2013, 62(Suppl 25): D42-D50. DOI: 10.1016/j.jacc.2013.10.032.
[8] 贾佳, 程德云. 慢性阻塞性肺疾病相关肺动脉高压发病机制[J]. 临床荟萃, 2016, 31(3): 345-348. DOI: 10.3969/j.issn.1004-583X.2016.03.029.
Jia J, Cheng DY. Pathogenesis of pulmonary hypertension associated with chronic obstructive pulmonary disease[J]. Clin Focus, 2016, 31(3): 345-348. DOI: 10.3969/j.issn.1004-583X.2016.03.029.
[9] 王同生, 毛毅敏, 孙瑜霞, 等. 慢性阻塞性肺疾病合并肺动脉高压的临床特征及高危因素[J]. 中华内科杂志, 2015, 54(12): 1037-1040. DOI: 10.3760/cma.j.issn.0578-1426.2015.12. 010.
Wang TS, Mao YM, Sun YX,etal. Pulmonary hypertension in patients with chronic obstructive pulmonary disease: clinical characteristics and risk factors[J]. Chin J Intern Med, 2015, 54(12): 1037-1040. DOI: 10.3760/cma.j.issn.0578-1426.2015.12.010.
[10] 刘敏, 高莹卉, 崔华, 等. 老年男性慢性阻塞性肺疾病患者肺动脉高压发生率及相关危险因素分析[J]. 中华老年心脑血管病杂志, 2016, 18(11): 1144-1146. DOI: 10.3969/j.issn. 1009-0126.2016.11.007.
Liu M, Gao YH, Cui H,etal. Prevalence and risk factors for pulmonary hypertension in elderly male patients with chronic obstructive pulmonary disease[J]. Chin J Geriatr Heart Brain Vessel Dis, 2016, 18(11): 1144-1146. DOI: 10.3969/j.issn.1009-0126.2016.11.007.
[11] Chen Y, Liu C, Lu W,etal. Clinical characteristics and risk factors of pulmonary hypertension associated with chronic respiratory diseases: a retrospective study[J]. J Thorac Dis, 2016, 8(3): 350-358. DOI: 10.21037/jtd.2016.02.58.
[12] Huang F, Chen J, Liu Y,etal. New mechanism of elevated CA125 in heart failure: the mechanical stress and inflammatory stimuli initiate CA125 synthesis[J]. Med Hypotheses, 2012, 79(3): 381-383. DOI: 10.1016/j.mehy.2012.05.042.
[13] Uz O, Kardesoglu E, Tas D,etal. CA-125 level is associated with right ventricular echocardiographic parameters in patients with COPD[J]. South Med J, 2011, 104(9): 624-628. DOI: 10.1097/SMJ.0b013e318229a55c.
[14] 蒋延文, 庞莉, 方秋红, 等. 血清炎性因子水平与慢性阻塞性肺疾病继发肺动脉高压的相关性研究[J]. 中华结核和呼吸杂志, 2011, 34(12): 904-908. DOI: 10.3760/cma.j.issn.1001-0939.2011.12.007.
Jiang YW, Pang L, Fang QH,etal. The relationship between inflammatory mediators and pulmonary hypertension in patients with chronic obstructive pulmonary disease[J]. Chin J Tuberc Respir Dis, 2011, 34(12): 904-908. DOI: 10.3760/cma.j.issn.1001-0939.2011.12.007.
[15] 赵燕霞, 黄相增. NT-ProBNP、CRP及D-D在COPD急性加重期合并肺动脉高压中的相关性研究[J]. 国际呼吸杂志, 2014, 34(5): 341-346. DOI: 10.3760/cma.j.issn.1673-436X.2014.05.006.
Zhao YX, Huang XZ. Correlation study of serum NT-ProBNP, CRP and D-D levels in patients of AECOPD with pulmonary hypertension[J]. Int J Respir, 2014, 34(5): 341-346. DOI: 10.3760/cma.j.issn.1673-436X.2014.05.006.
[16] 胡萍, 张运剑. 老年慢性阻塞性肺疾病合并肺血栓栓塞症诊治进展[J]. 中华老年多器官疾病杂志, 2015, 14(12): 940-943. DOI: 10.11915/j.issn.1671-5403.2015.12.216.
Hu P, Zhang YJ. Progress in diagnosis and treatment for pulmonary thromboembolism in the elderly with chronic obstructive pulmonary disease[J]. Chin J Mult Organ Dis Elderly, 2015, 14(12): 940-943. DOI: 10.11915/j.issn.1671-5403.2015.12.216.
[17] 李雪英, 胡苏萍, 陈国忠, 等. 炎症反应与慢性阻塞性肺疾病相关肺动脉高压及其血液高凝状态的关系[J]. 山东医药, 2017, 57(1): 71-73. DOI: 10.3969/j.issn.1004-437X.2017.21.023.
Li XY, Hu SP, Chen GZ,etal. Relationship between inflammatory response and pulmonary hypertension associated with chronic obstructive pulmonary disease and its hypercoagulability[J]. Shandong Med J, 2017, 57(1): 71-73. DOI: 10.3969/j.issn.1004-437X.2017.21.023.
