老年住院患者衰弱指数不同临界值与出院预后分析
2018-05-24吕卫华王青翟雪靓赵清华张少景符琳琳徐颖
吕卫华,王青,翟雪靓,赵清华,张少景,符琳琳,徐颖
(首都医科大学附属复兴医院综合科,北京 100038)
衰弱是一种与年龄相关的老年综合征,是指老年人生理储备下降导致机体易损性增加、抗应激能力减退的非特异性状态,这种状态与老年人住院、失能、死亡等不良健康后果有关[1,2]。住院老年患者是衰弱高危人群,准确地识别易发生不良健康事件的衰弱患者对风险评估和治疗计划的选择十分重要。目前衰弱评估主要是基于衰弱表型(frailty phenotype,FP)[3]及衰弱指数(frailty index,FI)[4]2种方法。FI是连续性变量,值越大,衰弱程度越严重,但确定衰弱状态的临界值目前没有统一标准。国外在社区人群中采用不同临界值的研究证实,FI能准确预测死亡、失能等不良结局风险[5-7]。住院老年患者不同于社区人群,采用何种临界值更适用于住院老年患者尚不明确。因此,本研究采用3种不同的FI临界值进行衰弱评估,评价不同FI临界值对患者出院6个月后发生不良健康事件的预测效果,并进行比较。
1 对象与方法
1.1 研究对象
选取2015年7月至2016年12月在首都医科大学附属复兴医院综合科连续入院的老年患者312例。纳入标准:(1)年龄≥70岁;(2)住院时间>48 h;(3)神志清楚,能完成衰弱评估内容,并签署知情同意书。排除标准:长期卧床、痴呆、恶性肿瘤晚期或需定期来院放化疗者及不能完成衰弱评估者。
1.2 方法
1.2.1 基线资料 收集患者一般临床资料,包括性别、年龄、文化程度、服药种类及数量(服药种类分为≤5及>5)、合并疾病(高血压、糖尿病、冠心病、既往卒中病史、慢性阻塞性肺疾病、慢性肾脏病、房颤、微小皮肤癌除外的恶性肿瘤)、共病数量分组(≤1、2~3和≥4)、血红蛋白、丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、血钾、血钠、血氯、血清白蛋白和左室射血分数(left ventricular ejection fraction,LVEF)。冠心病定义为典型心绞痛症状、有明确陈旧性心肌梗死、冠状动脉造影明确有至少1支主要冠状动脉血管狭窄≥50%、急性冠脉综合征。慢性肾脏病定义参考美国肾脏病基金会制定的肾脏病临床实践(Kidney Disease Outcomes Quality Initiative,KDOQI)指南[8]。
1.2.2 FI评估和临界值的选择 参考Rockwood等[9-11]学者建议的FI构建标准和方法,选用包括健康状况、慢性疾病、临床症状、药物使用情况、跌倒风险、Katz日常生活活动(activities of daily living,ADL)量表、Lawton工具性日常生活活动(instrumental activity of daily living,IADL)量表、简明精神状态检查(mini-mental state examination,MMSE)量表[12]、老年抑郁量表(geriatric depression scale,GDS)及微型营养评估简表(mini nutritional assessment-short form,MNA-SF)[13]、实验室检查、LVEF等61个参数构建健康缺陷变量。每一个不健康项目编码为1,健康项目编码为0,将每一个住院老年患者所有项目的得分值相加,除以总分61得到该老年患者FI。选取国外研究及国内专家共识推荐的3种临界值:(1)FI-1[6]:FI≤0.20为非衰弱、0.20
1.2.3 患者随访 出院后随访>6个月,每3个月电话随访记录患者不良健康事件,包括跌倒、骨折、再入院及任何原因的死亡,发生任何一种上述不良健康事件定义为发生不良结局。
1.3 统计学处理
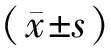
2 结 果
2.1 一般情况、衰弱评估及不良结局发生情况
本研究纳入老年住院患者312例,年龄70~98(83.6±5.5)岁,FI值范围0.06~0.61,FI-1、FI-2及FI-3确定衰弱的发生率分别为13.5%(42/312)、25.3%(79/312)及54.2%(169/312)。出院>6个月有146例发生不良结局(46.8%),其中跌倒31例(9.9%)、骨折12例(3.8%)、再入院123例(39.4%)、死亡16例(5.1%)。发生不良结局组患者的年龄、共病数量(≥4)及冠心病、慢性肾脏病、房颤、慢性阻塞性肺病的患病率显著高于未发生不良结局组,差异有统计学意义(P<0.05;表1)。
2.2 Cox回归分析
采用Cox回归分析不同FI临界值确定衰弱与不良结局的关系,结果显示,未校正其他变量时,FI-1及FI-2临界值确定衰弱为总不良结局的危险因素(HR=4.00及HR=2.74,95%CI2.40~6.55及1.73~4.35,P<0.001),而FI-3确定衰弱与不良结局无关(HR=2.58,95%CI0.95~7.02,P=0.063)。调整年龄及性别后,FI-1及FI-2确定衰弱仍与不良结局相关(HR=3.25及HR=2.21,95%CI1.92~5.51及1.34~3.64,P<0.01),进一步调整年龄、性别及共病后,FI-1确定衰弱仍是不良结局的独立危险因素(HR=2.38,95%CI1.35~4.19,P=0.003),而 FI-2确定衰弱与不良结局无关(HR=1.63,95%CI0.96~2.77,P=0.068;表2)。
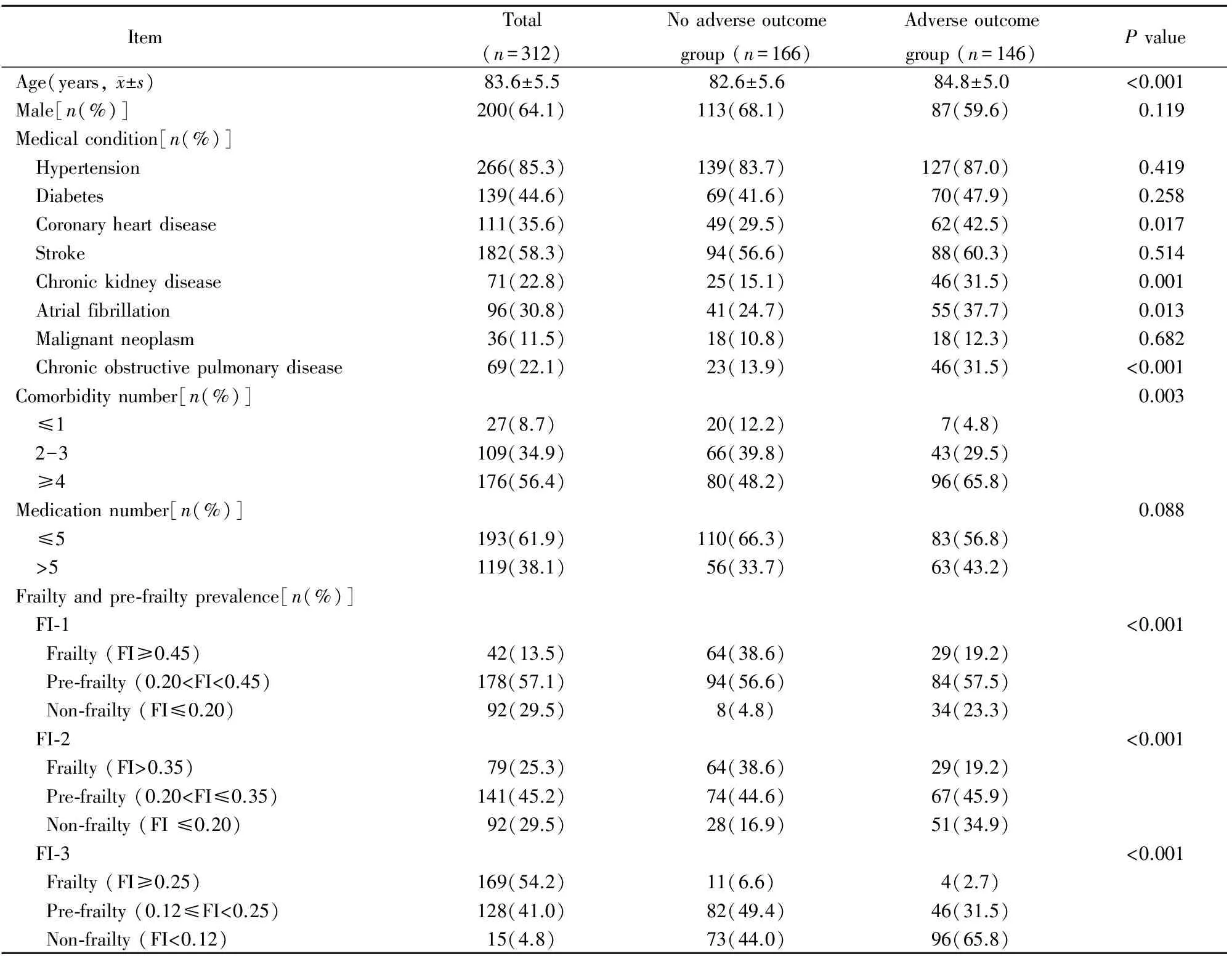
表1 发生不良事件与未发生不良事件组研究对象基线特征
FI: frailty index; FI-1: non-frailty(FI≤0.20), pre-frailty(0.20
2.3 FI不同临界值确定的衰弱对不良结局及死亡的预测效果
FI-1、FI-2和FI-3预测不良结局的AUC分别为0.685、0.673及0.644,预测死亡的AUC分别为0.747、0.731及0.647,表明FI-1和FI-2预测效果优于FI-3(表3)。
3 讨 论
衰弱指数涵盖多维度的健康缺陷变量,从整体的角度对衰弱进行描述,健康缺陷累积越多,即FI值越大,则个体衰弱程度越严重[9-11]。FI为连续变量,目前没有明确的临界值来区分无衰弱、衰弱前期及衰弱。已有学者[6,7,14]在社区人群中采用不同的FI临界值进行研究,结果显示各自所采用的临界值评估的衰弱可预测死亡等不良结局。本研究中312例住院老年患者FI分布范围为0.06~0.61,3个FI衰弱临界值(FI≥0.45、FI>0.35和FI≥0.25)衰弱的检出率分别为13.5%、25.3%及54.2%,提示FI临界值越低,衰弱检出率越高。
Saum等[6]采用衰弱指数法对9886名社区老年人群进行衰弱评估,依据FI值将研究人群分为3组:0
FI是连续性变量,目前采用的临界值均为试验性的,能有效预测社区人群死亡风险的FI临界值不一定适用于老年住院患者。本研究观察了住院老年患者出院6个月后不良结局发生与FI临界值的关系,因本研究死亡病例数量少,无法完成回归分析,故将4个不良事件(跌倒、骨折、再入院及死亡)合并为总不良结局进行Cox回归分析,结果显示,在校正了年龄、性别后,FI≥0.45(FI-1)及FI>0.35(FI-2)临界值判定的衰弱是不良结局的独立危险因素,进一步校正共病因素后,只有FI-1确定的衰弱仍与不良结局有关, 而FI-2确定衰弱与不良结局的关系较弱。FI-3无论是在校正年龄、性别和共病等因素后,还是单独分析,均显示0.25临界值判断的衰弱与总不良结局无关。ROC曲线显示,FI-1及FI-2预测死亡风险的AUC分别为0.747及0.731,提示FI≥0.45和FI>0.35临界值可预测本研究对象出院6个月后的死亡。一般认为FI>0.45是严重衰弱的切点值[18],其在本组患者中预测能力最强,与该临界值筛查出严重衰弱患者有关。FI-3预测不良结局或死亡的AUC均<0.7(分别为0.644及0.647),其预测能力显著低于FI-1及FI-2。2017年颁布的《老年患者衰弱评估与干预中国专家共识》[15]推荐FI≥0.25为判定衰弱的临界值,而本研究结果提示,该FI临界值预测住院老年患者不良结局效果不佳,可能该临界值更适用于社区人群。FI-1及FI-2预测总不良结局的AUC分别为0.685及0.673,未能显现出与预测死亡一样的效果,不良结局包括死亡、跌倒、骨折、再入院,本组患者中再入院发生比例较高(39.4%),可能对预测能力的评价有干扰,因为在我国现有医疗环境下,住院指征的掌握并不严格,再入院的患者中可能混有不需要住院的人,亦与本研究随访时间短有关。
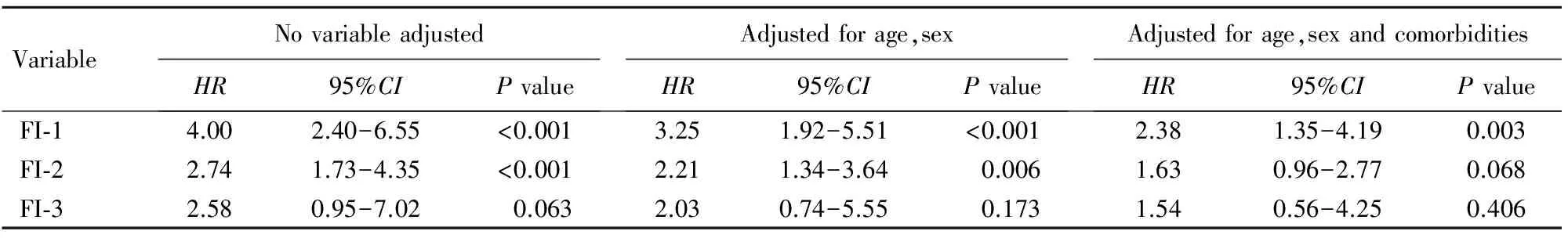
表2 FI不同临界值确定的衰弱与不良结局发生的关系
FI: frailty index; FI-1: non-frailty(FI≤0.20), pre-frailty(0.20
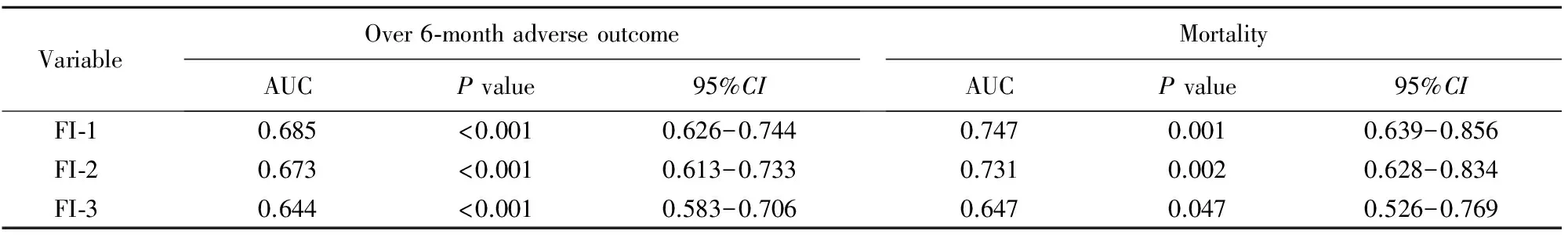
表3 FI不同临界值确定的衰弱对出院6个月后患者不良结局及死亡的预测能力
FI: frailty index; AUC: area under curve; FI-1: non-frailty(FI≤0.20), pre-frailty(0.20
本研究存在局限性包括单中心住院患者、样本量偏少、随访时间短、硬终点死亡人数较少以及难以确定合适的FI临界值。总之,针对老年住院患者,FI不同临界值筛查出的衰弱比例差异较大;衰弱指数可预测老年住院患者出院6个月后的不良健康结局,预测死亡风险的能力与FI衰弱临界值相关,FI>0.35和FI≥0.45判定衰弱的预测能力好于FI≥0.25。本研究结果仅适于住院老年患者,不能外推其他老年人群,还有待于针对更多的老年人群进行前瞻性研究,筛选出适合我国不同老年人群的确定衰弱的FI临界值。
【参考文献】
[1] Clegg A, Young J, Iliffe S,etal. Frailty in elderly people[J]. Lancet, 2013, 381(9868): 752-762. DOI: 10.1016/S0140-6736(12)62167-9.
[2] Strandberg TE, Pitkala KH, Tilvis RS. Frailty in older people[J]. Eur Geriatr Med, 2011, 2(6): 344-355. DOI: 10.1016/j.eurger.2011.08.003.
[3] Fried LP, Tangen CM, Walston J,etal.Frailty in older adults: evidence for a phenotype[J]. J Gerontol A Biol Sci Med Sci, 2001, 56(3): M146-156. DOI: 10.1093/gerona/56.3.M146.
[4] Mitnitski AB, Mogilner AJ, Rockwood K.Accumulation of deficits as a proxy measure of aging[J].Sci World J, 2001, 1: 323-336. DOI: 10.1100/tsw.2001.58.
[5] Theou O, Brothers TD, Mitnitski A,etal.Operationalization of frailty using eight commonly used scales and comparison of their ability to predict all-cause mortality[J]. J Am Geriatr Soc, 2013, 61(9): 1537-1551. DOI: 10.1111/jgs.12420.
[6] Saum KU, Dieffenbach AK, Müller H. Frailty prevalence and 10-year survival in community-dwelling older adults: results from the ESTHER cohort study[J]. Eur J Epidemiol, 2014, 29(3): 171-179. DOI: 10.1007/s10654-014-9891-6.
[7] Kulminski AM, Svetlana SV, Kulminskaya IV,etal.Cumulative deficits better characterize susceptibility to death in elderly people than phenotypic frailty: lessons from the Cardiovascular Health Study[J]. J Am Geriatr Soc, 2008, 56(5): 898-903. DOI: 10.1111/j.1532-5415.2008.01656.x.
[8] KDIGO. KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease[J]. Kidney Int Suppl, 2013, 3(1): 1-150.
[9] Rockwood K, Mitnitski A. Some mathematical models of frailty and their clinical implications[J]. Rev Clin Gerontol, 2002, 12(2): 109-117. DOI: 10.1017/S0959259802012236.
[10] Rockwood K, Song X, MacKnight C,etal. A global clinical mea-sure of fitness and frailty in elderly people[J].CMAJ, 2005, 173(5): 489-495. DOI: 10.1503/cmaj.050051.
[11] Searle SD, Mitnitski A, Gahbauer EA,etal. A standard procedure for creating a frailty index[J]. BMC Geriatr, 2008, 8(1): 24. DOI: 10.1186/1471-2318-8-24.
[12] 中华医学会老年医学分会老年神经病学组,老年人认知障碍诊治专家共识撰写组. 中国老年人认知障碍诊治流程专家建议[J]. 中华老年医学杂志, 2014, 33(8): 817-825. DOI: 10.3760/cma.j.issn.0254-9026.2014.08.001.
Geriatric Neurology Group of the Geriatrics Branch of the Chinese Medical Association, Expert Consensus Group on Diagnosis and Treatment of Cognitive Impairment in the Elderly. Chinese experts′ recommendation on the diagnosis and treatment of cognitive impairment in the elderly[J]. Chin J Geriatr, 2014, 33(8): 817-825. DOI: 10.3760/cma.j.issn.0254-9026.2014.08.001.
[13] Guigoz Y, Vellas B, Garry PJ.Assessing the nutritional status of the elderly: the Mini-Nutritional Assessment as part of the geria-tric evaluation[J].Nutr Rev, 1996, 54(1): 59-65. DOI: 10.1111/j.1753-4887.1996. tb03793.x.
[14] Song X, Mitnitski A, Rockwood K. Prevalence and 10-year outcomes of frailty in older adults in relation to deficit accumula-tion[J]. J Am Geriatr Soc, 2010, 58(4): 681-687. DOI: 10.1111/j.1532-5415.2010.02764.x.
[15] 郝秋奎, 李峻, 董碧蓉, 等. 老年患者衰弱评估与干预中国专家共识[J]. 中华老年医学杂志, 2017, 36(3): 251-256. DOI: 10.3760/cma.j.issn.0254-9026.2017.03.007.
Hao QK, Li J, Dong BR,etal. Chinese experts consensus on assessment and intervention for elderly patients with frailty[J]. Chin Geriatr, 2017, 36(3): 251-256. DOI: 10.3760/cma.j.issn.0254-9026.2017.03.007.
[16] Wians FH. Clinical laboratory tests: which, why, and what do the results mean?[J]. Lab Med, 2009, 40(2): 105-113. DOI: 10.1309/LM4O4L0HHUTWWUDD.
[17] Dent E, Chapman I, Howell S,etal. Frailty and functional decline indices predict poor outcomes in hospitalized older people[J]. Age Ageing, 2014, 43(4): 477-484. DOI: 10.1093/ageing/aft181.
[18] Rockwood K, Song X, MacKnight C,etal.A global clinical measure of fitness and frailty in elderly people[J]. CMAJ, 2005, 173(5): 489-495. DOI: 10.1503/cmaj.050051.
