水稻金属硫蛋白基因(rgMT)遗传转化的紫花苜蓿耐盐性分析
2018-05-23李国良金淑梅
徐 畅,何 好,李国良,金淑梅
(1.东北林业大学东北盐碱植被恢复与重建教育部重点实验室,黑龙江 哈尔滨 150040;2.黑龙江省农业科学院玉米研究所,黑龙江 哈尔滨 150068)
紫花苜蓿(Medicagosativa)素有“牧草之王”和“维他命饲料”的美称,是世界上利用最早、栽培最广的一种优良豆科牧草[1-2],紫花苜蓿多数属盐碱敏感型[3],适宜在轻度盐碱土壤中种植[4],50~200 mmol·L-1NaCl胁迫就会显著降低紫花苜蓿的产量[5],NaCl浓度为0.6%时,试管苗不能生根[6]。在高盐条件下,植物的光合作用减弱,生长受到抑制,严重时会出现植株萎蔫,甚至死亡现象[7]。在我国北方盐碱土主要是碱性盐,碱性盐对植物的危害作用很大程度上有别于中性盐,表现出比中性盐更大的生态破坏力[8]。
近年来,一些与植物耐盐机制有关的基因相继被克隆并用于转基因研究中,这些基因的表达不同程度地提高了转基因植物的耐盐能力。1986年,Deak等[9]首次利用转基因技术获得了抗性苜蓿植株,此后利用基因工程技术提高苜蓿抗逆性已成为苜蓿育种的重要途径[10-15]。金属硫蛋白基因能够提高植物的抗盐碱性,金属硫蛋白是一种机体内的快速反应应激蛋白,被认为是清除羟自由基最强的生物活性物质之一[16]。金属硫蛋白(metallothioneins,MTs)最初是从马的肾脏中提取出来的一类富含半胱氨酸的蛋白质[17],植物金属硫蛋白分为4类:Ⅰ型、Ⅱ型、Ⅲ型和Ⅳ型[18]。枣(Ziziphusjujuba)[19]、水稻(Oryzasativa)[20]和大麦(Hordeumvulgare)[21]金属硫蛋白的转录水平在盐和干旱处理后显著上调,说明该基因与盐有一定的应答关系。从虎尾草(Chlorisvirgata)[22]、碱茅(Pucclinelliadistans)[23]、碱蓬(Suaedaglauca)[24]等植物中克隆出的Ⅱ型金属硫蛋白遗传转化到酵母和拟南芥(Arabidopsisthaliana)中,能提高转基因酵母和拟南芥的抗性。
2014年,Jin等[25]从水稻中克隆出一个金属硫蛋白基因(rgMT,登录号:S57768),研究发现该基因能提高植物的抗盐碱性。“农菁1号”苜蓿是利用零磁空间选育的适合东北地区种植的、抗寒、抗病、生物产量高的优质紫花苜蓿品种[26],紫花苜蓿多数属盐碱敏感型,为了获得耐盐性更强的转基因苜蓿,本研究将rgMT基因通过农杆菌介导法遗传转化到苜蓿品种“农菁1号”中,在保持该品种优质、高产的条件下,进一步提高苜蓿的耐盐碱性,对提高盐碱地区紫花苜蓿种植面积、提高苜蓿产量及利用大面积盐碱荒地具有重要意义。
1 材料和方法
1.1 材料
1.1.1植物材料 黑龙江省农业科学院草业所提供的紫花苜蓿品种“农菁1号”为转基因受体植物。
1.1.2遗传转化所用的菌株 利用东北林业大学东北盐碱植被恢复与重建教育部重点实验室保存的pMD18-T-rgMT质粒,通过PCR技术在rgMT(带终止子TAA)读码框的前后添加BamH1和SacI酶切位点后连接到pMD18-T载体上,将添加BamH1和SacI位点的rgMT的T载和以35S为启动子的植物表达载体pBI121分别进行双酶切,胶回收后利用T4连接酶 (Takara,Japan) 将rgMT基因连接到植物表达载体pBI121上,再利用电击法将pBI121-rgMT质粒转化到根癌农杆菌菌株EH105中,用东北林业大学东北盐碱植被恢复与重建教育部重点实验室已经建立的苜蓿遗传转化方法[27],获得了转rgMT基因苜蓿株系,以T0代筛选出的转基因植株分别单株自交产生的T3代种子作为试验材料。
1.2 转基因苜蓿的鉴定
1.2.1PCR检测 以质粒DNA为阳性对照,以野生型植株为阴性对照,选出9株具有卡那霉素抗性、生长健壮的转基因植株进行检测,当T1代植株生长至4~5枚叶片时,摘取植株上部的幼嫩叶片,用CTAB法提取植物的DNA,进行PCR扩增检测。扩增产物用1%琼脂糖凝胶电泳分离,通过观察特异条带的有无,判断目的基因是否存在。PCR检测体系为20 μL,上游引物序列为:5′-ATGTCTTGCAGCTGTGGATCT-3′,下游引物序列为:5′-TTAGCAGTTGCAAGGGTTGCA-3′,引物由上海生工生物工程公司合成。扩增反应程序为:94 ℃ 5 min;94 ℃ 30 s,52 ℃ 45 s,72 ℃ 45 s,30个循环;72 ℃ 10 min。电泳Marker为Takara公司生产的DL2000。
1.2.2Northern blot检测 为确定rgMT基因在转基因苜蓿中是否稳定表达,采用Trizol提取法提取野生型和转基因植株的总RNA,参照Northern blot的方法[28],以测序正确的rgMT的T载质粒为模板,上游引物序列为:5′-ATGTCTTGCAGCTGTGGATCT-3′,下游引物序列为:5′-TTAGCAGTTGCAAGGGTTGCA-3′,以地高辛标记代替dNTP产生的PCR产物为探针, 进一步对这些转基因株系进行了Northern blot检测分析。
1.3 转基因苜蓿的胁迫处理
1.3.1子叶期苜蓿耐盐碱性表型分析 选择大小一致、籽粒饱满的野生型和转基因的苜蓿种子(#2),6%次氯酸钠消毒15 min,灭菌的蒸馏水冲洗3次,放置在铺有灭菌滤纸的培养皿中,在25 ℃培养箱中浸种,选露白一致的种子,播种到底部打孔的含有草炭土∶蛭石=3∶1的塑料营养钵中,置于温室中,保持相对湿度70%~80%,采用自然光照,昼/夜温度为25 ℃/18 ℃,每盆定苗4株。在苜蓿生长4周,只长子叶没有长出真叶时,选取长势均匀的野生型和转基因苜蓿幼苗,分别用水(CK)、NaCl(200、300、400 mmol·L-1)、NaHCO3(50、100、200 mmol·L-1)胁迫处理2 d,每盆50 mL透灌花盆,每个处理3次重复。
1.3.2幼苗期苜蓿耐盐碱性表型分析 在花盆中栽培8周的野生型和转基因苜蓿(#2)分别选取长势均匀的幼苗,分别用水(CK)、NaCl(200、300、400 mmol·L-1)、NaHCO3(50、100、200 mmol·L-1)胁迫处理15 d,每盆50 mL透灌花盆,每两天补浇50 mL处理液,试验设置3次重复。
1.4 生理指标测定
苗龄8周的野生型和转基因苜蓿经过1.3.2中的NaCl和NaHCO3处理24 h后,取相同部位功能叶片,采用茚三酮法测定脯氨酸含量,电导仪法测定质膜透性,氮蓝四唑光化还原法测定超氧化物歧化酶(SOD)活性[29],紫外分光光度法测定过氧化氢(H2O2)含量[30],取3次重复的平均值进行统计。
1.5 数据分析
将所有试验数据录入Microsoft Excel 2016进行整理、计算并作图。再通过SPSS 17.0统计软件对数据进行单因素方差分析和多重比较。
2 结果与分析
2.1 转基因苜蓿的鉴定
2.1.1PCR检测 选出9株具有卡那霉素抗性、生长健壮的转基因植株进行PCR扩增检测,其中6株转基因苜蓿DNA和质粒DNA扩增出200 bp左右的目的片段条带,而野生型苜蓿DNA和3株转基因苜蓿DNA则没有扩增出目的条带 (图1 ),初步表明,已经获得了rgMT基因整合到农菁1号苜蓿基因组中的转基因苜蓿株系。

图1 转rgMT基因抗性植株的PCR鉴定Fig. 1 PCR identification of resistant plants transformed with the rgMT gene
M: 2 000 bp marker;CK+: 阳性对照;CK-:阴性对照;#1-#9: 转基因植株。
M: 2 000 bp marker;CK+: Positive control;CK-: Negative control;#1-#9: Transgenic plants.
2.1.2Northern blot检测 对PCR阳性植株进行Northern blot分析,野生型苜蓿为对照,苜蓿rgMT全长基因标记为探针,检测rgMT基因在转基因苜蓿中的表达情况(图2),杂交结果表明,野生型苜蓿总RNA未与探针杂交出条带,#1和#8杂交出淡淡的条带,#2,#4,#5,#7杂交出的带型比较明显,尤其是#2转基因苜蓿,这说明被检测的7个株系中基因均稳定表达,rgMT基因成功遗传转化到紫花苜蓿中,获得了稳定遗传的转基因株系。
2.2 苜蓿耐盐碱表型分析
2.2.1子叶期苜蓿耐盐碱表型分析 在没有胁迫处理的条件下,野生型与转基因苜蓿的叶形态都较为正常,生长未受到抑制,两者之间没有差异。在200和300 mmol·L-1NaCl,50和100 mmol·L-1NaHCO3胁迫下,野生型与转基因苜蓿的生长均受到抑制,野生型苜蓿的子叶生长受抑制比转基因苜蓿更明显,但叶色均无明显变化。在400 mmol·L-1NaCl,200 mmol·L-1NaHCO3胁迫下,野生型与转基因的叶色变黄,生长受到了严重的抑制,野生型子叶生长更缓慢,出现干黄甚至死亡,而转rgMT基因的植株受胁迫比野生型轻(图3)。
2.2.2幼苗期转基因苜蓿耐盐碱性表型分析 对照组野生型与转基因苜蓿的生长都较为正常,两者之间没有明显差异(图4)。200 mmol·L-1NaCl,50 mmol·L-1NaHCO3胁迫下,野生型与转基因苜蓿生长受到抑制,野生型和转基因苜蓿叶片变黄,野生型受伤害明显,在300和400 mmol·L-1NaCl,100和200 mmol·L-1NaHCO3胁迫条件下,野生型与转基因苜蓿生长都受到了严重的抑制,野生型的叶片变黄、萎蔫甚至死亡,而转基因株系还带绿色叶片,有存活的植株。可以看出,转基因株系的抗逆性高于野生型。
2.3 苜蓿盐胁迫下各种生理指标的变化
2.3.1盐胁迫下苜蓿脯氨酸含量变化 将野生型植株与转基因植株分别用不同浓度的NaCl和NaHCO3胁迫处理后,检测其脯氨酸的积累情况(图5)。结果发现,没有胁迫处理的情况下,野生型植株与转基因植株的脯氨酸含量无明显差异(P>0.05)。在盐处理的情况下,野生型植株与转基因植株的脯氨酸含量均有所提高,盐胁迫对苜蓿叶片中脯氨酸的影响显著(P<0.05),转基因植株比野生型植株的脯氨酸量积累的多,说明rgMT转化紫花苜蓿在盐胁迫的条件下积累更多的脯氨酸来抵御外界不利的条件。

图2 转rgMT抗性植株的Northern blot鉴定Fig. 2 Northern blot identification of resistant plants transformed with the rgMT gene
WT: 非转基因植株;#1~#8: 转基因植株;下同。
WT: wild type plant;#1~#8: transgenic plants; similarly for the following figures.

图3 逆境胁迫下野生型植株和转基因植株子叶期的生长状况Fig. 3 The performance of wild-type plants and transgenic plants under stress at the cotyledon stage

图4 逆境胁迫下野生型植株和转基因植株幼苗期的生长状况Fig. 4 The performance of wild-type plants and transgenic plants under stress at the seedling stage
左:野生型植株;右:转基因植株。
Left:Wild type plant; Right:Transgenic plant.

图5 氯化钠和碳酸氢钠胁迫对苜蓿脯氨酸含量的影响Fig. 5 Effects of sodium chloride and sodium bicarbonate stresses on the proline content in Medicago sativa
“*”表示转基因植株与野生型植株之间差异显著(P<0.05),下同。
“*” indicate significant difference between wild type plant and transgenic plant under stress at the 0.05 level; similarly for the following figuers.
2.3.2盐胁迫下苜蓿SOD活性检测 在没有逆境胁迫处理的情况下,野生型植株与转基因植株的SOD活性无明显差异,在盐胁迫下二者的SOD活性均有提高(图6),转基因植株比野生型植株的SOD活性高,说明盐处理条件下苜蓿体内表达的rgMT基因对苜蓿体内抗氧化酶系统的活性有一定的影响。
2.3.3盐胁迫下苜蓿叶片相对质膜透性分析 在没有逆境胁迫条件下,野生型植株与转基因植株叶片中的相对电导率基本相同,即二者的细胞膜透性差异不显著(P>0.05),在盐胁迫条件下,二者的相对电导率均迅速升高(P<0.05),说明盐处理对二者的细胞膜均有伤害,但转基因植株叶片的相对电导率低于野生型植株,说明在NaCl和NaHCO3胁迫条件下,转rgMT基因株系较非转基因株系的细胞膜具有较强的生理活性,即转基因苜蓿的细胞膜在盐胁迫下受到的伤害比非转基因植株小(图7)。
2.4 盐胁迫下苜蓿H2O2含量变化
在胁迫条件下,植物细胞会产生大量的活性氧, 金属硫蛋白基因具有清除活性氧的功能,植物中的活性氧含量的多少可以通过测量H2O2含量的多少来体现。在没有盐胁迫的条件下,野生型的苜蓿和转基因苜蓿中的H2O2的含量没有明显的差异(P>0.05),在盐胁迫条件下,二者的H2O2含量均迅速升高(P<0.05),但转基因植株的H2O2含量明显低于野生型植株,说明转基因苜蓿中由于活性氧所带来的对植物伤害要少于野生型苜蓿体内的活性氧伤害(图8)。
3 讨论与结论
以往的研究报道表明,在早期对紫花苜蓿进行耐盐筛选最为合适,因为紫花苜蓿在发芽期和苗期对盐分比较敏感[31],盐、碱胁迫与温度交互作用对黄花苜蓿种子萌发的影响研究发现,黄花苜蓿对碱性盐和高pH有一定的耐受性[32]。紫花苜蓿苗期对盐分反应较发芽期更为敏感[33],并且转AtDREB2A基因的苜蓿在幼苗期受到NaHCO3胁迫后,明显比未转基因的苜蓿提高了耐碱性[34],因此本研究选择苜蓿生长的苗期进行植物的各种耐盐碱性研究。

图6 氯化钠和碳酸氢钠胁迫对苜蓿SOD活性的影响Fig. 6 Effects of sodium chloride and sodium bicarbonate stresses on the SOD activity in Medicago sativa
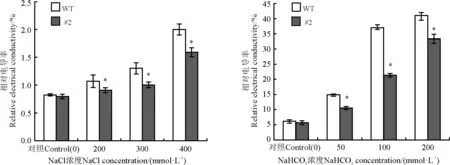
图7 氯化钠和碳酸氢钠胁迫胁迫对苜蓿叶片细胞膜透性的影响Fig. 7 Effects of sodium chloride and sodium bicarbonate stresses on the relative membrane permeability in Medicago sativa leaves
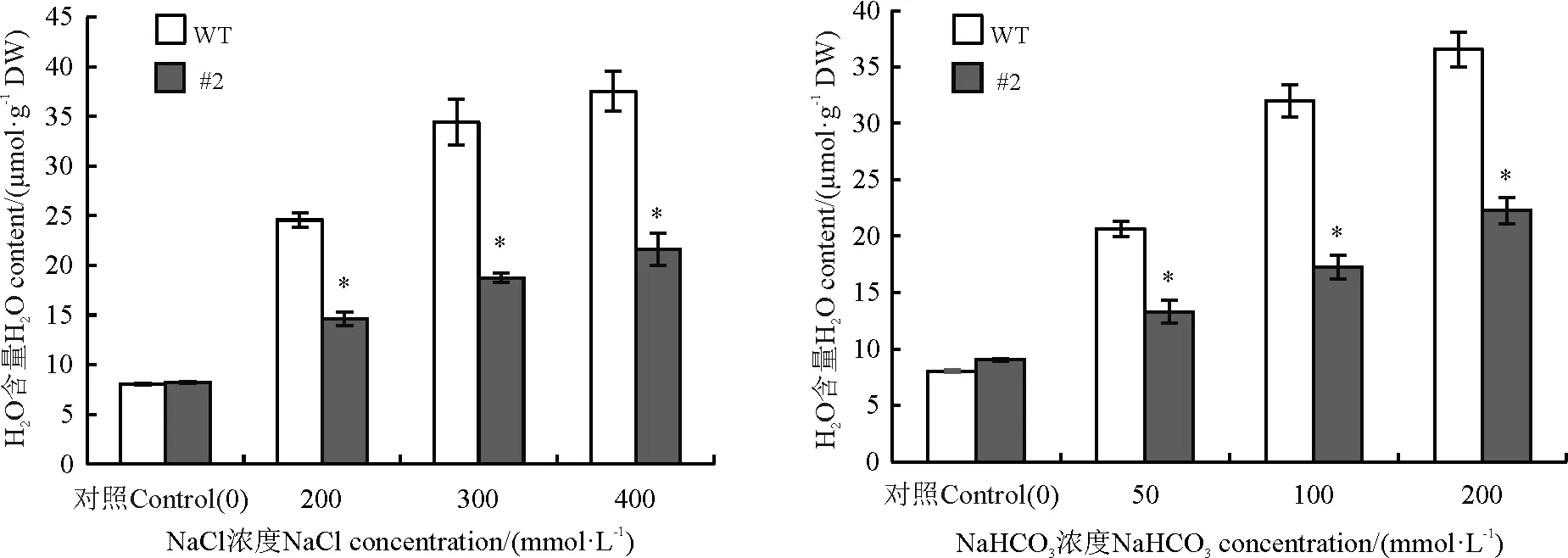
图8 氯化钠和碳酸氢钠胁迫对苜蓿H2O2含量的影响Fig. 8 Effects of sodium chloride and sodium bicarbonate stresses on the H2O2 content in Medicago sativa
在本研究的各种逆境处理下,转rgMT基因苜蓿的生长要明显优于野生型,这说明水稻金属硫蛋白rgMT基因在苜蓿中发挥了功能,从而提高了植物的抗逆性。植物的抗逆性是由多基因控制的数量性状,植物对逆境耐性的强弱往往不取决于某一单个因子,其性状受众多因子的综合影响。转录因子WRKY20基因过量表达的转基因苜蓿对高盐抵御能力增强,这是因为该基因调控其他基因的表达而改变苜蓿抵抗外界环境的能力[35]。蛋白激酶GsCRCK基因转化的“农菁1号”苜蓿在300和400 mmol·L-1NaCl处理条件下,转基因苜蓿仍能正常生长而野生型苜蓿则遭受严重盐害,蛋白激酶是在信号转导网络中起调控作用的蛋白质因子,尤其其单基因的表达就可以激活下游众多功能基因的转录和表达,达到多个功能基因共同作用的效果[36]。金属硫蛋白基因能够提高植物的抗逆性,可能这个基因转入植物体内,在逆境条件下,不仅自身发挥功能,还能够激发其他与逆境有关的基因表达,共同提高转基因植物的抗性。到底是rgMT基因在植物抗逆中起到主导作用,还是该基因激发其他基因的连锁反应进而提高植物的抗逆境的能力,有待于进一步的研究。
脯氨酸在正常情况下含量往往很低,在盐胁迫等逆境条件下合成反应被激活。有研究表明,植物体内游离脯氨酸的含量与植物的抗逆性呈正相关关系[37],但也有研究报道,脯氨酸的积累与耐盐程度呈负相关关系[38]。本研究中转基因苜蓿叶片中的脯氨酸含量显著高于对照,这与脯氨酸的积累与耐盐程度呈正相关关系的报道相一致。
植物组织受到逆境伤害时,由于膜的功能受损或结构破坏,而使其透性增大。即细胞膜透性大小也能够反映出细胞质膜受害的程度[29]。本研究表明,盐胁迫下转基因苜蓿和野生型苜蓿的细胞膜透性都在增大,但对转基因苜蓿细胞膜透性的影响明显小于对非转基因型苜蓿的影响。说明盐胁迫下转基因苜蓿的细胞受到的伤害较非转基因型苜蓿小,即其抗盐胁迫能力好于非转基因苜蓿。
SOD是保护膜系统的关键酶,在植物抗氧化胁迫中具有清除氧自由基、防止膜脂过氧化,维持活性氧代谢平衡的功能[39]。本研究表明,盐胁迫下转基因苜蓿和野生型苜蓿的SOD含量都在增加,转基因苜蓿体内SOD含量要高于野生型苜蓿SOD含量,说明转基因苜蓿比野生型苜蓿具有更高的抗氧化能力。
活性氧发生在植物生长和发育的各个阶段,并且当植物在生物和非生物逆境胁迫的条件下活性氧的浓度会升高,产生氧化胁迫。在100 mmol·L-1NaHCO3处理条件下,转野生大豆(Glycinesoja)GsGST19基因苜蓿株系生长状态良好,而非转基因对照株系明显萎蔫、失绿,甚至死亡,与GsGST19基因具有过氧化物酶活性,能清除多余的活性氧有关[40]。有报道称,金属硫蛋白基因也与活性氧清除相关,能直接移走活性氧保护植物不受伤害[41-43],将rgMT基因遗传转化到苜蓿体内,也可能是由于rgMT基因的表达,有助于清除植物在逆境条件下产生的多余活性氧,从而提高了苜蓿的抗盐碱能力。
本研究将rgMT基因转入“农菁1号”紫花苜蓿,获得了7个转基因株系,在NaCl和NaHCO3胁迫的情况下,转基因苜蓿的生长要好于野生型苜蓿,盐胁迫后转基因苜蓿的脯氨酸含量和SOD活性均高于野生型,相对电导率低于野生型,转基因苜蓿体内活性氧含量也明显少于野生型苜蓿,表明rgMT基因在“农菁1号”苜蓿中的过表达明显提高了转基因苜蓿的耐盐性,有利于耐盐碱苜蓿新品种的选育。
参考文献References:
[1] 李善家,韩多红,王恩军,武燕.外源甜菜碱对盐胁迫下黑果枸杞种子萌发和幼苗保护酶活性的影响.草业科学,2016,33(4):674-680.
Li S J,Han D H,Wang E J,Wu Y.Effects of exogenous betaine on seed germination and antioxidase activities ofLyciumrutheniumseedlings under NaCl stress.Pratacultural Science,2016,33(4):674-680.(in Chinese)
[2] 王鑫,马永祥,李娟.紫花苜蓿营养成分及主要生物学特性.草业科学,2003,20(10):39-41.
Wang X,Ma Y X,Li J.The nutrient content and major biological characters ofMadicagosativa.Pratacultural Science,2003,20(10):39-41.(in Chinese)
[3] Osborn T,Brouwer D,McCoy T.Molecular marker analysis of alfalfa.//McKersie B B D.(eds.).Biotechnology and the Improvement of Forage Legumes.Wallingford:CABI Publishing,1997:91-109.
[4] 姜健,杨宝灵,夏彤,于淑梅,乌云娜.紫花苜蓿耐盐种质资源的遗传多样性分析.草业学报,2011,20(5):119-125.
Jiang J,Yang B L,Xia T,Yu S M,Wu Y N.Analysis of genetic diversity of salt tolerant alfalfa germplasms.Acta Prataculturae Sinica,2011,20(5):119-125.(in Chinese)
[5] 张立全,张凤英,哈斯阿古拉.紫花苜蓿耐盐性研究进展.草业学报,2012,21(6):296-305.
Zhang L Q,Zhang F Y,Hasiagula.Research progress on alfalfa salt tolerance.Acta Prataculturae Sinica,2012,21(6):296-305.(in Chinese)
[6] 刘艳芝,韦正乙,邢少辰,谭化,高明,董英山.HAL1基因转化苜蓿再生植株及其耐盐性.吉林农业科学,2008,33(6):21-24.
Liu Y Z,Wei Z Y,Xing S C,Tan H,Gao M,Dong Y S.Transgenetic alfalfa withHAL1 gene and its salt tolerance.Journal of Jilin Agricultural Sciences,2008,33(6):21-24.(in Chinese)
[7] 侯建建,白春生,张庆,玉柱.单一和复合乳酸菌添加水平对苜蓿青贮营养品质及蛋白组分的影响.草业科学,2016,33(10):2119-2125.
Hou J J,Bai C S,Zhang Q,Yuzhu.Effects of different additive amount of single and multiplel actic acid bacteriaon the silage quality and protein fractions of alfalfa.Pratacultural Science,2016,33(10):2119-2125.(in Chinese)
[8] 李波,赵洪波,杨蔚然,李红.NaHCO3胁迫对苜蓿苗期适应性的影响.种子,2010,29(2):22-25.
Li B,Zhao H B,Yang W R,Li H.Effect of adaptive capacity of alfalfa seedlings to NaHCO3stress.Seed,2010,29(2):22-25.(in Chinese)
[9] Deak M,Kiss G B,Koncz C,Dudits D.Transformation ofMedicagoby agrobacterium mediated gene transfer.Plant Cell Report,1986,5(2):97-100.
[10] Bao A K,Wang S M,Wu G Q,Xi J J,Zhang J L,Wang C M.Over expression of the arabidopsis H+-ppase enhanced resistance to salt and drought stress in transgenic alfalfa (MedicagosativaL.).Plant Science,2009,176(2):232-240.
[11] Verdoy D,De La Pena T C,Redondo F J,Lucas M M,Pueyo J J.TransgenicMedicagotruncatulaplants that accumulate proline display nitrogen-fixing activity with enhanced tolerance to osmotic stress.Plant Cell and Environment,2006,29(10):1913-1923.
[12] Liu L,Fan X D,Wang F W,Wang N,Dong Y Y,Liu X M,Yang J,Wang Y F,Li H Y.Coexpression ofscnhx1 andscvpin transgenic hybrids improves salt and saline-alkali tolerance in alfalfa (MedicagosativaL.).Journal of Plant Growth Regulation,2013,32(1):1-8.
[13] Wang Z Y,Song F B,Cai H,Zhu Y M,Bai X,Ji W,Li Y,Hua Y.Over-expressinggsgst14 fromGlycinesojaenhances alkaline tolerance of transgenicMedicagosativa.Biologia Plantarum,2012,56(3):516-520.
[14] Li W F,Wang D L,Jin T C,Chang Q,Yin D X,Xu S M,Liu B,Liu L X.The vacuolar Na+/H+antiporter genessnhx1 from the halophyteSalsolasodaconfers salt tolerance in transgenic alfalfa (MedicagosativaL.).Plant Molecular Biology Reporter,2011,29(2):278-290.
[15] Zhang Y M,Zhang H M,Liu Z H,Li H C,Guo X L,Li G A.The wheat nhx antiporter genetanhx2 confers salt tolerance in transgenic alfalfa by increasing the retention capacity of intracellular potassium.Plant Molecular Biology,2015,87(3):317-327.
[16] 代勋,龚明.植物金属硫蛋白在植物抗逆性中的作用.宁夏师范学院学报,2011,32(3):47-51.
Dai X,Gong M.The function of plant metallothioneins in plant resistence.Journal of Ningxia Teachers University (Natural Science),2011,32(3):47-51.(in Chinese)
[17] Margoshes M,Vallee B L.A cadmium protein from equine imaging hyperintensity in Alzheimer’s disease:Correlation with kidney cortex.Journal of American Chemical Society,1957,79:4813-4814.
[18] Cobbett C,Goldsbrough P.Phytochelatins and metallothioneins:Roles in heavy metal detoxification and homeostasis.Annual Review of Plant Biology,2002,53:159-182.
[19] Yang M X,Zhang F,Wang F,Dong Z G,Cao Q F,Chen M C.Characterization of a type 1 metallothionein gene from the stresses-tolerant PplantZiziphusjujuba.International Journal of Molecular Sciences,2015,16(8):16750-16762.
[20] Kawasaki S,Borchert C,Deyholos M,Wang H,Brazille S,Kawai K,Galbraith D,Bohnert H.Gene expression profiles during the initial phase of salt stress in rice.The Plant Cell,2001,13(4):889-905.
[21] Oztur Z N,Talame V,Deyholos M,Michalowski C,Galbraith D,Gozukirmizi N,Tuberosa R,Bohnert H.Monitoring large-scale changes in transcript abundance in drought- and salt-stressed barley.Plant Molecular Biology,2002,48(5-6):551-573.
[22] Nishiuchi S,Liu S,Takano T.Isolation and characterization of a metallothionein-1 protein inChlorisvirgataswartz that enhances stress tolerances to oxidative,salinity and carbonate stress inSaccharomycescerevisiaei.Biotechnology Letters,2007,29(8):1301-1305.
[23] Zhang M,Takano T,Liu S K,Zhang X X.Abiotic stress response in yeast and metal-binding ability of a type 2 metallothionein-like protein (putmt2) fromPuccinelliatenuiflora.Molecular Biology Reports,2014,41(9):5839-5849.
[24] 金淑梅,孙丹,王吉.碱蓬金属硫蛋白基因对碳酸盐胁迫的应答.草业科学,2014,31(11):2082-2087.
Jin S M,Sun D,Wang J.Metallothionein gene (sgMT) fromSuaedaglaucaexpression under saline stress.Pratacultural Science,2014,31(11):2082-2087.(in Chinese)
[25] Jin S M,Sun D,Wang J,Li Y,Wang X W,Liu S K.Expression of thergMTgene,encoding for a rice metallothionein-like protein inSaccharomycescerevisiaeandArabidopsisthaliana.Journal of Genetics,2014,93(3):709-718.
[26] 张月学,唐凤兰,张弘强,韩微波,李道明,刘杰淋,蒿若超,申忠宝,刘录祥.零磁空间处理选育紫花苜蓿品种农菁1号.核农学报,2006,21(1):34-37.
Zhang Y X,Tang F L,Zhang H Q,Han W B,Li D M,Liu J L,Song R C,Shen Z B,Liu L X.Breeding of new variety Nongjing No.1 ofMedicagosativaL. by magnetic field free space.Journal of Nuclear Agricultural Sciences,2006,21(1):34-37.(in Chinese)
[27] 金淑梅,管清杰,罗秋香,王涛,高野哲夫,柳参奎.苜蓿愈伤组织高频再生遗传和转化体系的建立.分子植物育种,2006,4(4):571-578.
Jin S M,Guan Q J,Luo Q X,Wang T,Tetsuo T,Liu S K.Study on high frequency regeneration and transformation system of alfalfa from embryogenic callus.Molecular Plant Breeding,2006,4(4):571-578. (in Chinese)
[28] Sambrook J F,Fritsch E F,Maniatis T.Molecular Cloning:A Laboratory Manual.New York:Cold Spring Harbor Laboratory Press,1989.
[29] 张治安,张美善,蔚荣海.植物生理学实验指导.北京:中国农业科学技术出版社,2004.
Zhang Z A,Zhang M S,Wei R H.Instructional on Plant Physiology.Beijing:China Agricultural Science and Technology Press,2004.(in Chinese)
[30] 邹琦.植物生理学实验指导.北京:中国农业出版社,2000.
Zhou Q.Instructional on Plant Physiology.Beijing:China Agriculture Press,2000.(in Chinese)
[31] Li R L,Shi F C,Fukuda K,Yang Y L.Effects of salt and alkali stresses on germination,growth,photosynthesis and ion accumulation in alfalfa (MedicagosativaL.).Soil Science and Plant Nutrition,2010,56(5):725-733.
[32] 武祎,田雨,张红香,杨健,吴志红.盐碱胁迫与温度对黄花苜蓿种子发芽的影响.草业科学,2015,32(11):1847-1853.
Wu Y,Tian Y,Zhang H X,Yang J,Wu Z H.Effects of salinity,alkalinity,temperature and their interactions on seed germination ofMedicagofalcata.Pratacultural Science,2015,32(11):1847-1853.(in Chinese)
[33] 于卓,孙祥,张文忠,郑淑霞.苜蓿品种间种子萌发及苗期耐盐性差异的研究.干旱区资源与环境,1993,7(2):106-111.
Yu Z,Sun X,Zhang W Z,Zheng S X.Studies on the differences of salt tolerence between seed germination and seedling of alfalfa cultivars.Journal of Arid Land Resources and Environment,1993,7(2):106-111.(in Chinese)
[34] 才华,宋婷婷,张大洋.Rd29a和camv-35s启动子调控转atdreb2a苜蓿耐碱性分析.东北农业大学学报,2016,47(9):16-23.
Cai H,Song T T,Zhang D Y.Alkaline tolerance analysis of transgenic alfalfa withatdreb2agene regulated by Rd29A and camv-35s promoter.Journal of Northeast Agricultural University,2016,47(9):16-23.
[35] Tang L L,Cai H,Zhai H,Luo X,Wang Z Y,Cui L,Bai X.Overexpression ofGlycinesojawrky20 enhances both drought and salt tolerance in transgenic alfalfa (Medicagosativa).Plant Cell Tissue and Organ Culture,2014,118(1):77-86.
[36] 刘莹,才华,刘晶,柏锡,纪巍,朱延明.Gscrck基因转化农菁1号苜蓿及其耐盐性分析.草业学报,2013,22(2):150-157.
Liu Y,Cai H,Liu J,Bai X,Ji W,Zhu Y M.Transformation of theGscrckgene intoMedicagosativacv. Nongjing No.1 and salt tolerance analysis in transgenic plants.Acta Prataculturae Sinica,2013,22(2):150-157.(in Chinese)
[37] 秦峰梅,张红香,武祎,周道玮.盐胁迫对黄花苜蓿发芽及幼苗生长的影响.草业学报,2010,19(4):71-78.
Qing H F,Zhang H X,Wu W,Zhou D W.Effects of salt stress on germination and seedling growth ofMedicagofalcata.Acta Prataculturae Sinica,2010,19(4):71-78.(in Chinese)
[38] Petrusal M W L.Proline status in salt-tolerant and salt-sensitive alfalfa cell lines and plants in response to nacl.Plant Physiology Biochemistry,1997,35(4):303-310.
[39] 张永峰,殷波.混合盐碱胁迫对苗期紫花苜蓿抗氧化酶活性及丙二醛含量的影响.草业学报,2009,18(1):46-50.
Zhang Y F,Yin B.Influences of salt and alkali mixed stresses on antioxidative activity and MDA content ofMedicagosativaat seedling stage.Acta Prataculturae Sinica,2009,18(1):46-50.(in Chinese)
[40] 王臻昱,才华,柏锡,纪巍,李勇,魏正巍,朱延明.野生大豆GsGST19基因的克隆及其转基因苜蓿的耐盐碱性分析.作物学报,2012,38(6):971-979.
Wang Z Y,Cai H,Bai X,Ji W,Li Y,Wei Z W,Zhu Y M.Isolation ofGsGST19 fromGlycinesojaand analysis of saline-alkaline tolerance for transgenicMedicagosativa.Acta Agronomica Sinica,2012,38(6):971-979.(in Chinese)
[41] Xiong L, Schumaker K S,Zhu J K.Cell signaling during cold,drought,and salt stress.Plant Cell,2002,14:165-183.
[42] Wong H L,Sakamoto T,Kawasaki T,Umemura K,Shimamoto K.Down-regulation of metallothionein,a reactive oxygen scavenger,by the small gtpase osrac1 in rice.Plant Physiology,2004,135(3):1447-1456.
[43] Nzengue Y,Steiman R,Rachidi W,Favier A,Guiraud P.Oxidative stress induced by cadmium in the c6 cell line:Role of copper and zinc.Biological Trace Element Research,2012,146(3):410-419.
