频谱边界频率与意识障碍患者临床预后的相关性研究
2018-05-23雷伟健刘锦仪余炳坚广州医科大学附属第六医院清远市人民医院广东清远510000
雷伟健,刘锦仪,余炳坚(广州医科大学附属第六医院,清远市人民医院,广东 清远 510000)
大脑的皮质电活动能反应脑功能状态,是意识的一种表现形式。因此,脑电图(EEG)监测在神经科,麻醉科及重症监护室的应用越来越广泛。常规脑电图的解读需脑电生理的专科知识。但随着计算机技术的快速发展和数字数据传输系统的革命,EEG能够根据将振幅,功率,频率和节律性量化,使得成为数值、比率,或百分比。95%频谱边界频率(95% spectral edge frequency SEF)是脑电监测的一量化指标,可以使无具备脑电图知识的普通医护人员直接、简单地了解患者脑功能状态。意识障碍患者病因各样,预后不一。本研究选择缺血性、出血性脑卒中及心肺复苏后缺血缺氧性脑病意识障碍患者进行脑电监测,以观察95%SEF对临床预后的相关性。
1 资料与方法
1.1一般资料:本研究入组患者为2015年8月~2017年8月在我院神经重症监护室住院治疗的意识障碍患者89例。其中缺血性脑卒中(24例),出血性脑卒中(35例)及心肺复苏后缺血缺氧性脑病(30例)。纳入标准:①符合以觉醒度改变的意识障碍[1];②符合缺血性脑卒中、出血性脑卒中[2]、心肺复苏后缺血缺氧性脑病的诊断标准;③发病24 h内入住神经重症监护室。排除标准:①后循环缺血的缺血性脑卒中;②脑干出血的出血性脑卒中;③躁动不能合作者或其家属拒绝行EEG及SEF检查者;④头皮有破损,不适宜行EEG检查者。
1.2研究方法:入组患者入院后即进行意识障碍程度的判断,同时予格拉斯哥评分(GCS),并予连续脑电监测≥1 h,以采集95%SEF数据。Nicolet公司的脑电监护仪用作脑电监测。电极安装方法采用国际脑电图学会联盟标准,10~20系统,32通道放大器,4电极蒙太奇记录背景脑电(F3,F4,P3,P4),时间基准为30 mm/s,灵敏度10.0 μV/mm,高切70 HZ,低切0,3HZ,阻抗小于10 kQ。当阻抗超10kQ时机器自动报警提示。死亡或发病后1个月为预后判定的终点时间。在预后终点时间进行电话随访,记录患者意识状态,并与入院时意识障碍程度进行比较,根据意识状态的改变把患者发病1个月后的临床预后分为好转、维持、加重或死亡三组。

2 结果
2.1一般情况:89例患者,缺血性脑卒中24例,出血性脑卒中35例,缺血缺氧性脑病30例。男性53例,女性36例。 嗜睡16例,昏睡26例,浅昏迷18例,中昏迷15例,深昏迷14例。详见表1。
表1患者一般资料
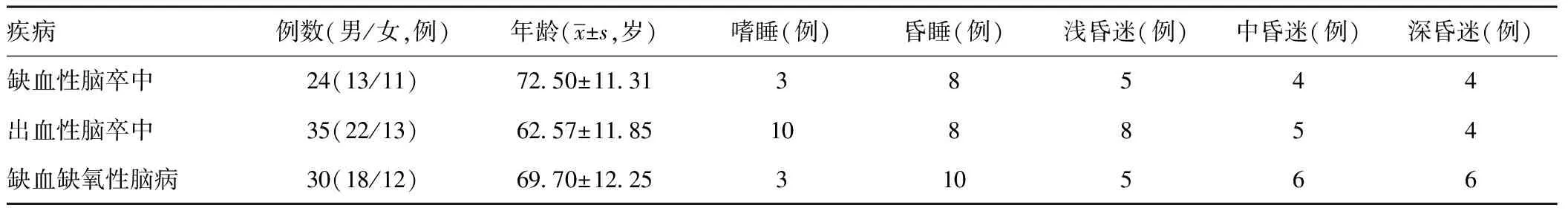
疾病例数(男/女,例)年龄(x±s,岁)嗜睡(例)昏睡(例)浅昏迷(例)中昏迷(例)深昏迷(例)缺血性脑卒中24(13/11)7250±113138544出血性脑卒中35(22/13)6257±1185108854缺血缺氧性脑病30(18/12)6970±1225310566
2.2各意识水平下的95%SEF与GCS结果:95%SEF与GCS评分均呈正相关,与意识障碍程度呈负相关:随着意识障碍程度的逐渐加重,GCS评分及95%SEF逐渐下降,89例患者中,95%SEF 均值为10.53±3.31,GCS均值为7.71±2.99,两者正相关,差异有统计学意义(R=0.899,P<0.001)。 95%SEF与意识障碍程度呈负相关,差异有统计学意义(R=-0.936,P<0.001)。在缺血性脑卒中组中,95%SEF与GCS及意识障碍程度的相关系数分别为0.907及-0.959,差异有统计学意义(P<0.001)。出血性脑卒中组中,95%SEF与GCS及意识障碍程度的相关系数分别为0.933及-0.919,差异有统计学意义(P<0.001)。在心肺复苏后缺血缺氧性脑病组中,95%SEF与GCS及意识障碍程度的相关系数分别为0.878及-0.942,差异有统计学意义(P<0.001)。见表2、表3。
2.389例患者1个月后的临床预后情况:95%SEF与1个月后出血性脑卒中及缺血缺氧性脑病良好预后呈正相关,与缺血性脑卒中的预后无明显相关性。见表4。
89例患者1个月后的临床预后情况见表4。其中,在缺血性脑卒中组24例患者中,12例意识好转,7例意识无明显改善,5例出现意识加重或死亡;出血性脑卒中组35例患者中,18例意识好转,7例意识无明显改善,10例出现意识加重或死亡;缺血缺氧性脑病组30例患者中,13例意识好转,6例意识无明显改善,11例出现意识加重或死亡。对89例患者进行综合分析,得出95%SEF与1个月后良好预后呈正相关(R=0.238,P<0.001)。但对各疾病组进行预后相关性分析中得出,在缺血性脑卒中组,95%SEF与1月后的预后无明显相关(R=0.086,P=0.534)。出血性脑卒中(R=0.292,P=0.009)及缺血缺氧性脑病(R=0.332,P=0.008)组中进行分析,得出95%SEF与1个月后的预后成正相关。

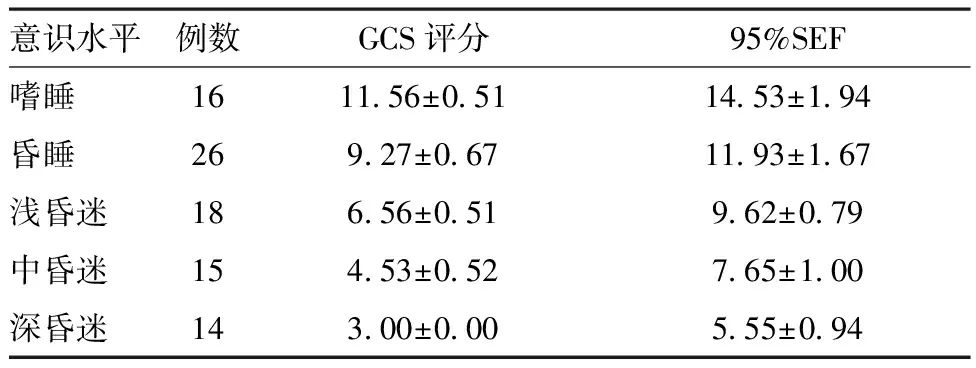
意识水平例数GCS评分95%SEF嗜睡161156±0511453±194昏睡26927±0671193±167浅昏迷18656±051962±079中昏迷15453±052765±100深昏迷14300±000555±094
表395%SEF与GCS及意识障碍程度的相关性
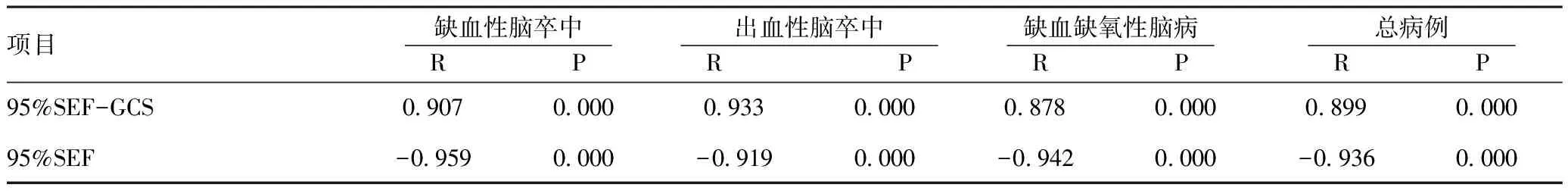
项目缺血性脑卒中 R P 出血性脑卒中 R P 缺血缺氧性脑病 R P 总病例 R P 95%SEF-GCS0907000009330000087800000899000095%SEF-09590000-09190000-09420000-09360000
表4患者1月后临床预后情况[例(%)]
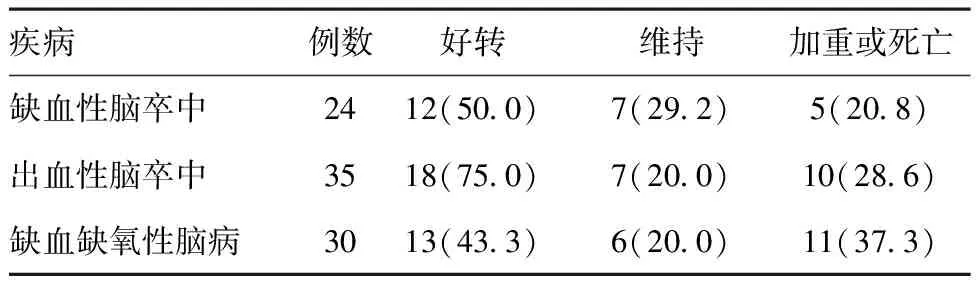
疾病例数好转维持加重或死亡缺血性脑卒中2412(500)7(292)5(208)出血性脑卒中3518(750)7(200)10(286)缺血缺氧性脑病3013(433)6(200)11(373)
3 讨论
脑电图监测在临床上可用于以下方面:①监测癫痫及缺血缺氧性脑病;②监测脑血流;③监测脑缺血;④监测脑功能;⑤监测镇静药物作用;⑥监测降颅压药物作用[2-6]。因此,脑电图监测在重症监护室得到越来越普遍的使用。脑电原始信号通过电极被收集,并经过数字信号处理器,利用快速傅立叶原理计算波形的频谱,将时间-振幅关系的原始脑电信号转换成频率-功率的关系,并在 显示器上显示计算结果。95 % SEF作为脑电信号频谱分析生成的一量化指标,包含了95 %的EEG 功率谱高边界频率。有研究表明,SEF与麻醉镇静深度有较好的相关性[2]。Maksimow等使用EEG频谱熵(Electroencephalogram-based Spectral Entropy)对高剂量(5 ng/ml)和低剂量(0.5 ng/ml)右旋美托咪啶诱导镇静的水平进行了研究[7],结果发现频谱熵在低剂量时由84±5降至66±16,而高剂量时由84±5降至20±12;患者由意识清醒转为意识丧失时,频谱熵由76±8降至43±10,由意识丧失转为意识清醒时,频谱熵由14±4升至63±13。陈璇等对30例意识障碍患者进行SEF与意识障碍程度的相关性研究[8],得出95%SEF与意识障碍程度呈负相关的结果,因此认为95%SEF可作为评价患者意识障碍程度的神经电生理指标。本研究中,95%SEF随着意识水平的下降逐渐减少,与意识障碍程度呈负相关(R=-0.942,P<0.001),与GCS评分呈正相关(R=0.878,P<0.001),这可能与EEG随意识状态的改变而发生相应改变有关。当大脑处在清醒状态时,大脑皮层兴奋,α波、β波等快波成分较多,从而使快波所占的功率值较高,故95 %SEF值较大。相反,但大脑处在困倦、深睡,镇静或昏迷时,大脑皮层功能受到抑制,快波成分减少,慢波成分增多,95 %SEF向较低频处移动,因此,95%SEF值较小。
尽管目前对于意识障碍患者进行预测其预后转归的方法较多,但局限性仍有存在。GCS是目前评估意识障碍严重程度最常用的方法,广泛应用于中枢神经系统损伤和意识障碍状态的评定,但在预测意识障碍患者预后方面,GCS的准确度较差[9]。部分研究表明,EEG能预测意识障碍患者预后转归,但由于预测的精准度差异较大,预测的临床价值有一定的局限性,原因主要和意识障碍患者的病因多样有关。曾彦英等[10]探讨脑电图预测重型颅脑外伤性昏迷患者预后的价值,认为脑电图反应性(EEGR)可以预测颅脑外伤性昏迷患者的预后,若将EEGR联合GCS共同预测颅脑外伤性昏迷患者的预后,则预测的准确度更高。本研究中,95%频谱边界频率与缺血性脑卒的预后无明显相关性,与出血性脑卒中(R=0.292,P=0.009)及缺血缺氧性脑病(R=0.332,P=0.008)1月后良好预后呈正相关,但相关系数均较低,提示95%SEF与出血性脑卒中及缺血缺氧性脑病1月后的预后虽有正相关,但相关性较差。
本组病例没有脑干病变的患者,原因为95 %SEF描记的是大脑皮层的电活动,对于脑干病变引起的意识障碍不敏感。95 %SEF对缺血性脑卒中,出血性脑卒中及心肺复苏后缺血缺氧性脑病所致意识障碍均有明显相关性,但95 %SEF在预测意识障碍患者预后方面因病因不同,从而预测的临床价值不一。
4 参考文献
[1] 贾建平.神经病学[M].北京:人民卫生出版社,2012:69-70,175-192.
[2] Cha K M,Choi B M,Noh G J,et al.Novel Methods for Measuring Depth of Anesthesia by Quantifying Dominant Information Flow in Multichannel EEGs[J].Computational Intelligence and Neuroscience,2017,2017(1):1.
[3] Peng-Fan Yang,Ming-Chao Shang,Qiao Lin,et al. Three-dimensional intracranial EEG monitoring in presurgical assessment of MRI-negative frontal lobe epilepsy[J].Medicine (Baltimore),2016,95(50):e5192.
[4] A Zayachkivsky,MJ Lehmkuhle,JJ Ekstrand,et al. Ischemic injury suppresses hypoxia-induced electrographic seizures and the background EEG in a rat model of perinatal hypoxic-ischemic encephalopathy[J].J Neurophysiol,2015,114(5):2753.
[5] Brenton Hordacre,Nigel C.Rogasch,Mitchell R.Goldsworthy,et al.Commentary:Utility of EEG measures of brain function in patients with acute stroke[J].Front Hum Neurosci,2016,10:621.
[6] Christian Crouzet,Robert H.Wilson,Afsheen Bazrafkan,et al.Cerebral blood flow is decoupled from blood pressure and linked to EEG bursting after resuscitation from cardiac arrest[J]. Biomed Opt Express,2016,7(11):4660.

[8] 陈 璇,苏绮璇.脑电频谱边界频率与意识障碍程度的相关性[J].广东医学,2013,34(9):1410.
[9] 陈燕伟,王向宇,谢成金.定量脑电图对重型颅脑创伤长期意识障碍患者的清醒评估[J].中华神经外科杂志,2011,27(1):56.
[10] 曾彦英,宋春杰,孙巧英.EEG和GCS预测重型颅脑外伤性昏迷患者预后的价值[J].江苏医药,2013,39(18):2172.
