肾小管上皮细胞中可溶性表氧化物水解酶对小鼠巨噬细胞极化的调控作用
2018-05-23赵向娅赵倩茹杨胜楠
王 倩,赵向娅,赵倩茹,杨 轶,杨胜楠,李 冰,李 馨,田 蕊
(郑州大学第一附属医院老年综合二科,河南 郑州 450052)
肾间质纤维化是慢性肾脏病(chronic kidney disease,CKD)进展的共同途径。持续炎症细胞浸润可促进肾损伤,导致肾小管间质纤维化[1]。巨噬细胞在调节肾脏炎症及纤维化中发挥重要作用,且与疾病进展有关。血液中的单核细胞经过不同途径分化为M1型或M2型巨噬细胞,M1型巨噬细胞具有促进炎症反应的作用,引起肾脏纤维化,M2型巨噬细胞发挥抗炎作用,促进肾脏修复[2-3]。环氧二十碳三烯酸(epoxyeicosatrienoic acids,EETs)是花生四烯酸经细胞色素P450作用后的代谢产物,主要在心血管和肾脏循环中发挥舒张血管、抗炎等效应,其中14,15-环氧二十碳三烯酸(14,15-epoxyeicosatrienoic acids,14,15-EET)的活性最强。EETs被可溶性表氧化物水解酶(soluble epoxide hydrolase,sEH)催化形成脱氢二十碳三烯酸(dihydroxyeicosatrienoic acids,DHET),从而降低或失去活性[4]。在顺铂导致的急性肾损伤、单侧输尿管结扎导致的肾脏纤维化等多种动物模型中,通过抑制sEH的表达可增加EETs水平,减轻巨噬细胞浸润,改善肾功能,保护肾脏[5-9]。巨噬细胞极化是单核细胞活化后一系列功能状态的2个极端,在感染、代谢和免疫等多种疾病的发生、发展中起重要作用,但关于sEH如何调控肾组织中巨噬细胞极化的作用机制尚不明确。本研究选用肾小管上皮细胞系及巨噬细胞系为研究对象,观察蛋白尿刺激对肾小管上皮细胞产生sEH和巨噬细胞极化相关炎性因子的影响,探讨肾小管上皮细胞中sEH对巨噬细胞极化的作用,为延缓CKD进展提供新的治疗靶点。
1 材料与方法
1.1主要试剂与仪器人近端肾小管上皮细胞系HK-2细胞、小鼠巨噬细胞系RAW264.7细胞购自美国ATCC公司。高糖达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM)、胎牛血清购自美国Hyclone公司,sEH抑制剂12-(3-金刚烷-1-烃基-脲基)正十二烷酸[12-(3-adamantan-1-yl-ureido)-dodecanoic acid,AUDA]、14,15-EET/14,15-DHET 酶联免疫吸附试验测定(enzyme linked immunosorbent assay,ELISA)试剂盒、兔抗小鼠sEH抗体购自美国Caymann公司,干扰素-γ(interferon-γ,IFN-γ)、白细胞介素(interleukin,IL)-4购自美国Perotech公司,二辛可宁酸(bicinchoninic acid,BCA)蛋白检测试剂盒购自美国Pierce公司,兔抗小鼠β-actin购自美国Santa Cruz公司,辣根过氧化物酶标记山羊抗兔IgG购自北京中杉金桥生物技术有限公司,实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)试剂盒购自美国Thermo公司。蛋白质电泳、转膜及凝胶成像分析系统购自美国Bio-Rad公司,实时定量PCR仪购自美国Stratagene公司。
1.2细胞培养人近端肾小管上皮细胞系HK-2细胞及小鼠巨噬细胞系RAW264.7细胞置于含体积分数10%胎牛血清的DMEM中,在37 ℃、含体积分数5%CO2的培养箱中培养。待细胞生长至80%~85%融合时,给予无胎牛血清的DMEM静置24 h,将细胞同步静止于G0期。
1.3尿蛋白提取收集病理诊断为IgA肾病患者(初治患者肾穿刺前)晨尿250 mL,采用NH4SO4沉淀法提取尿蛋白。选用截留相对分子质量为3 500的透析袋透析NH4SO4蛋白质溶液。浓缩尿蛋白溶液:将蛋白质溶液置于透析袋中,放置在聚乙二醇8000粉末中;将50~100 mL溶液浓缩至 5~10 mL 待用。尿蛋白粉末冻干:取1~2 mL浓缩的蛋白质溶液置于清洁的青霉素小瓶内,倾斜放置于-20 ℃冰箱过夜,然后转至-80 ℃冰箱冻存1 d;然后置于冻干机内6~10 h,得到蛋白质粉末。
1.4尿蛋白溶液制备此操作严格在超净工作台中进行。取一定量的蛋白质粉末置于干净的10 mL离心管中,称质量后用DMEM溶解为浓度为1 000 g·L-1的尿蛋白溶液,利用22 μm滤器过滤尿蛋白溶液,将尿蛋白溶液加入含有DMEM的无菌培养瓶中,置于37 ℃、含体积分数5 % CO2的培养箱中培养 3 d,进行验菌实验;经验菌实验阴性,保证无菌后可用于处理细胞。
1.5实验分组将人近端肾小管上皮细胞系HK-2细胞分为正常对照组、sEH抑制剂组、尿蛋白组和sEH抑制剂联合尿蛋白组。正常对照组细胞不给予任何干预处理,sEH抑制剂组细胞给予1 μmol·L-1AUDA,尿蛋白组细胞给予10 g·L-1尿蛋白,sEH抑制剂联合尿蛋白组细胞给予10 g·L-1尿蛋白和1 μmol·L-1AUDA,各组细胞均培养24 h,实验重复3次。将小鼠巨噬细胞系RAW264.7细胞分为A组、B组、C组、D组、M1型巨噬细胞阳性对照组(IFN-γ阳性对照组)、M2型巨噬细胞阳性对照组(IL-4阳性对照组)。分别取正常对照组、sEH抑制剂组、尿蛋白组和sEH抑制剂联合尿蛋白组培养 24 h 的HK-2细胞培养基上清液,1 500 r·min-1离心3 min,取上清液备用。A、B、C、D组细胞分别加入正常对照组、sEH抑制剂组、尿蛋白组、sHE抑制剂联合尿蛋白组培养24 h的HK-2细胞培养基上清液孵育 24 h;IFN-γ阳性对照组和IL-4阳性对照组细胞均加入孵育24 h的正常对照组HK-2细胞培养基,并分别加入M1型巨噬细胞诱导剂IFN-γ(100 μg·L-1)和M2型巨噬细胞诱导剂IL-4(20 μg·L-1)孵育 24 h。
1.6Westernblot法检测HK-2细胞中sEH蛋白表达细胞培养皿应用磷酸盐缓冲液洗3次,加入预冷的放射免疫沉淀裂解液和蛋白酶抑制剂的全细胞裂解液,刮下细胞,超声粉碎后于4 ℃下13 000×g离心15 min,取上清液置于 -80 ℃ 冰箱备用。使用BCA蛋白检测试剂盒检测各组上清液中蛋白浓度,每组取50 μg上样,聚丙乙烯酰胺凝胶电泳分离蛋白,电泳后将蛋白转移至硝酸纤维膜上,室温下30 g·L-1牛血清白蛋白封闭1 h,加一抗sEH,4 ℃ 下震荡过夜,以β-actin为内参。次日,Tris洗膜缓冲液洗膜,辣根过氧化物酶标记山羊抗兔IgG室温孵育1 h。Tris洗膜缓冲液洗膜,用含有辣根过氧化物酶底物的化学发光液显色并扫描结果,应用 Image J图像分析软件进行半定量分析。
1.7RT-PCR检测HK-2细胞中单核细胞趋化蛋白-1(monocytechemotacticprotein-1,MCP-1)、IL-6、集落刺激因子-1(colonystimulatingfactor-1,CSF-1)、肿瘤坏死因子-α(tumornecrosisfactor-α,TNF-α)mRNA表达及RAW264.7细胞中诱导型氮氧化物合酶(induciblenitricoxidesynthase,iNOS)、IL-6、精氨酸酶-1(arginase,Arg-1)、IL-10mRNA表达弃去细胞培养液,用TRIzol RNA提取液按照氯仿-异丙醇法提取细胞总RNA,使用分光光度仪测定RNA浓度。取总RNA 2 μg进行反转录,将合成的cDNA保存于-20 ℃冰箱备用。实验所用引物均由上海生工生物工程股份有限公司合成。IL-6上游引物序列为5′-ACAACCACGGCCTTCCCTACTT-3′,下游引物序列为5′-CACGATTTCCCAGAGAACATGTG-3′;MCP-1上游引物序列为5′-AGGTCCCTGTCATGCTTCTG-3′,下游引物序列为5′-TCTGGACCCATTCCTTCTTG-3′;CSF-1上游引物序列为5′-CGGGCATCATCCTAGTCTTGCTGACTGT-3′,下游引物序列为5′-ATAGTGGCAGTATGTGGGG-GGCATCCTC-3′;TNF-α上游引物序列为5′-CCAGACCCTCACACTCAGATC-3′,下游引物序列为5′-CACTTGGTGGTTTGCTACGAC-3′;iNOS上游引物序列为5′-GTTCTCAGCCCAACAATACAAGA-3′,下游引物序列为5′-GTGGACGGGTCGATGTCAC-3′;Arg-1上游引物序列为5′-CTCCAAGCCAAAGTCCTTAGAG-3′,下游引物序列为5′-GGAG-CTGTCATTAGGGACATC-3′;IL-10上游引物序列为5′-GCAGCTCTAGGAGCATGTGG-3′,下游引物序列为5′-ACAGCCGGGAAGACAATAACT-3′;内参基因18 S上游引物序列为5′-ACCGCAGCTAGGAATAATGGA-3′,下游引物序列为5′-GCCTCAGTTCCGAAAACCA-3′。将cDNA用SYBR Green染料进行实时定量PCR。PCR扩增条件为:95 ℃预变性30 s,95 ℃变性5 s,62 ℃延伸20 s,共40个循环。结果分析采用2-△△CT(Livak法),18 S作为内参基因。所有试验均重复3次。
1.8ELISA测定各组HK-2细胞培养上清液中14,15-EET和14,15-DHET水平收集各组细胞培养上清液,3 000×g离心5 min,取上清液,用0.1 mmol·L-1苯基膦处理,乙酸调整pH值至3~4,加入等体积乙酸乙酯,充分混匀,12 000×g离心10 min,取上清液;按上述方法操作3次,留取有机相上清液;应用氮气贴着上清液面将有机相吹干;加入20 μL二甲基甲酰胺溶解14,15-DHET,余步骤详见ELISA试剂盒说明书,测定HK-2细胞培养液中14,15-EET和14,15-DHET水平,计算14,15-EET/14,15-DHET。

2 结果
2.1尿蛋白及sEH抑制剂对HK-2细胞中sEH蛋白表达的影响结果见图1和表1。正常对照组与sEH抑制剂组HK-2细胞中sEH蛋白及细胞培养上清液中14,15-EET/14,15-DHET比较差异均无统计学意义(P>0.05)。与正常对照组比较,蛋白尿组HK-2细胞中sEH蛋白表达显著增加(P<0.05);尿蛋白组HK-2细胞上清液中14,15-EET/14,15-DHET显著降低(P<0.05)。sEH抑制剂联合尿蛋白组与尿蛋白组HK-2细胞中sEH蛋白表达比较差异无统计学意义(P>0.05),sEH抑制剂联合尿蛋白组HK-2细胞上清液中14,15-EET/14,15-DHET显著高于尿蛋白组(P<0.05)。
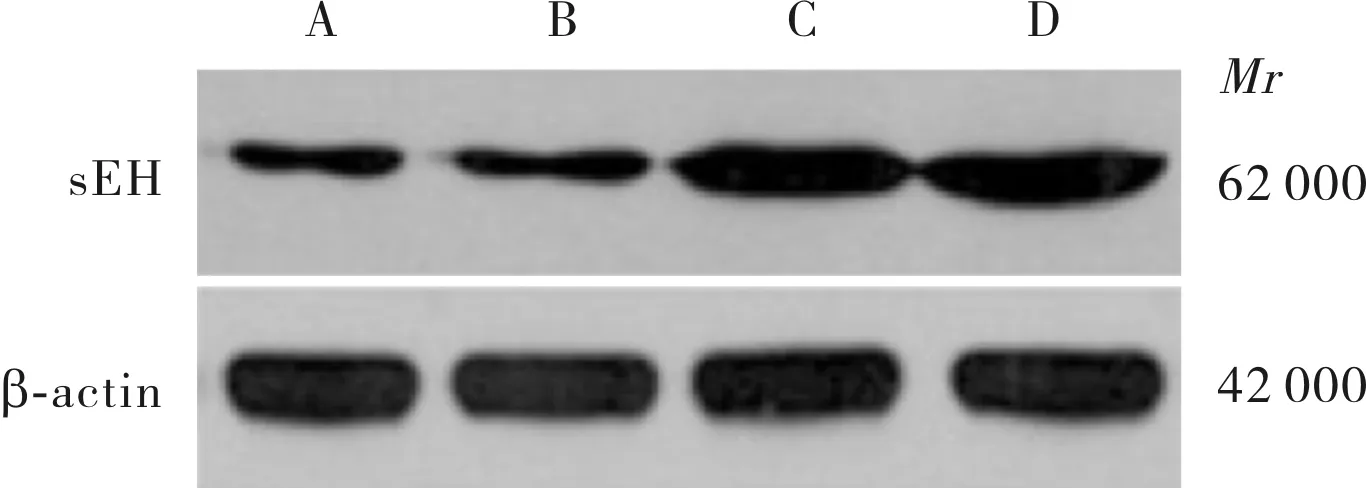
A:正常对照组;B:sEH抑制剂组;C:尿蛋白组;D:sEH抑制剂联合尿蛋白组。
图1各组HK-2细胞中sEH蛋白表达(Westernblot)
Fig.1ExpressionofsEHproteininHK-2cellsineachgroup(Westernblot)
表1各组HK-2细胞中sEH蛋白表达及上清液中14,15-EET/14,15-DHET比较

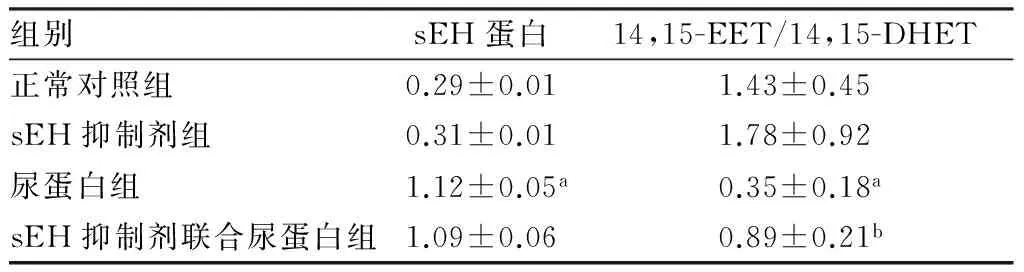
组别sEH蛋白14,15-EET/14,15-DHET正常对照组0.29±0.011.43±0.45sEH抑制剂组0.31±0.011.78±0.92尿蛋白组1.12±0.05a0.35±0.18asEH抑制剂联合尿蛋白组1.09±0.060.89±0.21b
注:与正常对照组比较aP<0.05;与尿蛋白组比较bP<0.05。
2.2各组HK-2细胞中MCP-1、IL-6、CSF-1及TNF-αmRNA表达比较结果见表2。正常对照组与sEH抑制剂组HK-2细胞中MCP-1、IL-6、CSF-1及TNF-α mRNA表达比较差异无统计学意义(P>0.05)。与正常对照组比较,尿蛋白组HK-2细胞中MCP-1、IL-6、CSF-1及TNF-α mRNA表达均显著增加(P<0.05)。与尿蛋白组比较,sEH抑制剂联合尿蛋白组HK-2细胞中MCP-1、IL-6、CSF-1及TNF-α mRNA表达均显著降低(P<0.05)。
表2各组HK-2细胞中MCP-1、IL-6、CSF-1及TNF-αmRNA表达比较


组别MCP-1mRNAIL-6mRNACSF-1mRNATNF-αmRNA正常对照组1.00±0.001.00±0.001.00±0.001.00±0.00sEH抑制剂组1.24±0.300.82±0.110.91±0.351.21±0.23尿蛋白组5.41±1.24a2.76±0.93a4.72±1.42a3.15±0.65asEH抑制剂联合尿蛋白组2.84±0.97b1.83±0.54b2.43±1.12b1.93±0.41b
注:与正常对照组比较aP<0.05;与尿蛋白组比较bP<0.05。
2.3各组HK-2细胞培养24h的培养基对RAW264.7细胞极化作用的影响结果见表3。A组与B组RAW264.7细胞中IL-6、iNOS、Arg-1及IL-10 mRNA表达比较差异均无统计学意义(P>0.05)。与A组比较,C组和IFN-γ阳性对照组RAW264.7细胞中 iNOS、IL-6 mRNA表达显著增加(P<0.05,P<0.01);IL-4阳性对照组RAW264.7细胞中Arg-1、IL-10 mRNA表达显著增加(P<0.05)。与C组比较,D组RAW264.7细胞中 iNOS、IL-6 mRNA表达显著降低(P<0.05),Arg-1、IL-10 mRNA表达显著增加(P<0.05)。
表3各组RAW264.7细胞中IL-6、iNOS、IL-10及Arg-1mRNA表达比较

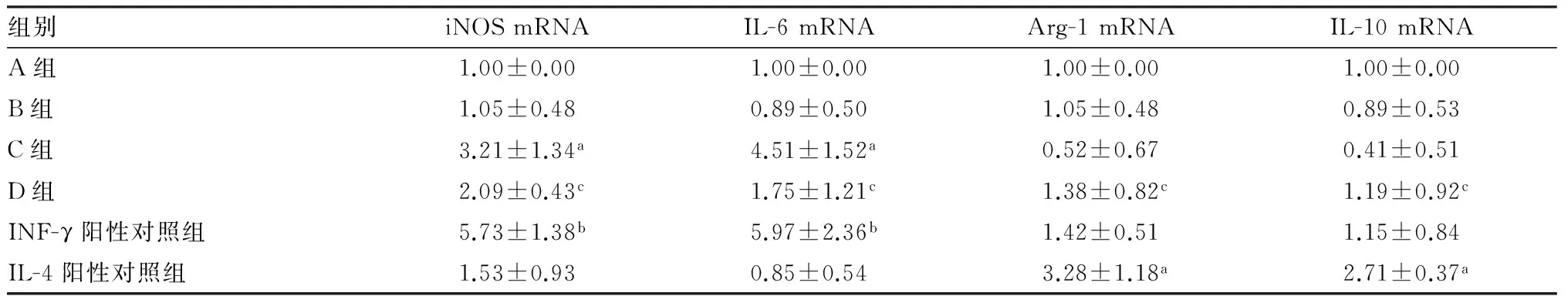
组别iNOSmRNAIL-6mRNAArg-1mRNAIL-10mRNAA组1.00±0.001.00±0.001.00±0.001.00±0.00B组1.05±0.480.89±0.501.05±0.480.89±0.53C组3.21±1.34a4.51±1.52a0.52±0.670.41±0.51D组2.09±0.43c1.75±1.21c1.38±0.82c1.19±0.92cINF-γ阳性对照组5.73±1.38b5.97±2.36b1.42±0.511.15±0.84IL-4阳性对照组1.53±0.930.85±0.543.28±1.18a2.71±0.37a
注:与A组比较aP<0.05,bP<0.01;与C组比较cP<0.05。
3 讨论
近年来,CKD患病率逐渐增加,已成为威胁全球人民健康的重要公共问题之一。我国CKD总患病率为10.8%[10]。肾小管间质纤维化是CKD进展的共同途径,其主要特征包括炎性细胞浸润、炎性因子释放、肌成纤维细胞活化和细胞外基质沉积[11]。炎性细胞的募集处于核心环节。巨噬细胞在炎症反应中发挥重要作用,且与疾病预后密切相关。巨噬细胞是具有吞噬功能的免疫细胞,可根据局部微环境分化为经典活化M1型和替代活化M2型巨噬细胞[2]。M1型巨噬细胞以表达高水平的致炎细胞因子、活性氧等产物为特征,促进炎症反应,如果炎症持续存在,可促进炎症蔓延,导致脏器纤维化。M2型巨噬细胞主要发挥抗炎作用,通过促进细胞增殖、减少细胞凋亡、促进血管新生而发挥组织修复作用[3]。
M1及M2型巨噬细胞在多种急、慢性肾脏疾病动物模型中发挥不同作用。在小鼠急性肾损伤模型中,造模前敲除巨噬细胞可减轻肾损伤,造模后3~5 d敲除巨噬细胞则延缓肾小管增殖修复,加重肾损伤[12]。如果M1型巨噬细胞不能及时转变为M2型,将阻碍肾小管修复,肾损伤持续存在,加重肾病进展[13-14]。在小鼠慢性炎性肾病模型中,注射M2型巨噬细胞后可减轻肾脏炎症反应,促进肾组织修复[15]。在单侧输尿管结扎肾纤维化小鼠模型中,早期干预M1型巨噬细胞可发挥改善肾损伤、延缓肾纤维化的作用[16]。
近年来,EETs与巨噬细胞的关系已有相关研究,但在肾脏中的作用仍不明确。有研究显示,在脂多糖介导的心功能不全动物模型中,EETs通过抑制NF-κB而诱导巨噬细胞极化[17]。在高脂饮食导致的脂肪肝模型中,sEH抑制剂促进巨噬细胞向抗炎的M2型极化,可改善肝脏炎症状态及胰岛素抵抗[18]。在高脂喂养的小鼠中给予sEH抑制剂或外源性补充EETs可抑制脂肪细胞募集巨噬细胞,抑制巨噬细胞向M1型极化,改善脂肪炎症状态及胰岛素抵抗[19]。
本研究通过应用sEH抑制剂,增加肾小管上皮细胞EETs水平,可减少MCP-1、IL-6、CSF-1和TNF-α等诱导M1型巨噬细胞极化细胞因子的表达,增加Arg-1、IL-10等诱导M2型巨噬细胞极化细胞因子的表达。利用肾小管上皮细胞的条件培养基孵育巨噬细胞,发现sEH抑制剂可抑制巨噬细胞向M1型极化,促进其向M2型极化,说明肾小管EET、sEH参与了肾间质巨噬细胞的极化。本研究将EETs及sEH抑制剂在肾小管上皮细胞的抗炎作用扩展到肾间质巨噬细胞,但尚缺乏深入的机制探讨。本研究将为明确EETs在肾脏的生理作用研究以及为sEH抑制剂作为一种有效的肾脏治疗药物的临床推广提供理论基础。
参考文献:
[1] BOOR P,OSTENDORF T,FLOEGE J.Renal fibrosis:novel insights into mechanisms and therapeutic targets[J].NatRevNephrol,2010,6(11):643-656.
[2] GUITERAS R,FLAQUER M,CRUZADO J M.Macrophage in chronic kidney disease[J].ClinKidneyJ,2016,9(6):765-771.
[3] SICA A,MANTOYANI A.Macrophage plasticity and polarization:invivoveritas[J].JClinInvest,2012,122(3):787-795.
[4] FAN F,ROMAN R J.Effect of cytochrome P450 metabolites of arachidonic acid in nephrology[J].JAmSocNephrol,2017,28(10):2845-2855.
[5] HASHIMOTO T,FANG Y I,OHATA H,etal.Change in soluble epoxide hydrolase (sEH) during cisplatin-induced acute renal failure in mice[J].JToxicolSci,2015,40(4):451-457.
[6] BETTAICH A,KOIKE S,CHAHED S,etal.Podocyte-specific soluble epoxide hydrolase deficiency in mice attenuates acute kidney injury[J].FEBSJ,2017,284(13):1970-1986.
[7] KIM J,IMIG J D,YANG J,etal.Inhibition of soluble epoxide hydrolase prevents renal interstitial fibrosis and inflammation[J].AmJPhysiolRenalPhysiol,2014,307(8):F971-F980.
[8] WANG Q,PANG W,CUI Z,etal.Upregulation of soluble epoxide hydrolase in proximal tubular cells mediated proteinuria-induced renal damage[J].AmJPhysiolRenalPhysiol,2013,304(2):F168-F176.
[9] ROCHE C,GUERROT D,HAROUKI N,etal.Impact of soluble epoxide hydrolase inhibition on early kidney damage in hyperglycemic overweight mice[J].ProstaglandinsOtherLipidMediat,2015,120:148-154.
[10] ZHANG L,WANG F,WANG L,etal.Prevalence of chronic kidney disease in China:a cross-sectional survey[J].Lancet,2012,379(9818):815-822.
[11] ROCKEY D C,BELL P D,HILL J A.Fibrosis-A common pathway to organ injury and failure[J].NEnglJMed,2015,373(1):96.
[12] LEE S,HUEN S,NISHINO H,etal.Distinct macrophage phenotypes contribute to kidney injury and repair[J].JAmSocNephrol,2011,22(2):317-326.
[13] LECH M,GROBMAYR R,RYU M,etal.Macrophage phenotype controls long-term AKI outcomes:kidney regeneration versus atrophy[J].JAmSocNephrol,2014,25(2):292-230.
[14] ANDERS H J,RYU M.Renal microenvironments and macrophage phenotypes determine progression or resolution of renal inflammation and fibrosis[J].KidneyInt,2011,80(9):915-925.
[15] WANG Y,WANG Y P,ZHENG G,etal.Exvivoprogrammed macrophages ameliorate experimental chronic inflammatory renal disease[J].KidneyInt,2007,72(3):290-299.
[16] TIAN S,ZHANG L,TANG J,etal.HMGB1 exacerbates renal tubulointerstitial fibrosis through facilitating M1 macrophage phenotype at the early stage of obstructive injury[J].AmJPhysiolRenalPhysiol,2015,308(1):F69-F75.
[17] DAI M,WU L,HE Z,etal.Epoxyeicosatrienoic acids regulate macrophage polarization and prevent LPS-induced cardiac dysfunction[J].JCellPhysiol,2015,230(9):2108-2119.
[18] LOPEZ C,ALCARAZ J,GARCIA V,etal.Inhibition of soluble epoxide hydrolase modulates inflammation and autophagy in obese adipose tissue and liver:role for omega-3 epoxides[J].ProcNatlAcadSciUSA,2015,112(2):536-541.
[19] DAI M,WU L,WANG P,etal.CYP2J2 and its metabolites EETs attenuate insulin resistance via regulating macrophage polarization in adipose tissue[J].SciRep,2017,7:46743.
