阻断神经元CD200表达诱导的炎性反应相关炎症通路
2018-05-23刘宏斌房艳宇潘云志赵吉波张晨昕
刘宏斌 房艳宇 韩 钢 潘云志 赵吉波 王 澍 张晨昕
(齐齐哈尔医学院附属第三医院,黑龙江 齐齐哈尔 161000)
帕金森病(PD)并非单因素所致,而是多因素交互作用下导致黑质多巴胺神经元大量变性、丢失〔1,2〕。然而,神经元也表达多种起着保护作用的免疫球蛋白〔3,4〕。CD200广泛表达于包括神经元在内的多种细胞中,研究表明,CD200-CD200R通路是中枢神经系统内下调神经元/小胶质细胞活化的重要机制〔5,6〕。近年来与两者活化可能相关炎症通路的研究成为热点,然而大部分研究均关于小胶质细胞活化相关的炎症通路,而关于神经元变性过程中相关炎症通路的研究较少。本实验在体外采用PC12细胞代替神经元,探讨在神经元发生炎性变性过程中可能相关的下游通路。
1 材料及方法
1.1细胞培养及分组 用含10%胎牛血清(FBS)的1640培养基(Hyclone,美国)培养PC12细胞(上海细胞库)2~3 d传代一次,待细胞贴壁达90%时,取对数期的细胞用于实验。细胞分组:A:对照组;B:脂多糖(LPS)处理组;C:CD200抗体(Abcam公司,美国)及LPS(Sigma公司,美国)处理组;D:SB203580及CD200抗体处理组;E:AG490及D200抗体处理组。
1.2免疫荧光检测CD200的表达 96孔板培养PC12细胞,4%多聚甲醛固定15 min,5%牛血清白蛋白(BSA)封闭0.5 h,加入1∶1 000稀释的CD200过夜,荧光二抗孵育1.5 h,每步骤之间均用磷酸盐缓冲液(PBS)洗3次,每次5 min,荧光显微镜下观察细胞形态及CD200的表达。
1.3酶联免疫吸附法(ELISA)检测肿瘤坏死因子(TNF)-α及白细胞介素(IL)-6的分泌 以非处理组上清作对照,设立复孔,重复3次实验,按照TNF-α(R&D)及IL-6(R&D)的使用说明书,96孔板中分别加入标准样品及待测样本、生物标记二抗及酶标试剂,37℃,反应1 h后洗板5次,加入显色剂A、B,37℃敷箱中显色10 min,加终止液,以酶标仪检测波长为450 nm的光密度值。
1.4Western印迹检测P38丝裂原激活蛋白激酶(P38MAPK)、酪氨酸激酶-信号转导子与转录激活子(JAK-STAT3)、pho-P38MAPK及pho-JAK-STAT3的表达 收集A、B、C组细胞,提蛋白,二喹啉甲酸(BCA)蛋白定量法用PAGE蛋白上样缓冲液配制待测蛋白,上样电泳,冰上转膜,5%BSA封闭1 h,敷一抗P38MAPK(1∶1 000稀释,cellsignal)、pho-P38MAPK(1∶1 000稀释,cellsignal),pho-JAK-STAT3(1∶1 000稀释,Abcam),JAK-STAT3(1∶1 000稀释,CST),4℃过夜,TBST洗膜,二抗孵育2 h,电化学发光法(ECL)发光。
1.5统计学方法 采用SPSS19.0及Image J软件进行单因素方差分析。
2 结 果
2.1PC12细胞表面CD200的表达 荧光显微镜观察PC12细胞为单层贴壁细胞,胞体细长呈梭形,发出较多分支,表明CD200可表达于PC12细胞表面,见图1。

图1 PC12细胞表面CD200的表达(×20)
2.2PC12细胞炎症因子分泌水平 在不加任何处理因素的情况下TNF-α及IL-6均有基础分泌分别为〔(277±3.7)、(295±4.7)ng/L〕,单加LPS后细胞活化,两者分泌增多〔分别为(324±7.2)、(357±9.2)ng/L〕,而用CD200抗体及LPS处理后较单独的LPS处理而言,细胞活化更加明显,TNF-α、IL-6分泌继续增多〔分别为(398±5.7)、(395±7.7)ng/L〕,各组比较差异均有统计学意义(P<0.05)。
2.3PC12细胞炎症通路蛋白表达水平 两种磷酸化蛋白及半定量分析待测蛋白与内参比而言,C组显著高于B组及A组,说明在CD200抗体及LPS共刺激PC12细胞后P38MAPK及JAK-STAT3的磷酸化表达显著增加,各组间比较差异均有统计学意义(P<0.05),见图2,表1。


图2 各组PC12细胞炎症通路蛋白表达
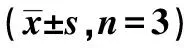
表1 各组炎症通路蛋白表达水平比较
与A组比较:1)P<0.05;与B组比较:2)P<0.05
2.4两条通路阻断剂对炎症因子水平的影响 与C组TNF-α、IL-6水平〔(384±5.2)、(396±4.8)ng/L〕比较,D组〔(341±4.5)、(353±4.2)ng/L〕和E组〔(375±2.7)、(378±2.9)ng/L〕明显减低,差异有统计学意义(P<0.05)。加入足量的两条通路阻断剂后,TNF-α、IL-6分泌均有所减低,各组间比较差异有统计学意义(P<0.05),说明pho-P38MAPK及pho-JAK-STAT3通路均参与了CD200抗体及LPS诱导的神经元细胞的激活。
3 讨 论
PD是常见的神经系统变性疾病,在我国,65岁以上的人群总体患病率为1 700/10万,与欧美国家相似,其发病率随着年龄的增高而升高,男性高于女性〔7~9〕。病理及尸检结果表明,黑质多巴胺能神经元大量变性丢失,神经系统内的炎性反应参与了PD的发生及进展〔10,11〕,CD200广泛表达在神经元、B细胞等细胞表面,而其受体CD200R则局限表达在小胶质细胞等髓样细胞表面,两者其一发生改变均可导致神经元及小胶质细胞的活化。本实验证实PC12细胞存在CD200的表达。众所周知,神经炎症在神经变性疾病中发挥重要作用〔12〕,探讨一种维持CD200/CD200R通路的平衡进而维持神经元及小胶质细胞处于静息状态的治疗手段,必然会成为未来治疗与神经炎症有关的神经变性性疾病的新方向。
4 参考文献
1Deckert M,Sedwick JD,Fischer E,etal.Regulation of microglial cell resposes in murine toxoplasma encephalitis by CD200/CD200 receptor interaction〔J〕.Acta Neuropathol,2006;111:548-58.
2Colton CA,Mott RT,Sharpe H,etal.Expression profiles for macrophage alternative genes in AD and in mouse models of AD〔J〕.Neuroinflammation,2006;3:27.
3Hatherley D,Barclay AN.The CD200 and CD200 receptor cell surface proteins interact through their N-terminal immunoglobulin-like domains 〔J〕.Eur J Immunol,2004;34:1688-94.
4Hoek RM,Ruuls SR,Murphy CA,etal.Down-regulation of the macrop-hage lineage through interaction with OX2(CD200)〔J〕.Science,2000;290:1768-71.
5Jankowsky JI,Patterson PH.The role of cytokines and growth factors in seizures and their sequelae〔J〕.Prog Neurobiol,2001;63:125-49.
6Xiao J,Wong AW,Willingham MM,etal.Brain derived neurotrophic factor promotes central nervous system myelination via a direct effect upon Oligodenerocytes〔J〕.Neurosignals,2010;18:186-202.
7Liu Y,Holdbrooks AT,De Sarno P,etal.Therapeutic efficacy of suppressing the JAK/STAT pathway in multiple models of experimental autoimmune encephakomyelitis〔J〕.Immunol,2014;192:59-72.
8Minogue AM,Barrett JP,Lynch MA,etal.LPS-induced release of IL-6 from glia modulates production of IL-1β in a JAK2-dependent manner〔J〕.Neuroinflammation,2012;9:126.
9Ohtsubo M,Takayanagi A,Gamou S,etal.Interruption of NF kappaB-STA-T1 signaling mediates EFG-induced cell-cycle arrest〔J〕.Cell Physiol,2000;184:131-7.
10Frisullo G,Angelucci F,Caggiula M,etal.pSTAT1,pSTAT3,and T-bet exprsssion in peripheral blood mononuclear cells from relapsing-remitting multiple sclerosis patients correlates with disease activity〔J〕.Neurosci Res,2006;84:1027-36.
11Jenner P,Olanow CW.Understanding cell death in Parkinson disease〔J〕.Ann Neurol,1998;44:S72-S84.
12Coyle JT,Puttfarcken P.Oxidative stress,glutamate,and neurodegenerative disordes〔J〕.Science,1993;262:689-95.
