高效液相色谱法同时测定中成药红药片中5种成分
2018-05-23白钢钢
李 敏 ,赵 健 ,白钢钢 △
(1.江苏省泰州市食品药品检验所,江苏 泰州 225300; 2.武警安徽总队医院,安徽 合肥 230000)
中成药红药片由三七、红花、当归、川芎、白芷和土 鳖虫6味中药组成,具有活血止痛、祛瘀生新功效,临床主要用于跌打损伤、筋骨淤血肿痛、风湿麻木[1]。方中三七为主药,可散瘀止血、消肿定痛,临床主要用于各种内、外出血,胸腹刺痛,跌扑肿痛[2]。人参皂苷和三七皂苷是三七的生物活性成分,但在红药片部颁标准中无其含量测定项目。三七的含量测定有薄层扫描法、高效液相色谱(HPLC)-蒸发光散射测定法、HPLC法等,薄层扫描法的精密度和重复性均较差[3],HPLC-蒸发光散射测定法在测定过程中不稳定。HPLC法更快速,分离效能高,结果准确可靠,重复性好,应用广泛,如2015年版《中国药典(一部)》中,三七药材的含量测定采用HPLC法测定人参皂苷Rg1,Rb1和三七皂苷R1的含量[2]。目前,关于红药片三七中皂苷类成分的HPLC法检测分析,大多以4个成分以下居多[4-7],同时测定5个成分的报道相对较少,缺少对人参皂苷Rd的测定,且目前市场上有三七总皂苷对照品,相对于配制混合对照品,更简单、方便、快捷。为更好地控制中成药红药片的质量,保证临床用药的疗效,本研究中建立了中成药红药片5种主要生物活性成分的含量测定方法。现报道如下。
1 仪器与试药
1.1 仪器
Waters e2695型高效液相色谱仪,包括脱气泵、四元泵、自动进样器、2489UV紫外检测器;Empower色谱工作站;8200型超声波清洗器(功率为500 W,频率为53 kHz,上海科导超声仪器有限公司);Milli-Q型超纯水处理系统(美国M ILLIPORE公司);Mettler AE-200型电子天平(梅特勒公司);Mettler XS105DU型电子天平(梅特勒公司)。
1.2 试药
红药片(抚顺青松药业有限公司,批号分别为20161104,20170402,20170521);三七总皂苷对照品(批号为 110870-201603),人参皂苷 Rg1(纯度为 28.0%),人参皂苷 Re(纯度为 3.8%),人参皂苷 Rb1(纯度为29.7%),人参皂苷 Rd(纯度为 7.3%),三七皂苷 R1(纯度为6.9%),均购于中国食品药品检定研究院;乙腈为色谱纯,水为超纯水,其他试剂均为分析纯。
2 方法
2.1 色谱条件
色谱柱:Waters XBridge C18柱(250 mm ×4.6 mm,3.5 μm);柱温:25 ℃;流动相:A 为乙腈溶液,B 为水,梯度洗脱(0~20 min 20%A,20~45 min 20% ~46%A,45~55 min 46% ~55%A,55~60 min 55%A,60~65 min 55% ~20%A,65~80 min 20%A);流速:0.8 mL /min;检测波长:203 nm;进样量:10 μL。
2.2 溶液制备
取三七总皂苷对照品适量,精密称定,加甲醇制成每 1 mL 含三七皂苷 R128 μg、人参皂苷 Rg10.15 mg、人参皂苷 Re 15 μg、人参皂苷 Rb10.12 mg、人参皂苷Rd 30 μg的对照品溶液。取本品10片,研细,混匀,取约0.5 g,精密称定,置具塞锥形瓶中,精密加入水饱和正丁醇50 mL,密塞,称定质量,超声处理(功率为500 W,频率为53 kHz)40 min,放冷,再称定质量,用水饱和的正丁醇溶液补足减失的质量,摇匀,滤过,精密量取续滤液25 mL,置分液漏斗中,用正丁醇饱和的氨试液洗涤2次(25 mL,15 mL),弃去氨试液,再用正丁醇饱和的水洗涤 2次(25 mL,15 mL),弃去水液,正丁醇液蒸干,残渣用甲醇溶解转移至10 mL容量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得供试品溶液。取缺三七药材的阴性样品,按供试品溶液项下方法制备,即得阴性对照品溶液。
2.3 方法学考察
专属性试验:取缺三七药材的阴性样品,依法制备溶液并进样测定,记录色谱图,结果阴性对照品溶液无干扰。详见图1。
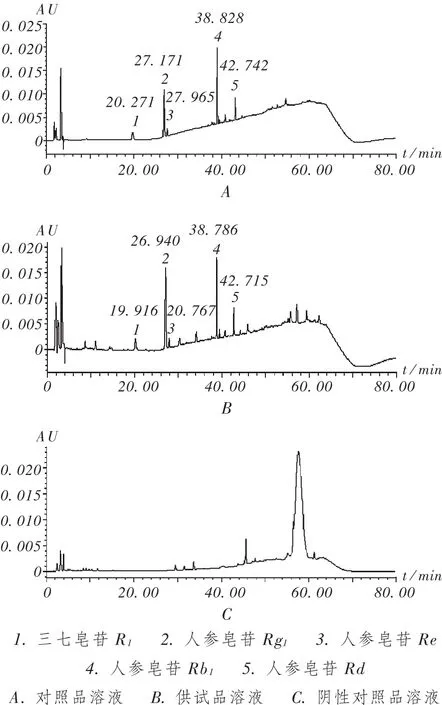
图1 高效液相色谱图
线性关系考察:取对照品溶液,分别进样2,5,8,10,12,15 μL,记录峰面积,计算回归方程,详见表 1。

表1 线性关系考察结果
精密度试验:取对照品溶液,连续进样6次,记录色谱峰面积值。结果的 RSD依次为 0.71%,0.23%,0.31%,0.18% ,0.60%(n = 6),表明仪器精密度良好。
稳定性试验:取2.2项下同一供试品溶液,分别在0,2,4,6,8,10,12,16,20,24 h 时进样,记录峰面积。结果 5种成分峰面积的 RSD分别为 1.46%,1.08%,1.34%,0.90%,1.88%(n =10),表明供试品溶液在 24 h内稳定。
重复性试验:取同一批(批号20161104)样品6份,依法平行制备,测定。结果,三七皂苷R1及人参皂苷Rg1,Re,Rb1,Rd 每 片 平 均 含 量 分 别 为 0.20,0.88,0.096,0.58,0.16 mg, RSD 分别为 2.43% ,1.28% ,1.01%,1.66%,3.69%(n = 6),表明方法重复性良好。
加样回收试验:取已知含量的同一批(批号20161104)样品,研细,称取 6 份,每份约 0.25 g,精密称定,分别加入三七皂苷 R1(0.070 g/L)、人参皂苷Rg1(0.28 g/L)、人 参 皂 苷 Re(0.039 g/L)、人 参 皂 苷Rb1(0.30 g /L)、人参皂苷 Rd(0.074 g /L)的对照品溶液3 mL,依法制备,测定。结果见表2。
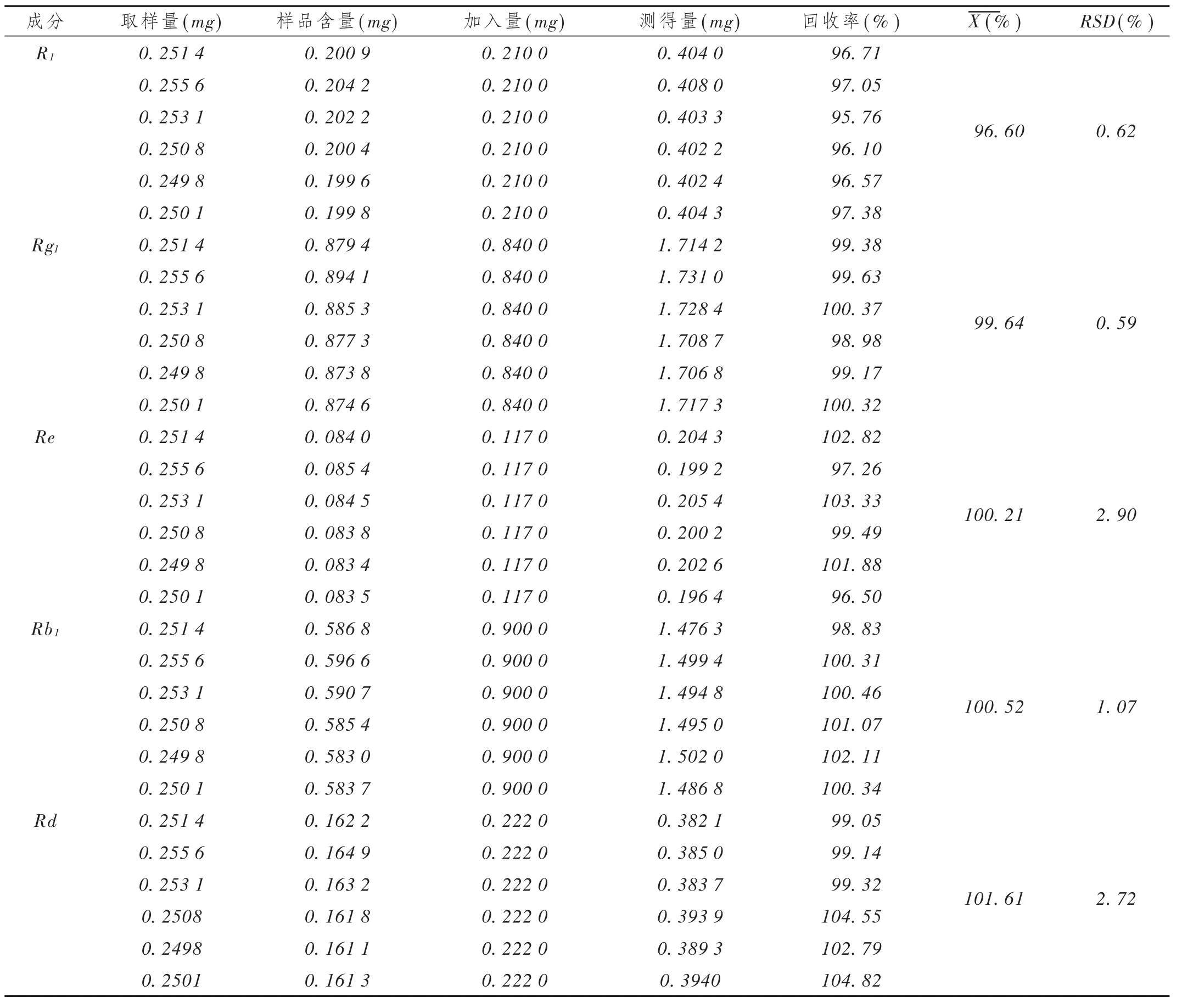
表2 加样回收试验结果(n=6)
2.4 样品含量测定
取3批样品,依法制备溶液并测定,按外标校正因子法计算含量。结果见表3。

表3 样品含量测定结果(mg,n=4)
3 讨论
本研究中所测的人参皂苷类成分,在常温条件下稳定不易分解,可常温保存,但供试品溶液在蒸干过程中,温度蒸干,几乎没有三七总皂苷成分。三七皂苷类成分的稳定性相关的研究表明,高温对三七总皂苷的影响较大,在高温条件下,三七总皂苷极易分解,样品应密封,阴凉暗干燥处储存[4,8-9]。
本研究中对流动相系统进行了选择,分别对乙腈-0.05% 磷酸溶液(20 ∶80)[10]、乙腈 -0.1% 磷酸溶液(22 ∶78)[11]、甲醇 -水(55 ∶45),发现人参皂苷 Rg1和人参皂苷Re几乎很难分开,且人参皂苷Rd相对其他成分,极性小,出峰时间比较靠后,洗脱时间长,故应考虑梯度洗脱方法。参考2015年版《中国药典(一部)》三七药材含量测定的色谱条件,使用乙腈-水梯度洗脱,结果人参皂苷Rg1和人参皂苷Re分离度低,且人参皂苷Rd未分离出来。采用人参皂类成分多选用的乙腈-水为流动相[12],梯度洗脱 115[13],80,65 min[14],结果梯度洗脱80 min时,出峰快,待测组分能和共存组分达到基线分离,基线平稳,且色谱峰具有较好的对称性,故选用80 min的梯度洗脱程序。
色谱条件的考察中,温度对人参皂苷类成分的影响也很大,温度高色谱峰会拖尾,温度低有的色谱峰会有前沿,最终确定色谱柱的最佳温度为25℃[15]。本研究中选择的色谱柱是 Waters XBridge C18柱(250 mm ×4.6 mm,3.5 μm),1.0 mL /min 的流速在梯度洗脱中致色谱柱压力偏高。通过优化试验,最终采用0.8 mL/min的流速既满足柱压又符合分离要求。
为达到让样品有更大的提取效率,前处理过程分别对称样量和提取方式进行了考察。提取方式分别考察了加热回流(2 h)和超声处理2种[16],发现超声处理含量明显偏高,说明三七总皂苷生物活性成分在前处理过程中应避免高温加热过程,故使用超声处理。分别比较超声 30,40,60 min,发现超声处理 40 min时提取效率最高,故超声处理 40 min。称样量分别称取约 0.2,0.3,0.4,0.5,0.7,1.0 g 样品,超声处理 40 min,结果称取约0.5 g时样品提取效率最佳。
综上所述,HPLC法同时测定中成药红药片中的三七皂苷 R1及人参皂苷 Rg1,Re,Rb1,Rd 的含量,各成分在80 min内检测完全,方法精密度、准确度,重复性好,对该制剂的质量控制具有重要意义。
:
[1]WS3-B-4028-98,中华人民共和国卫生部药品标准·中药成方制剂(第二十分册)[S].
[2]国家药典委员会.中华人民共和国药典 (一部)[M].北京:中国医药科技出版社,2015:11-12.
[3]冯雅斌,杜 靓,温 静,等.薄层色谱法在药物分析中的应用及研究进展[J].疾病监测与控制杂志,2011,5(1):60-62.
[4]郑丽华,卢昌均,周志坤,等.HPLC测定三七总皂苷中5种皂苷的含量及稳定性考察[J].中医药临床杂志,2012,24(1):73-75.
[5]王德旺,马坤芳,季宏建.HPLC法测定红药片中三七皂苷R1、人参皂苷 Rg1的含量[J].南京医科大学学报,2006,26(12):1292-1294.
[6]段 瑞,沙东旭,杨 文.高效液相色谱-蒸发光散射法测定红药片中三七皂苷R1和人参皂苷 Rg1、Re、Rb1的含量[J].沈阳药科大学学报,2008,25(5):376-379.
[7]王 敏,马玉梅.HPLC法测定跌打红药片三七药材中人参皂苷 Rg1、Rb1及三七皂苷R1的含量[J].中国民族民间医药,2012,12(23):29-31.
[8]陈木洲,刘延辉,黄 姬,等.酸碱度对人参皂苷提取率及其稳定性影响分析[J].中国实用医药,2011,6(20):146-147.
[9]余潇苓,苗 青,方翠芬.人参皂苷水溶液热稳定性研究[J].中国现代应用药学,2011,28(12):1109-1112.
[10]张文杰,白旭东.HPLC测定红药片中人参皂苷Rg1的含量[J].中华中医药学刊,2007,25(5):1059-1060.
[11]齐胡堂,周向阳.HPLC法测定跌打红药片中人参皂苷Rg1的含量[J].药物分析杂志,2008,28(11):1924-1925.
[12]陈开杰.HPLC法同时测定参附注射液中人参皂苷Rg1、Rb1的含量[J].中国药房,2014,25(40):3827-3828.
[13]谢 华,王 砚,王钢力,等.参附注射液中人参皂苷Rg1和人参皂苷 Re 的含量测定[J].华西药学杂志,2006,21(2):208-209.
[14]南 国,张 鹏,王 萌,等.HPLC法测定稳心颗粒中三七皂苷 R1、人参皂苷 Rg1、Rb1、Rd与党参炔苷的含量[J].天津中医药,2016,33(7):434-436.
[15]陆 娟,李绪文,魏 巍,等.RP-HPLC测定生脉注射液中7 个人参皂苷类成分的含量[J].药物分析杂志,2011,31(12):2302-2304.
[16]张建伟,赵 倩,何希荣,等.HPLC测定中成药中人参皂苷类成分含量的应用概况[J].南京医科大学学报,2014,20(17):228-231.
