大鼠脊髓损伤后 TIMP-2、Collagen I 和 Collagen IV的表达情况及其肢体运动功能的研究
2018-05-23李仁斌余光书林焱斌
李仁斌 余光书 林焱斌
脊髓损伤 (spinal cord injury,SCI) 是严重的神经系统疾病,损伤后原有的血-脊髓屏障破坏,血管基膜裂解,微血管损伤,产生出血、水肿、炎症等病变,损伤患者多伴有下肢感觉和运动功能减退或消失[1-3]。目前,SCI 尚未有理想的治疗方法。基质金属蛋白酶组织抑制因子 (tissue inhibitor of metalloproteinase 2,TIMP-2) 作为一种内源性的酶类能够抑制细胞外基质 (extracellular matrix,ECM)的降解从而维持组织内环境的稳定[4],故对 SCI 后组织修复所需环境的调控至关重要。I 型胶原蛋白(Collagen I) 主要来自哺乳动物成纤维细胞、软骨细胞等。研究表明[5],Collagen I 在损伤后伤口愈合,
血管重建中发挥重要作用;IV 型胶原蛋白 (Collagen IV) 由血管内皮细胞分泌,在正常的神经系统中,存在于脑脊液和微血管周围,起组织连接作用[6-7]。
研究表明[8],SCI 后 TIMP-2、Collagen I 和 Collagen IV 在某个时间内的表达持续升高,有利于损伤处血管的构建,基膜的重塑及轴突的生长,对 SCI 后肢体运动功能的恢复起重要作用。但三者在 SCI 后表达的变化趋势尚不清楚。本研究旨在观察大鼠 SCI后 TIMP-2、Collagen I 和 Collagen IV 的表达情况,探讨 TIMP-2,Collagen I 和 Collagen IV 对 SCI 模型大鼠肢体运动功能恢复所起的作用。
材料和方法
一、实验材料
1. 实验动物:60 只体重为 (220±20) g 的健康成年雌性 SD 大鼠,购于上海斯莱克实验动物责任有限公司,许可证号码为 SCXK (沪) 2014-006,饲养于福建中医药大学实验动物中心 SPF 级实验室。本研究符合福建中药大学动物实验伦理委员会要求。
2. 实验试剂:(1) 一抗:兔抗鼠 TIMP-2 抗体(Abcam,美国)、兔抗鼠 Collagen I 抗体 (Abcam,美国)、兔抗鼠 Collagen IV 抗体 (Abcam,美国);(2) 二抗:山羊抗兔 Alexa flour488 荧光二抗(Thermo Fisher,美国);(3) 尼氏染色试剂盒 (索莱宝、北京)、免疫组化试剂盒 (迈新,福州)。
3. 实验仪器:NYU 脊髓打击器 (W. M. Keck 神经科学协作中心,美国)、显微镜 (Leica DMI 4000B /DFC425C,德国)、Image-lab 图像分析系统、Image-Pro 图像分析系统 (BIORADHERCULES,美国)。
二、实验方法
1. 动物分组和造模:采用随机数表法将 60 只SD 大鼠随机分为假手术组、术后 3 天组、术后5 天组、术后 7 天组和术后 9 天组,每组 12 只。假手术组仅行椎板切除术,不损伤脊髓。其余各组均使用 NYU 脊髓打击器建立 SCI 模型[9]。大鼠麻醉成功后,取 T9~11区域进行脱毛,局部皮肤消毒,沿脊柱纵轴作一长约 2~3 cm 切口,依次切开皮肤、皮下组织、肌肉、筋膜,钝性剥离附着于棘突两侧的肌肉,暴露 T9~11椎骨棘突和椎板,咬除棘突和椎板,暴露 T10部位白色脊髓硬脊膜,将大鼠固定于NYU 打击器固定台,调整打击杆,使其瞄准 T10脊髓正中,调整打击杆高度为 12.5 mm,释放打击杆,使其自由下落撞击脊髓,出现大鼠尾部剧烈摆动,头部肌肉瞬间收缩,术后出现双下肢完全瘫痪,提示造模成功。造模成功后,生理盐水冲洗伤口后逐层缝合。术后每天早晚人工按摩膀胱和下腹以助大鼠排便排尿,每天进行青霉素 4 万单位 / 只前肢注射,连续 3 天,预防感染。
2. 行为学评分:本实验采用 BBB 肢体运动功能评分[10]评估假手术组大鼠和术后 9 天组大鼠肢体运动功能。由 2 名非本实验工作人员且熟练掌握 BBB评分标准的专业人员于造模后 1 天、3 天、5 天、7 天、9 天对每只大鼠独立进行 BBB 肢体运动功能评分,每只大鼠评分 2 次,且每次观察时间 ≥3 min。最终取平均评分。
3. 取材方法:水合氯醛麻醉成功后,将每组中的 6 只大鼠腹腔剪开,取血,止血钳夹住腹主动脉,打开胸腔,暴露心脏,然后于右心房、左心耳处各剪一小口,自左心尖部注入 150 ml 生理盐水快速冲洗,然后缓慢注入 150 ml 的 4% 多聚甲醛进行灌注固定,待大鼠肢体僵硬后以脊髓损伤处为中心,取长约 2 cm 脊髓段,置于 4% 多聚甲醛,4 ℃固定 48 h。每组剩余 6 只大鼠麻醉成功后,迅速以脊髓损伤处为中心,取长约 2 cm 脊髓段,放置于EP 管中,迅速放入液氮速冻,-80 ℃ 保存备用。
4. 检测方法:(1) 尼式染色:将厚度 5 μm 的石蜡切片常规脱蜡入水后放入尼氏染色液,置于 60 ℃温箱中浸染 50 min,蒸馏水迅速冲洗 3 遍,再用分色液分色 1~2 min (具体时间根据分色情况而定),晾干,中性树胶封片,镜下观察,采集图片。(2)免疫组化染色:采用免疫组化试剂盒染色,具体步骤如下:酒精梯度脱蜡,纯水漂洗 1 min,微波枸橼酸钠抗原修复,放置常温中冷却至室温。PBS 漂洗3 次,每次 3 min。洗去 PBS,加入过氧化物酶阻断剂室温下孵育 10 min,PBS 洗 3 次,每次 3 min,除去 PBS,加入非免疫动物血清封闭 10 min,不洗,加入一抗 4 ℃ 孵育过夜。次日常温下复温 30 min,PBS 漂洗 3 次,每次 3 min,加入二抗室温孵育10 min,除去 PBS,加入链霉菌抗生物素-过氧化物酶溶液,室温下孵育 10 min,除去 PBS 液,DAB显色,显色时间根据光学显微镜下观察而定,自来水终止显色,苏木素复染 1 min,自来水返蓝 30 s,梯度酒精脱水干燥,二甲苯透明,中性树脂透明封片。在光学显微镜下用低倍镜先定位,再用高倍镜观察。每个指标每个区域选择 6 个不重叠视野进行统计。(3) Western blot 检测:取 1 cm 脊髓剪碎,加裂解液,冰浴 60 min。14 000 g 离心 10 min,BCA法定量蛋白。各孔加入 200 µl BCA 工作液,于 37 ℃烤箱中放置 30 min。在酶标仪中测得标准曲线和吸光度,通过其算出蛋白浓度。蛋白变性后,将样品于相应浓度的 SDS-PAGE 凝胶电泳分离,待 Marker蛋白跑至玻璃板底部且样本蛋白基本呈一条直线沉于底部,则停止跑胶。转至 PVDF 膜封闭,TPBS 洗3 次。封闭液封闭 1.5 h,先后加入一抗二抗,每次步骤间隔均用 TBST 漂洗。用 TBST 清洗去除二抗后开始显影。将膜置于化学发光试剂中反应 1 min,在避光条件下显影,凝胶扫描成像系统进行分析。分别采用 TIMP-2、Collagen I 和 Collagen IV 与 β-actin的吸光度比值表示蛋白的相对表达量。
三、统计学处理
采用 SPSS 20.0 软件对数据进行统计学分析,实验数据采用± s 表示,符合正态分布的用t检验或单因素方差分析,非正态分布资料用秩和检验。BBB 评分不符合正态分布,采用秩和检验;免疫组化和 Western blot 检验符合正态分布,采用单因素方差分析进行比较。
结 果
一、BBB 肢体运动功能评分
与假手术组相比,术后 9 天组 BBB 肢体运动功能评分显著下降。随着损伤后时间的推移,术后 9 天组的 BBB 肢体运动功能评分逐渐升高,与术后 1 天相比,术后 7 天和术后 9 天的大鼠肢体 BBB 运动功能评分升高,差异有统计学意义 (P<0.05) (表1)。
表1 术后 BBB 评分 (± s)Tab.1 BBB score after surgery (± s)
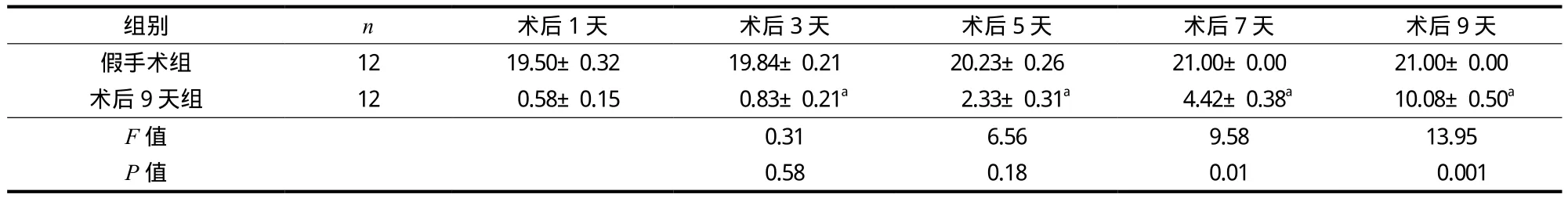
表1 术后 BBB 评分 (± s)Tab.1 BBB score after surgery (± s)
注:与术后 1 天组相比,aP<0.01Notice: Compared with the scores 1 day postoperatively, aP < 0.01
组别 n 术后 1 天 术后 3 天 术后 5 天 术后 7 天 术后 9 天假手术组 12 19.50±0.32 19.84±0.21 20.23±0.26 21.00±0.00 21.00±0.00术后 9 天组 12 0.58±0.15 0.83±0.21a 2.33±0.31a 4.42±0.38a 10.08±0.50a F 值 0.31 6.56 9.58 13.95 P 值 0.58 0.18 0.01 0.001
二、尼式染色
假手术组神经细胞结构完整、形态规则,呈饱满的梭形状,胞质内可见清晰的虎斑样尼氏体,尼氏体饱满,细胞核明显;SCI 各组神经细胞损伤严重,局部可见瘀血斑块,细胞水肿或碎裂,无细胞核,尼氏体萎缩或较小,神经细胞周围可见空泡样变,术后 9 天神经细胞形态有所改善,尼氏体较饱满,细胞水肿减轻 (图1)。
三、免疫组化染色
免疫组化结果发现假手术组未见明显的 TIMP-2、Collagen I 和 Collagen IV 表达。SCI 后 3 天即出现 TIMP-2、Collagen I 和 Collagen IV 的表达且表达量逐渐上升。TIMP-2 表达部位主要在神经元、胶质细胞、单核细胞;Collagen I 和 Collagen IV 弥散性表达于脊髓实质的基质成分中。SCI 各组的 TIMP-2 表达均高于假手术组,差异有统计学意义 (P<0.05);SCI 后 5 天 TIMP-2 表达最高,与其它时间点相比差异有统计学意义 (P<0.05);SCI 各组的 Collagen I和 Collagen IV 表达均高于假手术组,差异有统计学意义 (P<0.05);SCI 后 7 天 Collagen I 和 Collagen IV的表达最高,与其它时间点相比差异有统计学意义(P<0.05) (表2,图2、3)。
四、Western blot
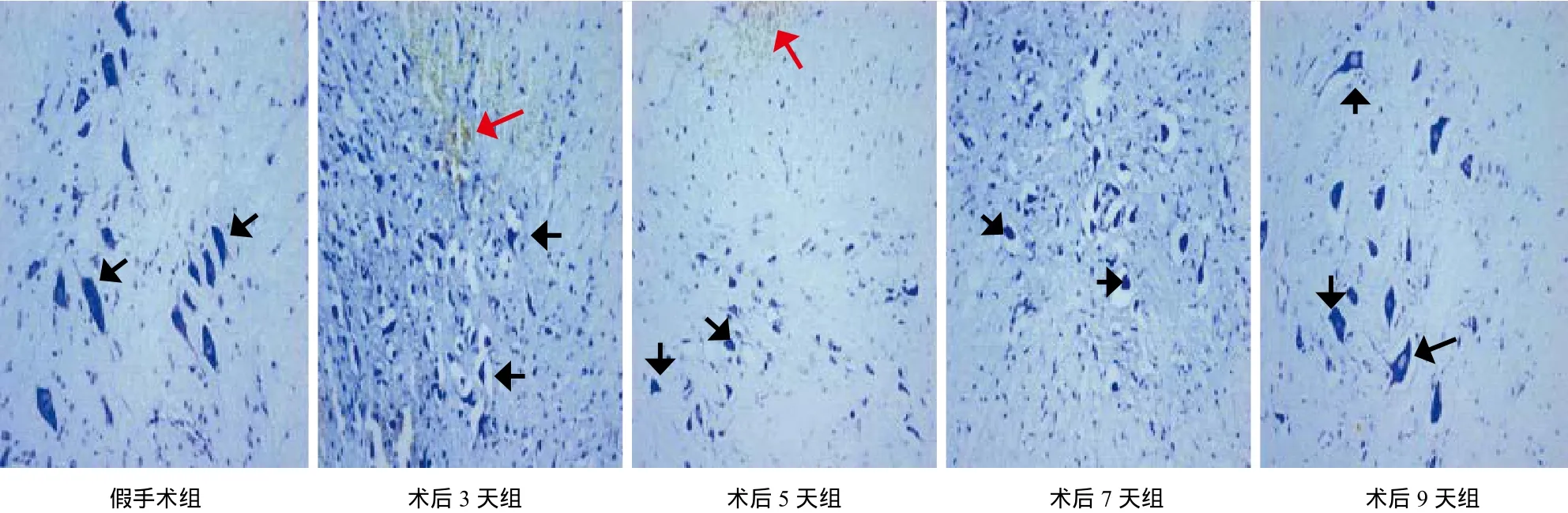
图1 尼氏染色观察各组脊髓神经元形态 (× 200) (注:黑色箭头所示为尼氏体,红色箭头所示为瘀血)Fig.1 Observation of spinal neuron morphology in each group by Nissl staining (× 200) (Notice: Black arrows showed the Nissl body and the red arrows showed the blood stasis)
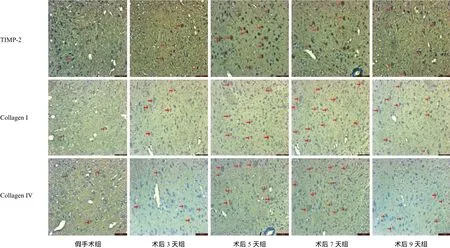
图2 免疫组化观察各组 TIMP-2、Collagen I 和 Collagen IV 表达情况 (× 200) (注:红色箭头所指为阳性反应)Fig.2 Immunohistochemical observation of the expressions of TIMP-2, Collagen I and Collagen IV in each group (× 200) (Notice: Red arrows showed the positive reaction)
表2 各-组大鼠 TIMP-2、Collagen I 和 Collagen IV 表达平均光密度值 (± s)Tab.2 The mean optical -density of TIMP-2, Collagen I and Collagen IV in rats of each group (± s)
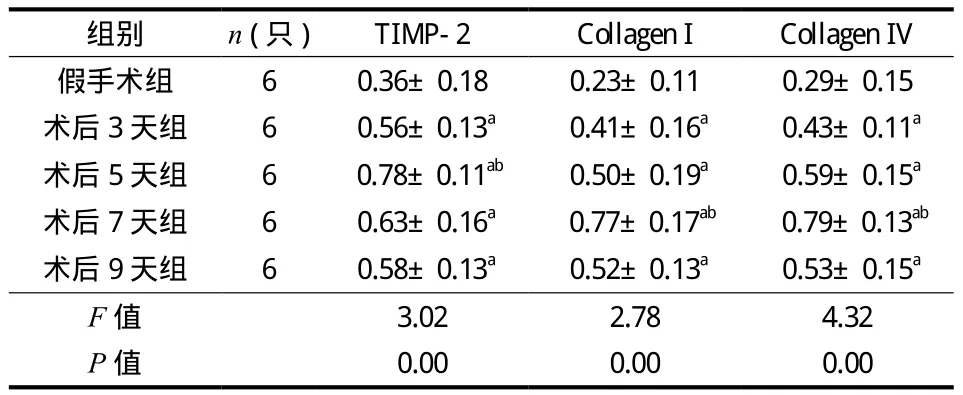
表2 各-组大鼠 TIMP-2、Collagen I 和 Collagen IV 表达平均光密度值 (± s)Tab.2 The mean optical -density of TIMP-2, Collagen I and Collagen IV in rats of each group (± s)
注:与假手术组相比,aP<0.05;与术后其它组相比,bP<0.05Notice: Compared with the sham group, aP < 0.05; Compared with other surgery groups, bP < 0.05
组别 n (只)TIMP-2 Collagen I Collagen IV假手术组 6 0.36±0.18 0.23±0.11 0.29±0.15术后 3 天组 6 0.56±0.13a 0.41±0.16a 0.43±0.11a术后 5 天组 6 0.78±0.11ab 0.50±0.19a 0.59±0.15a术后 7 天组 6 0.63±0.16a 0.77±0.17ab 0.79±0.13ab术后 9 天组 6 0.58±0.13a 0.52±0.13a 0.53±0.15a F 值 3.02 2.78 4.32 P 值 0.00 0.00 0.00
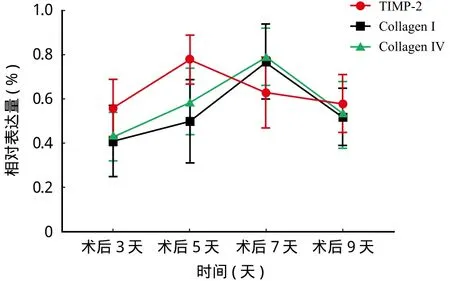
图3 TIMP-2、Collagen I 和 Collagen IV 相对表达量变化趋势Fig.3 Variation trend of relative expressions of TIMP-2, Collagen I and Collagen IV
Western blot 结果显示假手术组的 TIMP-2、Collagen I 和 Collagen IV 蛋白表达量较低。SCI 后TIMP-2、Collagen I 和 Collagen IV 蛋白表达量逐渐增高。SCI 各组中除术后 9 天组外,其它组的 TIMP-2 蛋白表达量均高于假手术组且差异有统计学意义(P<0.05);SCI 后 5 天 TIMP-2 蛋白表达量最高,与其它时间点相比差异有统计学意义 (P<0.05)。SCI 各组 Collagen I 和 Collagen IV 的蛋白表达量均高于假手术组,且差异有统计学意义 (P<0.05);Collagen I 和 Collagen IV 蛋白表达量于 SCI 后 7 天最高,与其它时间点相比差异有统计学意义 (P<0.05)(表3,图4、5)。
表3 各组大鼠 TIMP-2、Collagen I 和 Collagen IV 蛋白表达量(± s)Tab.3 The mean optical density of TIMP-2, Collagen I and Collagen IV in rats of each group (± s)
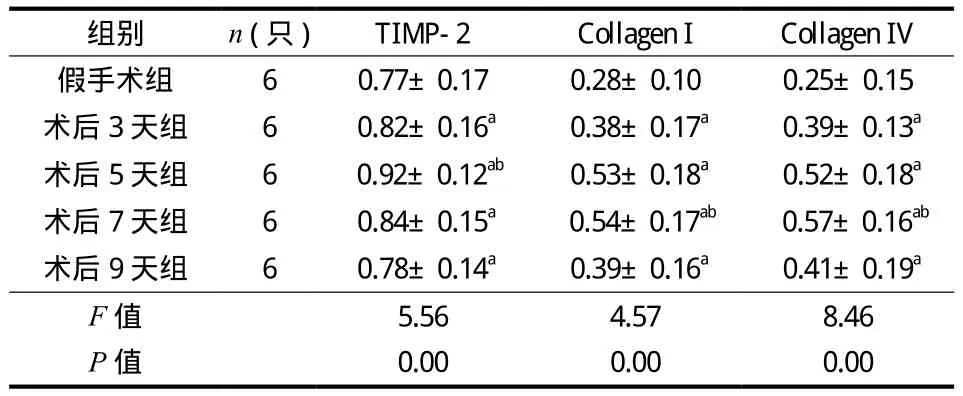
表3 各组大鼠 TIMP-2、Collagen I 和 Collagen IV 蛋白表达量(± s)Tab.3 The mean optical density of TIMP-2, Collagen I and Collagen IV in rats of each group (± s)
注:与假手术组相比,aP<0.05;与术后其它组相比,bP<0.05Notice: Compared with the sham group, aP < 0.05; Compared with other surgery groups, bP < 0.05
组别 n (只)TIMP-2 Collagen I Collagen IV假手术组 6 0.77±0.17 0.28±0.10 0.25±0.15术后 3 天组 6 0.82±0.16a 0.38±0.17a 0.39±0.13a术后 5 天组 6 0.92±0.12ab 0.53±0.18a 0.52±0.18a术后 7 天组 6 0.84±0.15a 0.54±0.17ab 0.57±0.16ab术后 9 天组 6 0.78±0.14a 0.39±0.16a 0.41±0.19a F 值 5.56 4.57 8.46 P 值 0.00 0.00 0.00
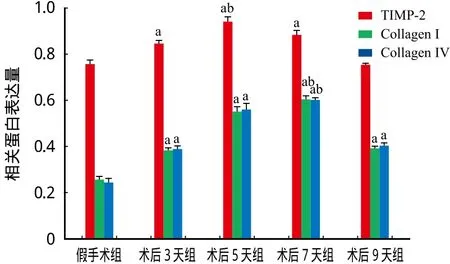
图4 各组 TIMP-2、Collagen I 和 Collagen IV 蛋白表达量 (注:与假手术组相比,aP < 0.05;与术后其它组相比,bP < 0.05)Fig.4 Protein expressions of TIMP-2, Collagen I and Collagen IV in each group (Notice: Compared with the sham group, aP < 0.05;Compared with other surgery groups, bP < 0.05)

图5 Western blot 检测各组 TIMP-2、Collagen I 和 Collagen IV蛋白表达情况Fig.5 Expressions of TIMP-2, Collagen I and Collagen IV in each group by Western blot
讨 论
SCI 包括原发性损伤和继发性损伤,原发性损伤主要是由于脊髓受到机械性打击造成组织结构破坏,包括细胞死亡,细胞外基质间相互作用被切断,损伤局部出现水肿,血脊髓屏障被破坏,以及炎症发生,炎症细胞浸润和炎性因子浸润,内环境紊乱等,原发性损伤后,由于血脊髓屏障通透性增加,导致血管内物质大量外漏,进一步加剧出血、水肿、炎症等继发性损伤[1-3,11]。在本实验中随着时间的推移,SCI 大鼠的 BBB 评分结果提示损伤后7 天开始显著升高,说明其肢体功能障碍改善可能与炎症逐渐消散,内环境慢慢修复,出血和水肿进一步减轻有关。这也与相关实验结果与本实验结果相一致[12]。
TIMP-2 是一种可溶性的低分子量分泌型糖蛋白,其作为一种内源性的酶类,能够抑制 ECM 成分(如:胶原、明胶、蛋白多糖、基膜等) 的降解,在促进伤口修复,抑制炎性反应等过程中起到重要作用[4,13]。TIMP-2 不仅能抑制 ECM 成分的降解,同时,还能发挥细胞生长因子样作用,促进胶原蛋白生成及成肌纤维细胞的增生活化[14]。在本实验中,SCI 大鼠可见大量 TIMP-2 表达,并在术后 5 天达到高峰,可能的机制是 SCI 发生后原有血脊髓屏障发生破坏,维持脊髓组织中微血管内皮骨架结构血管基膜发生裂解,其完整性受到破坏,开始出现水肿,炎症,出血,缺氧,细胞凋亡,神经元受损等病理现象,TIMP-2 被激活并开始大量表达[2,8,11]。TIMP-2 维持在较高表达水平后,对 ECM 的降解发挥抑制作用,从而维持损伤内环境的稳定,有利于组织修复。但术后 5 天由于组织慢慢恢复,缺氧、缺血得到改善,对内皮细胞,神经元等的刺激也逐渐减弱,因此,TIMP-2 也不会被过度激活,其表达逐渐降低。TIMP-2 与 MMPs 相结合后形成酶原-TIMP 复合体,从而抑制 MMPs 的活性。在一般正常生理情况下,此二者的比例是保持一种动态平衡关系,从而维持着 ECM 有序的合成和降解。在病理状态下,二者的平衡被打破,如脊髓损伤后,炎症因子释放过多,基质大量被溶解,EMC 降解减少,因此造成积聚[15-17]。MMPs 被激活后,就能够发挥降解 EMC 的生物学作用。因此将其活性严格地控制在一定的程度,对维持机体的正常稳定状态具有重要的意义。
Collagen I 主要来自哺乳动物正常组织中真皮层,成纤维细胞、成骨细胞、成软骨细胞等,具有形成和保持骨与结缔组织的完整性的作用[18]。研究也表明,Collagen I 能够参与损伤血管的重新构建,与血管形成密切相关,同时在形成特定的细胞外微环境中也起到主要作用,而这些特定的细胞外微环境对于细胞生存,维持细胞完整性及细胞之间信号传递有着重要意义和作用[9,19]。此外,Collagen I 可以通过盘蛋白、整合素等向细胞内传递细胞外环境中的刺激信号,发挥其生物学功能;通过截留、保存、运输生长因子从而起到信号分子的作用[9,20]。这些功能在器官发育、伤口组织愈合与修复中发挥重要作用。在正常脊髓组织中,Collagen I 并无明显表达,SCI 后,由于出血,水肿等病理因素的刺激,Collagen I 开始表达[21]。
Collagen IV 作为 ECM 中基膜的主要组成组分,广泛分布于全身组织,起组织连接、促进损伤血管再生作用,对维持内环境的平衡稳定具有重要意义[22-24]。Collagen IV 在正常的中枢神经系统中,仅存在于微血管周围和脑脊膜中,由血管内皮细胞分泌并包绕血管内皮细胞,也是构成微血管管壁的主要成分之一,在脊髓实质中的其它部分并无明显表达[8]。当脊髓受到打击后,ECM 遭到破坏,基膜成分开始裂解,血管内皮细胞坏死、凋亡,Collagen IV 开始降解,但由于生理病理因素的影响,血管再生机制被很快激活,作为构成微血管主要成分的Collagen IV 开始大量合成,研究表明,SCI 早期,Collagen IV 的合成有利于阻碍炎症的发生[25]。
本研究发现术后 3 天 Collagen I、Collagen IV 开始明显表达,术后 7 天 Collagen I、Collagen IV 表达到最高峰,随后开始慢慢下降。其可能的机制为:SCI 后,TIMP-2,Collagen I、Collagen IV 开始表达,高表达的 TIMP-2 促进 Collagen IV 过度表达,同时过度表达的 Collagen IV 形成的某种机械屏障能限制轴突再生,从而阻碍神经功能的恢复,此时Collagen I 表达水平也并未很高,对组织的修复能力很弱。术后 5 天,TIMP-2 表达到最高峰随后开始下降,其对 Collagen IV 表达的促进作用减弱,Collagen IV 表达减少,机械屏障开始分解,神经正常的生理功能得以恢复,与此同时 Collagen I 在损伤后 7 天表达最高,其所发挥的血管重建,组织修复等作用也达到最高峰,所以 BBB 评分在损伤后 7 天显著升高。研究证明[26-27],SCI 后过度表达的 Collagen IV形成的胶质瘢痕发挥机械屏障作用,能够限制轴突的再生与传导功能,从而影响神经功能的恢复。
本实验研究结果为治疗 SCI 提供一个新思路,即在损伤早期提高 Collagen I 的表达,通过调控TIMP-2 的表达,控制 Collagen IV 表达水平使其不形成胶质瘢痕的同时还能限制炎症反应。
参 考 文 献
[1]王想福, 王兴盛, 王国玉. 脊髓损伤的药物治疗研究进展[J].中国中医骨伤科杂志, 2014, (8):76-78.
[2]Volarevic V, Erceg S, Bhattacharya SS, et al. Stem cellbased therapy for spinal cord injury[J]. Cell Transplant, 2013,22(8):1309-1323.
[3]Min SH, Lee SH, Shim H, et al. Development of complete thoracic spinal cord transection model in rats for delayed transplantation of stem cells[J]. Spine, 2011, 36(3):155-163.
[4]Łukaszewicz-Zając M, Mroczko B, Guzińska-Ustymowicz K, et al. Matrix metalloproteinase 2 (MMP-2) and their tissue inhibitor 2 (TIMP-2) in gastric cancer patients[J]. Adv Med Sci,2013, 58(2):235-243.
[5]Hsu JY, Mckeon R, Goussev S, et al. Matrix metalloproteinase-2 facilitates wound healing events that promote functional recovery after spinal cord injury[J]. J Neurosci, 2006,26(39):9841.
[6]Page-McCaw A, Ewald AJ, Werb Z. Matrix metalloproteinases and the regulation of tissue remodelling[J]. Nat Rev Mol Cell Biol, 2007, 8(3):29-33.
[7]Yong VW, Agrawal SM, Stirling DP. Targeting MMPs in acute and chronic neurological conditions[J]. Neurotherapeutics,2007, 4(4):580-589.
[8]Anik I, Kokturk S, Genc H, et al. Immunohistochemical analysis of TIMP-2 and collagen types I and IV in experimental spinal cord ischemia-reperfusion injury in rats[J]. J Spinal Cord Med, 2011, 34(3):257-264.
[9]Dunham KA, Floyd CL. Contusion models of spinal cord injury in rats[M]. Humana Press. 2011: 345-362.
[10]D’Amico F, Skarmoutsou E, Mangano K, et al. Isoproterenol modulates matrix metalloproteinase-2 (MMP-2) and its tissue inhibitor-2 (TIMP-2) in rat parotid gland[J]. Arch Oral Biol,2013, 58(4):370-376.
[11]Sharma HS. Pathophysiology of blood-spinal cord barrier in traumatic injury and repair[J]. Curr Pharm Des, 2005,11(11):1353.
[12]马珊珊, 渠瑞娜, 田毅, 等. 脐带沃顿胶干细胞移植对脊髓损伤大鼠炎症因子表达的影响[J]. 中国组织工程研究, 2015,19(23):3729-3735.
[13]Zhang H, Adwanikar H, Werb Z, et al. Matrix metallopro-teinases and neurotrauma: evolving roles in injury and reparative processes[J]. Neuroscientist, 2010, 16(2):156-170.
[14]Larsen MB, Stephens RW, Brünner N, et al. Quantification of tissue inhibitor of metalloproteinases 2 in plasma from healthy donors and cancer patients[J]. Scand J Immunol, 2005,61(5):449-460.
[15]Gharagozlian S, Svennevig K, Bangstad HJ, et al. Matrix metalloproteinases in subjects with type 1 diabetes[J]. BMC Clin Pathol, 2009, 9(1):7.
[16]Yang J, Zhou Q, Wang Y, et al. Effect of high glucose on PKC and MMPs / TIMPs in human mesangial cells[J].Zhongnandaxue Xuebao Yixueban, 2009, 34(5):425-431.
[17]Kowluru RA, Kanwar M. Oxidative stress and the development of diabetic retinopathy: contributory role of matrix metalloproteinase-2[J]. Free Radic Biol Med, 2009,46(12):1677-1685.
[18]Giannelli G, Bergamini C, Marinosci F, et al. Clinical role of MMP-2 / TIMP-2 imbalance in hepatocellular carcinoma[J]. Int J Cancer, 2002, 97(4):425.
[19]Haifei S, Xingang W, Shoucheng W, et al. The effect of collagen-chitosan porous scaffold thickness on dermal regeneration in a one-stage grafting procedure[J]. J Mech Behav Biomed Mater, 2014: 114-125.
[20]Hong F, Saiman Y, Si C, et al. X4 Human immunodeficiency virus type 1 gp120 promotes human hepatic stellate cell activation and collagen I expression through interactions with CXCR4[J]. PloS One, 2012, 7(3):e33659.
[21]Kong D, Kong X, Wang L. Effect of cardiac lymph flow obstruction on cardiac collagen synthesis and interstitial fibrosis[J]. Physiol Res, 2006, 55(3):253-258.
[22]Cardoso FL, Brites D, Brito MA. Looking at the bloodbrain barrier: molecular anatomy and possible investigation approaches.[J]. Brain Res Rev, 2010, 64(2):328.
[23]Takigawa T, Yonezawa T, Yoshitaka T, et al. Separation of the perivascular basement membrane provides a conduit for inflammatory cells in a mouse spinal cord injury model[J].J Neurotrauma, 2010, 27(4):739-751.
[24]Anik I, Kokturk S, Genc H, et al. Immunohistochemical analysis of TIMP-2 and collagen types I and IV in experimental spinal cord ischemia-reperfusion injury in rats[J]. J Spinal Cord Med, 2011, 34(3):257-264.
[25]Wu HJ, Yiu WH, Li RX, et al. Mesenchymal stem cells modulate albumin-induced renal tubular inflammation and fibrosis[J]. PloS One, 2014, 9(3):e90883.
[26]Liesi P, Kauppila T. Induction of type IV collagen and other basement-membrane-associated proteins after spinal cord injury of the adult rat may participate in formation of the glial scar[J].Exp Neurol, 2002, 173(1):31-45.
[27]Iseda T, Nishio T, Kawaguchi S, et al. Spontaneous regeneration of the corticospinal tract after transection in young rats:collagen type IV deposition and astrocytic scar in the lesion site are not the cause but the effect of failure of regeneration[J].J Comp Neurol, 2003, 464(3):343-355.
