单中心 194 例非计划手术后软组织肉瘤再次手术疗效及预后分析
2018-05-23冯奇郭鹏王东来张晓宇冯建刚
冯奇 郭鹏 王东来 张晓宇 冯建刚
软组织肉瘤是源于间叶组织的恶性肿瘤,占全部恶性肿瘤的不足 1%,其治疗方案以手术为主的综合治疗。软组织肉瘤非计划手术 (soft tissue sarcoma unplanned excision,STSUE) 最早由 Giuliano 等[1]于 1985 年提出,指在没有进行充分术前影像学检查、病理学活检、缺乏整体外科边界评估的情况下进行的切除方式。此类手术常常因对肿瘤性质认识偏差,术前检查不完善,造成手术切除范围不足,甚至仅进行了切取活检而造成肿瘤残余,因此又称为首次不恰当切除术 (initial inadequate excision,IIE)[2-4]。目前认为非计划手术后软组织肉瘤均应行再次手术治疗,以达到广泛切除目的[5],但影响患者疗效及预后的因素尚缺乏统一的认识。本研究回顾性分析于我院行再次手术的 194 例非计划手术后软组织肉瘤患者,探讨并分析影响再次手术疗效及预后的因素。
材料与方法
一、纳入与排除标准
1. 纳入标准:(1) 病理确诊为软组织肉瘤者;(2) 既往接受一次或多次非计划手术,其中包括按良性肿瘤或炎症包块进行的边缘切除、切取活检或术前已知为恶性肿瘤,但缺乏影像学检查评估边界,术中侵入瘤内、未完整切除等情况者;(3) 均于我院行再次手术治疗者;(4) 临床病理资料完整,随访数据齐全者。
2. 排除标准:(1) 术后病理诊断不明确者;(2)非计划手术软组织肉瘤患者于我院未行再次手术治疗者;(3) 临床病理资料不完整或拒绝进一步行随访患者。
二、一般资料
回顾性分析 2007 年 1 月至 2016 年 1 月在我院骨科收治的 STSUE 术后再次行手术治疗患者194 例, 男 115 例,女 79 例,年龄 9~80 岁,中位年龄 50 岁。肿瘤病理类型包括:皮肤隆突性纤维肉瘤 18 例、未分化肉瘤 35 例、横纹肌肉瘤 8 例、滑膜肉瘤 35 例、肌纤维母细胞肉瘤 30 例、纤维肉瘤 16 例、脂肪肉瘤 28 例、其它类型如血管肉瘤、骨外尤文肉瘤等共 24 例,肿瘤位于浅表者 57 例,侵及深部者 137 例,生长部位包括:上肢 87 例,下肢 43 例,躯干 23 例,骨盆周围 18 例,腋窝、腹股沟、锁骨等窝区 23 例。其它纳入分析的因素包括原发肿瘤大小、肿瘤是否存在临近骨侵犯、STSUE 术后至再次手术时间、STSUE 方式、是否经放疗 / 化疗、术前是否有局部复发及转移、再次手术切除方式、再次手术后病理肿瘤大小、肿瘤组织 Ki-67 表达水平 (表1)。全部患者通过电话与门诊随访的方式进行术后病例资料采集,生存时间计算以患者手术日至患者死亡日或随访截止日为结束,删失包括失访以及随访期间非肿瘤原因导致死亡者。
三、统计学处理
应用 SPSS 19.0 及 GraphPad Prism 6 软件进行统计分析,以P<0.05 为差异有统计学意义。各临床病理资料采用 Kaplan-Meier 法行单因素分析,结合患者随访时间应用 Cox 行多因素分析。

表1 非计划软组织肉瘤患者一般资料Tab.1 General information of patients with unplanned surgery
结 果
一、局部复发
本研究中患者再次手术后复发共 83 例,复发率为 42.8%,中位无复发生存时间为 9 (1~47) 个月,单因素分析结果显示:患者无复发生存期 (recurrence-free survival,RFS) 与就诊年龄、肿瘤病理类型、STSUE 术后至再次手术时间、再次手术前肿瘤复发、临近骨侵犯、原发肿瘤大小、肿瘤位置、再次手术切除方式、再次手术后病理肿瘤大小、再次手术前淋巴结转移、化疗及肿瘤组织 Ki-67 表达水平有关,差异有统计学意义 (P<0.05) (图1);将单因素分析有统计学差异的影响因素纳入 Cox 多因素回归结果显示,仅 Ki-67 表达水平为影响患者 RFS 的独立危险因素 (表2)。
二、远处转移
本研究中患者再次手术后出现新发远处转移或原有转移灶进展 59 例,转移率为 30.4%,其中包括肺转移 47 例 (24.2%)、骨转移 5 例 (2.6%)、淋巴结转移 2 例 (1.0%),其它部位 5 例 (2.6%),中位无转移时间为 6 (1~55) 个月,单因素分析显示:患者无转移生存时间与肿瘤病理类型、STSUE 术后至再次手术时间、临近骨侵犯、再次手术前肿瘤复发或淋巴结转移、原发肿瘤大小、肿瘤位置、再次手术后病理肿瘤大小、肿瘤组织 Ki-67 表达水平、化疗有关 (P<0.05) (图2);将单因素分析有统计学差异的影响因素纳入多因素 Cox 回归结果显示:肿瘤病理类型、是否有骨侵犯、原发肿瘤大小、Ki-67表达水平为影响患者无转移生存期 (metastasis-free survival,MFS) 的独立危险因素 (表2)。
三、总生存率
本研究随访期 4~60 个月,中位生存期 30 个月,5 年总生存率 70.1% (135 / 194),单因素分析显示:肿瘤病理类型、STSUE 术后至再次手术时间间隔、再次手术前肿瘤复发、临近骨侵犯、再次手术前内脏转移或淋巴结转移、原发肿瘤大小、肿瘤位置、再次手术切除方式、再次手术后病理肿瘤大小、Ki-67 表达水平、再次手术后转移部位、化疗是影响患者总生存期 (overall survival,OS) 的重要影响因素 (P<0.05) (图3);将单因素分析有统计学差异的影响因素纳入多因素 Cox 回归结果显示:STSUE 术后至再次手术时间、Ki-67 表达水平、再次手术后转移部位是影响患者 OS 的独立危险因素(表2)。
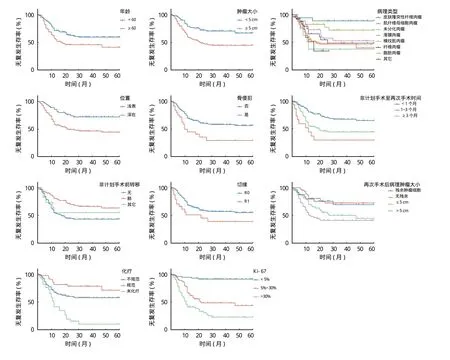
图1 影响软组织肉瘤患者 RFS 的生存分析Fig.1 Survival analysis of RFS of the soft tissue sarcoma patients
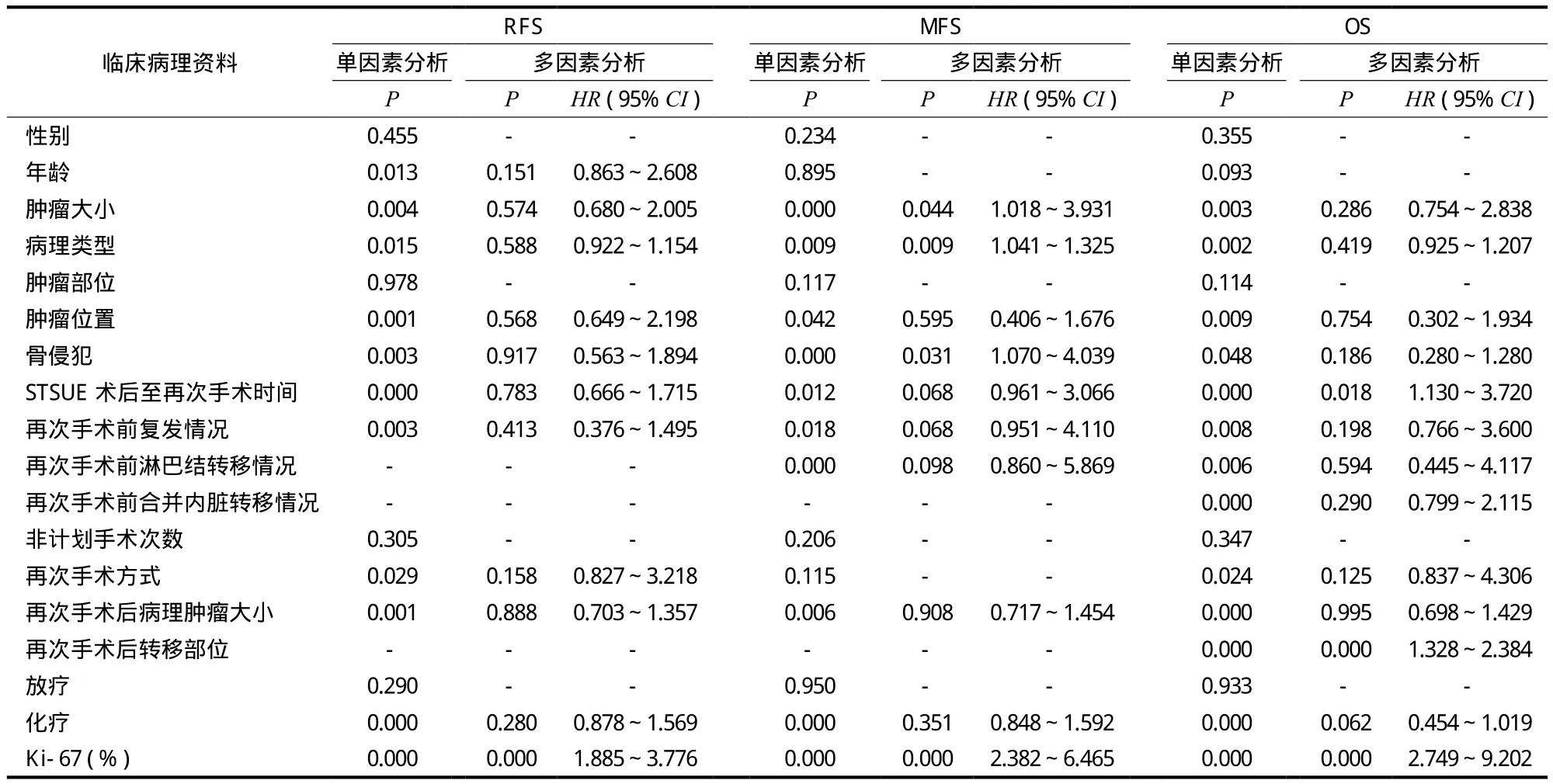
表2 软组织肉瘤非计划手术患者单、多因素分析Tab.2 ANOVA and LSD analysis of soft tissue sarcoma patients with unplanned surgery
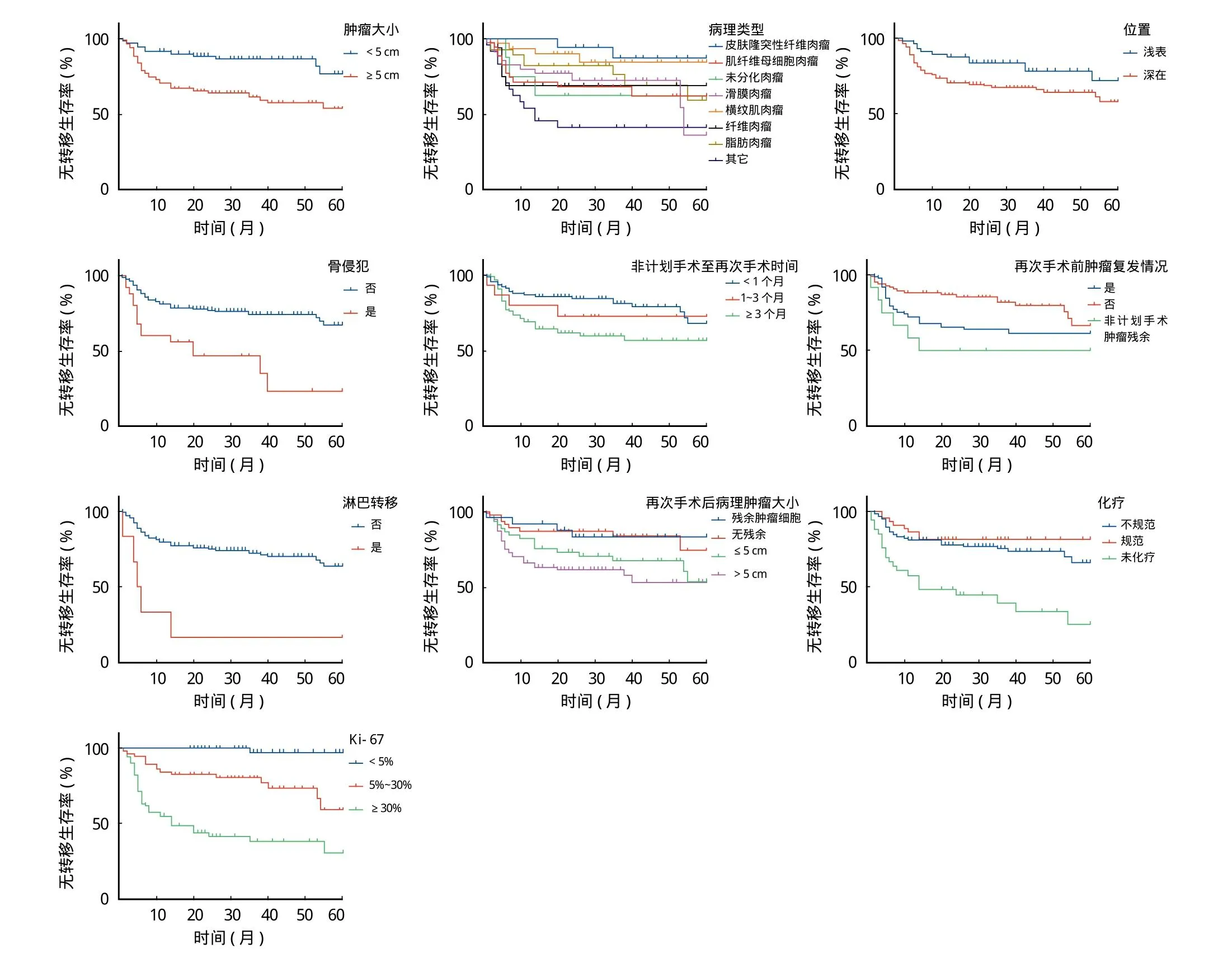
图2 影响软组织肉瘤患者 MFS 的生存分析Fig.2 Survival analysis of MFS of the soft tissue sarcoma patients

图3 影响软组织肉瘤患者 OS 的生存分析Fig.3 Survival analysis of OS of the soft tissue sarcoma patients
讨 论
一、流行病学
软组织肉瘤是间叶源性恶性肿瘤,发病率低,据 WHO 统计,年发病率仅为 3 / 10 万,占全部恶性肿瘤不足 1%。但软组织肉瘤可发病于任何年龄段、全身任何部位,目前已发现 56 种不同亚型[6]。尽管近年来软组织肉瘤发病率及诊治率逐年提高,但由于基层医疗机构对其认识不足,术前缺乏完善的影像学、病理学检查,未行手术切缘的评估,软组织肉瘤初治非计划手术的情况仍时有发生[7-8]。有研究显示,STSUE 的发生可能与肿瘤大小、部位、病理类型相关,Alamanda 等[9]认为原发肿瘤较小、上肢的软组织肉瘤、发病位置位于浅表者更易被当作良性肿瘤进行局部切除,而最易发生非计划手术的病理类型包括滑膜肉瘤、未分化肉瘤、中高级脂肪肉瘤[10-11]。不同文献报道,STSUE 切除后肿瘤残余率24%~91%[12-15],而不适当的初次非计划手术切口及引流管位置选择,导致再次手术时切口选择、瘤床切除后创面覆盖的困难[16]。本组病例中,肿瘤病理类型滑膜肉瘤、未分化肉瘤、脂肪肉瘤三种亚型共98 例,占全部病例 50.5%,发病部位位于上肢者共87 例,占全部病例 44.8%,与上述报道相符,但原发肿瘤大小 ≤ 5 cm 者仅有 36.6%,肿瘤位于浅表组织者仅有 29.4%,且有 20.1% 的患者在行既往曾接受多次的非计划手术,有 50.0% 的患者在接受非计划手术后未及时就诊,而是在肿瘤出现明显临床复发后才就诊行再次手术切除,有 75.8% 的患者再次手术后病理提示有肿瘤组织或肿瘤细胞残留,可能与本地域基层医疗机构对软组织肉瘤认识不足,初次非计划手术后需及时补充广泛切除意识差有关。
二、非计划手术后再次手术疗效分析
目前多数研究认为,非计划手术后软组织肉瘤患者较接受计划手术者局部复发率明显增高[17-19],Potter等[20]研究显示非计划手术后软组织肉瘤 5 年局部无复发率明显低于计划手术患者 (63.7% vs 89.7%,P<0.05),同时不适当的初次非计划手术也会导致再次手术时瘤床切除困难,破坏多个间室,难以广泛切除,甚至增加截肢率。本组患者再次手术达到广泛切除的共 170 例 (87.6%),但仍有 24 例再次手术后病理提示切缘阳性 (12.4%),对这部分患者回顾分析发现其中肿瘤侵及多个间室无法广泛切除但拒绝接受截肢者 8 例,侵及临近重要血管行血管外膜剥离,术后病理提示血管旁组织受侵 13 例,另有 3 例为补充瘤床切除范围不足,可能与再次手术经磁共振提示的肿瘤反应区切除,存在肿瘤细胞残留有关。尽管单因素分析显示再次手术未达到广泛切除患者 RFS 及 OS 较短,但在 Cox 多因素回归分析中再次手术切除方式未对预后产生影响。全部患者再次手术后随访期内复发率为 42.8%,远处转移率 30.4%,总生存率 70.1%,局部控制率低于文献报道,可能与本组病例肿瘤恶性程度较高,预后不良有关。软组织肉瘤以血行转移为主,最常见的转移部位为肺部,其次是骨,腹腔及腹膜后软组织肉瘤易发生肝转移,淋巴结转移则较为少见[6,21-23],但在部分特殊类型软组织肉瘤如透明细胞肉瘤、上皮样肉瘤、胚胎型横纹肌肉瘤,淋巴结转移较为常见[24-25]。软组织肉瘤患者接受非计划手术不规范切除,可能导致术中肿瘤种植、播散,不仅造成肿瘤残余,同时导致软组织肉瘤转移率增高,预后不良。本组患者中有 14 例再次手术前合并内脏转移(7.2%),其中 10 例为肺转移 (5.1%),而术后出现新发转移或转移灶进展 59 例,肺转移 47 例 (24.2%)、骨转移 5 例 (2.6%)、淋巴结转移 2 例 (1.0%),其它部位 5 例 (2.6%),进一步分析发现再次手术前淋巴结转移的 6 例中 2 例术后淋巴结转移灶进展,术前无淋巴结转移患者均未出现新发淋巴结转移,病理类型包括未分化肉瘤 2 例,上皮样肉瘤、横纹肌肉瘤、透明细胞肉瘤、肌纤维母细胞肉瘤各 1 例。
三、预后影响因素分析
1. 软组织肉瘤临床病理特点研究显示,肿瘤病理类型、肿瘤所在位置深浅、非计划手术后瘤床切除是否完整等是影响非计划手术后软组织肉瘤患者预后的独立危险因素[7,14,16]。Chandrasekar 等[26]通过随访 363 例非计划手术患者,67% 的高级别软组织肉瘤,再次手术时因切除范围不足,而导致更高的局部复发风险。Davis 等[27]研究发现,再次手术后切缘阴性的患者,获得更好的局部控制率。在实际临床工作中,一些恶性程度较高且原发肿瘤位置深在的软组织肉瘤,非计划手术造成局部反应区广泛难以确定准确的切除范围,再次手术后仍可能存在肿瘤组织残余,此类患者往往局部复发率高,预后不佳[28]。关于非计划手术后,再次手术时机的选择,Han 等[29]指出 STSUE 术后延迟 22~50 天再次手术患者预后无明显影响。有研究表明,对 44 例非计划手术软组织肉瘤行再次手术治疗的报道显示,再次手术前已出现肿瘤复发组的人群,其局部再复发率明显高于再次手术前无肿瘤复发组,转移率及总生存率两组之间无明显差异。对于软组织肉瘤骨侵犯的相关报道较少,目前多数学者认为软组织肉瘤侵及临近骨组织可能提示肿瘤存在更高的局部侵袭性,预后不良,Yan 等[30]对 30 例关节周围骨侵犯的软组织肉瘤患者行肿瘤及受侵瘤段骨切除,肿瘤型假体重建,获得了 61.6% 和 30.8% 的 2 年、5 年生存率。Ki-67 是一种存在于增殖细胞中的核抗原,Ki-67 免疫组化染色标记大部分 G0 期以外的细胞,Ki-67 阳性百分比高提示处于增殖周期的细胞比例高,在多种肿瘤中 Ki-67 过表达与预后不良相关[31]。
本组病例通过 Cox 回归分析研究影响患者RFS、MFS 及 OS 的预后因素。皮肤隆突性纤维肉瘤非计划手术后再次手术的 RFS、MFS 及 OS 均较其它病理类型延长,但在 Cox 多因素回归中肿瘤病理类型仅对 MFS 产生影响。延迟再次手术 (>3 个月) 患者 RFS 及 OS 均缩短,在 Cox 多因素回归中也发现 STSUE 术后至再次手术时间是影响 OS 的独立危险因素,因此推荐非计划手术后软组织肉瘤患者应尽早行补充瘤床切除。本组病例中单因素分析显示再次手术前出现肿瘤复发、存在临近骨侵犯、合并淋巴结转移患者的 RFS、MFS 及 OS 均缩短,表明这部分患者肿瘤临床表现存在更高的侵袭转移能力,但在 Cox 多因素回归中发现肿瘤是否存在临近骨侵犯是影响非计划手术后软组织肉瘤 MFS 的独立危险因素。对肿瘤大小,本组病例分为原发肿瘤大小及再次手术后病理肿瘤大小两个因素,单因素分析显示不论原发或再次手术后病理肿瘤直径>5 cm患者 RFS、MFS、OS 均有缩短,而在 Cox 多因素回归中则显示,原发肿瘤大小是影响 MFS 的独立危险因素,表明原发肿瘤直径>5 cm 的患者伴随更高的转移风险。本组病例研究显示 Ki-67 表达水平 ≥30% 阳性者 RFS、MFS 及 OS 均缩短,Cox 多因素回归分析显示 Ki-67 表达水平是影响患者 RFS、MFS及 OS 的独立危险因素,提示肿瘤组织 Ki-67 表达水平可能是非计划手术后软组织肉瘤患者预后的敏感指标。
多数学者认为,肿瘤转移是导致软组织肉瘤患者死亡的主要因素[4,7-9],本组病例单因素分析提示,再次手术后无转移患者 OS 明显延长,差异有统计学意义,Cox 多因素回归分析也提示再次手术后远处转移情况是影响患者 OS 的独立危险因素。
2. 放疗、化疗的影响:对于放疗在非计划手术后软组织肉瘤中的意义,有研究显示放疗联合瘤床切除可以降低非计划手术后软组织肉瘤的局部再次复发率,但单纯放疗却不能降低局部复发率,另外放疗并不能减少远处转移,对总生存率无影响[4]。化疗在软组织肉瘤中的作用始终存在争议,仅在尤文肉瘤、胚胎型 / 腺泡型横纹肌肉瘤作为 I 类推荐,但化疗作为全身治疗手段,在相对敏感型的晚期高级别软组织肉瘤中仍广泛应用,美国癌症联合委员会推荐存在远处转移或高风险的非计划手术后软组织肉瘤应接受化疗[32],而 2015 版的软组织肉瘤诊治中国专家共识也提出化疗有助于提高肿瘤 R0 切除率、增加患者保肢机会,降低术后复发转移风险,延长患者 OS 并提高生活质量。尽管近年来不断有新的化疗方案及靶向药物应用于临床,但在晚期非特殊类型软组织肉瘤治疗中,阿霉素 (ADM) 和异环磷酰胺 (IFO) 仍作为两大基石类药物应用于一线治疗。而对于二线治疗有研究显示在 ADM 失败后使用PLD 可能获益[33];而在平滑肌肉瘤和未分化多形性肉瘤中,以 GEM 为核心的二线联合方案较单药更有生存优势[34]。
对于放疗、化疗对预后的影响,本组病例在单因素分析中未发现是否接受放疗影响患者预后,可能与本组病例接受放疗患者较少 (15 / 194)、放疗剂量差异有关。本组病例中共有 77 例 (39.7%) 再次手术前后接受过化疗,但仅有 57.1% 的化疗患者接受过不少于 4 周期、包含 ADM 和 (或) IFO 方案的规范化化疗,而单因素分析显示接受不规范化疗患者的 RFS、MFS 及 OS 均较短,Cox 多因素回归未显示患者接受化疗情况对 RFS、MFS 及 OS 产生影响,提示尽管化疗对预后的影响尚不明确,但接受化疗的非计划手术后软组织肉瘤患者可能存在着更高的复发转移风险,且高级别软组织肉瘤患者化疗应尽量做到规范、足量、足疗程。
四、本研究局限性
本研究回顾性分析为 STSUE 初探,研究共纳入 194 例,样本量较小,未能与同期行计划手术软组织肉瘤患者对比分析预后影响因素。随访时间较短,患者失访率较高;由于单病种患者总人数较少而纳入因素较多,故肿瘤病理分类无法进行单病种分类,故结果偏移较为明显。尽管如此,本研究对STSUE 的治疗也存在的一定的参考价值。
综上所述,软组织肉瘤的局部复发对肿瘤的转移率及患者的总体生存率无明显影响,但会明显降低患者的无病生存率。软组织肉瘤一旦诊断明确应及时行二次扩大切除术治疗,尽量减少复发及提高无病生存率。
参 考 文 献
[1]Giuliano AE, Eilber FR. The rationale for planned reoperation after unplanned total excision of soft-tissue sarcomas[J]. J Clin Oncol, 1985, 3(10):1344-1348.
[2]Erstad DJ, Ready J, Abraham J, et al. Amputation for extremity sarcoma: contemporary indications and outcomes[J]. Ann Surg Oncol, 2018, 25(2):394-403.
[3]García-Jiménez A, Trullols-Tarragó L, Peiró-Ibáñez A, et al.Analysis of results of soft tissue sarcoma margins revision surgery[J]. Rev Esp Cir Ortop Traumatol, 2016, 60(6):366-371.
[4]Jones DA, Shideman C, Yuan J, et al. Management of unplanned excision for soft-tissue sarcoma with preoperative radiotherapy followed by definitive resection[J]. Am J Clin Oncol, 2016, 39(6):586-592.
[5]Qureshi SS, Prabhu A, Bhagat M, et al. Re-excision after unplanned resection of nonmetastatic nonrhabdomyosarcoma soft tissue sarcoma in children: Comparison with planned excision[J]. J Pediatr Surg, 2017, 52(8):1340-1343.
[6]Jernigan EW, Esther RJ. Soft tissue masses for the general orthopedic surgeon[J]. Orthop Clin North Am, 2015, 46(3):417-428.
[7]Nakamura T, Kawai A, Sudo A. Analysis of the patients with soft tissue sarcoma who received additional excision after unplanned excision: report from the Bone and Soft Tissue Tumor Registry in Japan[J]. Jpn J Clin Oncol, 2017, 47(11):1055-1059.
[8]Wang L, Pretell-Mazzini J, Kerr DA, et al. MRI findings associated with microscopic residual tumor following unplanned excision of soft tissue sarcomas in the extremities[J].Skeletal Radiol, 2018, 47(2):181-190.
[9]Alamanda VK, Delisca GO, Archer KR, et al. Incomplete excisions of extremity soft tissue sarcomas are unaffected by insurance status or distance from a sarcoma center[J]. J Surg Oncol, 2013, 108(7):477-480.
[10]Alamanda VK, Delisca GO, Mathis SL, et al. The financial burden of reexcising incompletely excised soft tissue sarcomas:a cost analysis[J]. Ann Surg Oncol, 2013, 20(9):2808-2814.
[11]Siegel HJ, Brown O, Lopez-Ben R, et al. Unplanned surgical excision of extremity soft tissue sarcomas: patient profile and referral patterns[J]. J Surg Orthop Adv, 2009, 18(2):93-98.
[12]Noria S, Davis A, Kandel R, et al. Residual disease following unplanned excision of soft-tissue sarcoma of an extremity[J].J Bone Joint Surg Am, 1996, 78(5):650-655.
[13]Manoso MW, Frassica DA, Deune EG, et al. Outcomes of re-excision after unplanned excisions of soft-tissue sarcomas[J].J Surg Oncol, 2005, 91(3):153-158.
[14]Goodlad JR, Fletcher CD, Smith MA. Surgical resection of primary soft-tissue sarcoma. Incidence of residual tumour in 95 patients needing re-excision after local resection[J]. J Bone Joint Surg Br, 1996, 78(4):658-661.
[15]Tedesco NS, Henshaw RM. Unplanned resection of sarcoma[J].J Am Acad Orthop Surg, 2016, 24(3):150-159.
[16]Smolle MA, Tunn PU, Goldenitsch E, et al. The prognostic impact of unplanned excisions in a cohort of 728 soft tissue sarcoma patients: a multicentre study[J]. Ann Surg Oncol,2017, 24(6):1596-1605.
[17]Charoenlap C, Imanishi J, Tanaka T, et al. Outcomes of unplanned sarcoma excision: impact of residual disease[J].Cancer Med, 2016, 5(6):980-988.
[18]Dyrop HB, Safwat A, Vedsted P, et al. Characteristics of 64 sarcoma patients referred to a sarcoma center after unplanned excision[J]. J Surg Oncol, 2016, 113(2):235-239.
[19]Kang S, Kim HS, Han I. Unplanned excision of extremity soft tissue sarcoma in korea: a nationwide study based on a claims registry[J]. PLoS One, 2015, 10(8):e0134354.
[20]Potter BK, Adams SC, Pitcher JD Jr, et al. Local recurrence of disease after unplanned excisions of high-grade soft tissue sarcomas[J]. Clin Orthop Relat Res, 2008, 466(12):3093-3100.[21]Sawamura C, Matsumoto S, Shimoji T, et al. What are risk factors for local recurrence of deep high-grade soft-tissue sarcomas[J]. Clin Orthop Relat Res, 2012, 470(3):700-705.
[22]Collin T, Blackburn AV, Milner RH, et al. Sarcomas in the groin and inguinal canal--often missed and difficult to manage[J].Ann R Coll Surg Engl, 2010, 92(4):326-329.
[23]Hoshi M, Ieguchi M, Takami M, et al. Clinical problems after initial unplanned resection of sarcoma[J]. Jpn J Clin Oncol,2008, 38(10):701-709.
[24]Mavrogenis A, Bianchi G, Stavropoulos N, et al. Clinicopathological features, diagnosis and treatment of clear cell sarcoma / melanoma of soft parts[J]. Hippokratia, 2013,17(4):298-302.
[25]Kosemehmetoglu K, Folpe AL. Clear cell sarcoma of tendons and aponeuroses, and osteoclast-rich tumour of the gastrointestinal tract with features resembling clear cell sarcoma of soft parts: a review and update[J]. J Clin Pathol,2010, 63(5):416-423.
[26]Chandrasekar CR, Wafa H, Grimer RJ, et al. The effect of an unplanned excision of a soft-tissue sarcoma on prognosis[J].J Bone Joint Surg Br, 2008, 90(2):203-208.
[27]Davis AM, Kandel RA, Wunder JS, et al. The impact of residual disease on local recurrence in patients treated by initial unplanned resection for soft tissue sarcoma of the extremity[J].J Surg Oncol, 1997, 66(2):81-87.
[28]Sugiura H, Takahashi M, Katagiri H, et al. Additional wide resection of malignant soft tissue tumors[J]. Clin Orthop Relat Res, 2002, 394(394):201-210.
[29]Han I, Kang HG, Kang SC, et al. Does delayed reexcision affect outcome after unplanned excision for soft tissue sarcoma[J]. Clin Orthop Relat Res, 2011, 469(3):877-883.
[30]Yan TQ, Zhou WH, Guo W, et al. Endoprosthetic reconstruction for large extremity soft-tissue sarcoma with juxta-articular bone involvement: functional and survival outcome[J]. J Surg Res,2014, 187(1):142-149.
[31]Yang C, Zhang J, Ding M, et al. Ki67 targeted strategies for cancer therapy[J]. Clin Transl Oncol, 2017.
[32]Eilber FC, Rosen G, Eckardt J, et al. Treatment-induced pathologic necrosis: a predictor of local recurrence and survival in patients receiving neoadjuvant therapy for high-grade extremity soft tissue sarcomas[J]. J Clin Oncol, 2001, 19(13):3203-3209.
[33]Verma S, Younus J, Stys-Norman D, et al. Meta-analysis of ifosfamide-based combination chemotherapy in advanced soft tissue sarcoma[J]. Cancer Treat Rev, 2008, 34(4):3393-3347.
[34]Garcia-Del-Muro X, Lopez-Pousa A, Maurel J, et al.Randomized phase II study comparing gemcitabine plus dacarbazine versus dacarbazine alone in patients with previously treated soft tissue sarcoma: a Spanish Group for Research on Sarcomas study[J]. J Clin Oncol, 2011, 29(18):2528-2533.
