节段性肿瘤假体治疗肱骨干转移癌合并病理性骨折的临床疗效及方法改进
2018-05-23赵杰于秀淳徐明郑凯胡永成王丰伦登兴
赵杰 于秀淳 徐明 郑凯 胡永成 王丰 伦登兴
肱骨是除了股骨外骨转移癌较易侵袭的长骨部位[1-2]。发生在肱骨干的转移癌特别是合并病理性骨折的患者多有严重的疼痛、肩肘关节功能障碍以及较低的生活质量等特点[3]。近年来随着放疗、化疗、手术、靶向治疗等肿瘤综合治疗方式的完善,对于预期生存期超过 3 个月、身体状况可以耐受手术的肱骨转移癌并病理性骨折的患者,手术疗效不断提高。1988 年 Chin 等[4]第一次报道了节段肿瘤假体治疗肱骨干转移瘤并病理骨折的临床应用,并发现节段性假体比动力加压钢板、髓内针有更高的抗上肢扭转能力。此后大量文献报道节段性假体治疗肱骨干转移瘤并病理性骨折具有即刻减轻疼痛、允许患者早期恢复上肢功能、保留肩肘关节等优点[4-12],但也存在假体松动、假体周围骨折、感染等并发症[5-12,22]。为增强假体抗上肢扭转及重力牵拉的能力,防止术后早期假体松动,笔者在节段性假体外附加一块钢板加强固定。本研究的目的是评价有无附加钢板的节段肿瘤假体治疗肱骨干转移瘤并病理性骨折的近期临床疗效和并发症,证实通过在假体外附加一块钢板预防早期假体松动的可行性。
材料与方法
一、纳入及排除标准
1. 纳入标准:(1) 2011 年 3 月至 2017 年 9 月济南军区总医院、天津医院 2 家骨肿瘤治疗中心收治的肱骨干转移瘤病理性骨折者;(2) 预期生存期>3 个月者;(3) 远近段剩余骨髓腔有效固定长度>5 cm 者。
2. 排除标准:(1) 身体条件太差不能耐受手术者;(2) 病理骨折累及肱骨头或者肱骨髁者。
二、一般资料
本组共纳入 9 例,男 4 例,女 5 例,平均初诊年龄 (62.9±11.1) 岁。肱骨干病理骨折部位:中段 6 例,近段 1 例,远段 2 例。原发肿瘤:肝癌1 例,甲状腺癌 2 例,乳腺癌 2 例,肾癌 2 例,肺癌 2 例 (表1)。所有患者均有严重的疼痛及患肢肩肘关节功能障碍,严重影响生活质量。

表1 患者一般资料Tab.1 General information of patients
三、治疗方法
1. 术前准备与假体选择:术前对患者行全面检查,密切关注血红蛋白、白蛋白、肝功、肾功等指标,排除严重病变,确保患者能够耐受手术。术前患者均拍摄带有刻度的 X 线片及 MRI,根据 MRI 确定病理骨折转移瘤段切除范围,同时根据 MRI 上远近段骨髓腔的长度及宽度,选择合适的假体,确保远近段假体柄>5 cm 的有效固定[6]。9 例均采用水泥型节段性假体重建转移瘤段切除后的骨缺损,2016 年以前的患者 (例 1~4,A 组) 行标准节段性假体重建 (图1),2016 年之后的患者 (例 5~9,B 组) 行附加钢板的节段假体重建,中段病理骨折复合一块直钢板固定,近段病理骨折复合一块近端解剖钢板固定,远段病理骨折复合一块髁钢板固定(图2)。
2. 手术要点:以肝癌左肱骨转移并病理性骨折的患者为例,简述手术步骤如下:全麻成功后,患者平卧位,取上臂前外侧纵行切口,长约 15 cm,依次切开皮肤、皮下组织、深筋膜,沿肱桡肌、肱肌间隙进入,仔细显露并保护好桡神经,锐性分离周围软组织,按照无瘤原则充分显露肱骨干病变部位。根据术前 MRI 显示的瘤段骨髓腔范围用摆锯截取肱骨干瘤段骨,测量长约 7 cm。确认瘤段骨切除彻底后扩髓,至髓腔直径超过假体柄直径 2~3 mm,以保证足够的水泥壳厚度。彻底冲洗止血后,试放假体。在保证肢体骨标志和肢体力线恢复正常的情况下,依次在髓腔内注入骨水泥,安放远近端假体,假体柄髓内固定部分至少 5 cm,拧紧2 枚螺钉使远近段假体柄组合为一体,待骨水泥硬化后,检查肢体力线与关节功能。放置 1 根引流管依次缝合切口,无菌敷料包扎,术毕 (图3)。
3. 术后处理:术中切除的病变组织送病理学检验证实均为转移瘤。常规给予抗炎、镇痛、抗凝等治疗,术后当天即鼓励患者行肩肘关节功能锻炼。引流管的拔除时间由引流量 (<50 ml / d) 决定。术后 14 天切口拆线。术后依据患者肿瘤性质给予化疗、放疗等辅助治疗。
四、术后随访及疗效评价
术后门诊定期随访。术后 2 年内,每 3 个月1 次;术后第 3 年,每 4 个月 1 次;术后 4~5 年,每 6 个月 1 次;以后每年随访 1 次。随访时复查肱骨正侧位 X 线片观察假体情况以及注意有无局部肿瘤复发、假体松动等并发症发生。根据国际骨与软组织肿瘤协会功能评估标准 (Musculoskeletal tumor society,MSTS) 及美国肩肘外科协会评分系统(American shoulder and elbow surgeons,ASES) 对患者进行术后肩肘关节功能评价[13-14](表2)。
五、统计学处理
采用 SPSS 17.0 软件进行统计学分析。数据采用±s 形式表示。利用t检验对两组的手术时间、出血量、术后 MSTS 评分、ASES 评分进行比较。
结 果
所有患者的转移瘤段骨均获得广泛的节段切除,平均切除长度 (7.8±0.9) cm。瘤段骨切除彻底后,A 组 4 例应用节段性肿瘤假体重建骨缺损,B 组 5 例应用改良后复合一块钢板的节段性肿瘤假体固定。手术均顺利完成,A 组平均用时 (80±14) min,B 组平均用时 (94±5) min,两组差异无统计学意义 (P=0.195);A 组平均出血量 (115±26) ml,B 组术中出血量 (120 ±31) ml,两组差异无统计学意义 (P=0.688) (表3)。

图1 a:组合式;b:非组合式节段性假体,包括远段柄、近段柄、2 枚中间螺栓图2 a:复合一块近端解剖钢板的近段肱骨干节段性假体;b:复合一块直钢板的中段肱骨干假体;c:复合一块髁钢板的远段肱骨干假体Fig.1 a: Assembled; b: Disassembled components of the humeral diaphyseal prosthesis, including a distal stem, a proximal stem, and two intermediate screwsFig.2 a: The proximal diaphyseal humeral prosthesis with a philos plate; b: The middle diaphyseal humeral prosthesis with a straight plate; c: The distal diaphyseal humeral prosthesis with a condylar plate
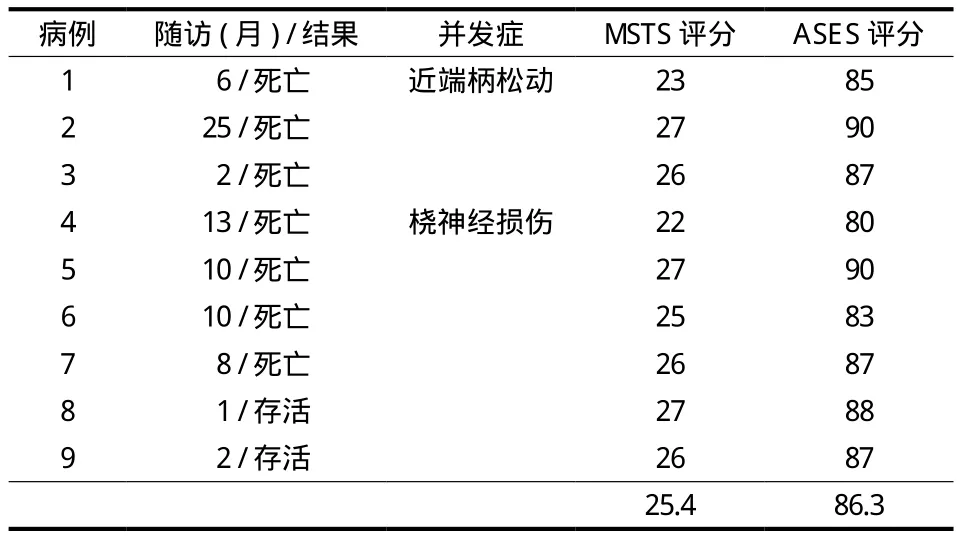
表2 患者的随访、并发症、MSTS 评分及 ASES 评分Tab.2 Follow-up, complications, MSTS and ASES scores of patients
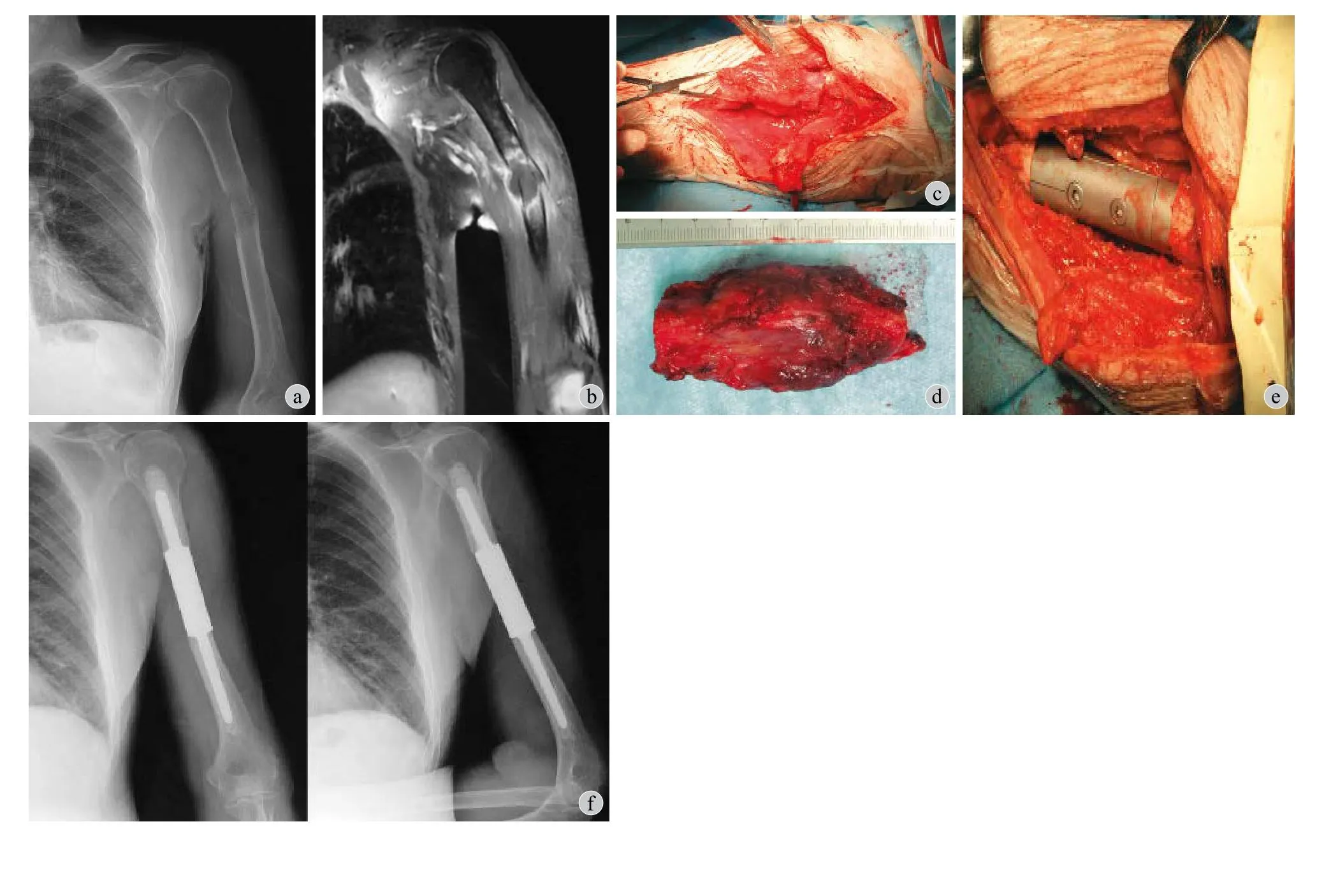
图3 例 3,男,82 岁。左肱骨干中段病理性骨折 (肝癌骨转移) 行瘤段切除、节段性假体内固定术 a:术前 X 线示左肱骨中段溶骨性破坏,骨皮质断裂,见明显骨折线,轻度成角;b:术前 MRI 示左肱骨中段髓腔内高低信号混杂,骨皮质断裂,周围软组织内异常高信号;c:术中见病理性骨折,骨皮质破坏;d:术中截除的瘤段骨,长约7 cm;e:远近段假体植入后,2 枚螺栓固定连为一体;f:术后 X 线示假体固定可,位置良好Fig.3 Male, 82 years old. Intercalary prosthetic reconstruction for pathological fracture of the left humeral shaft (bone metastasis from liver cancer) a: Preoperative x- ray showed osteolytic destruction, discontinuity of the bony cortex, obvious fracture line, outward angulation deformity in the middle portion of the left humeral diaphysis; b: Preoperative MRI showed high-low mixed signal from the marrow cavity, broken bony cortex,abnormal signal in surrounding soft tissues; c: Intraoperative photograph showed the pathological fracture; d: The length of resected tumor segment was about 7 cm; e: After implantation of the proximal and distal stems,the prosthesis was assembled with two screws; f: Postoperative X-ray showed that the prosthesis was in good position

表3 两组疗效比较Tab.3 Comparison of outcomes between the 2 groups
9 例随访 1~25 个月,平均 8.6 个月。截止末次随访,存活 2 例,1 例随访 1 个月,1 例随访 2 个月;死亡 7 例,其中 6 例死于肺转移,1 例为原发肺癌恶化,术后平均生存 (10.6±6.6) 个月。
最近随访或者死亡患者最后随访时,所有患者平均术后 MSTS 评分 25.4 分。A 组 (24.50±2.38) 分,B 组 (26.20±0.84) 分,两组患者术后功能差异无统计学意义 (P=0.25)。所有患者平均术后 ASES 评分 86.3 分。A 组 (85.50±4.20) 分,B 组(87.00±2.55) 分,两组患者术后肩肘关节功能差异无统计学意义 (P=0.35)。未发生并发症的患者术后 2 周内上肢活动及肩肘关节功能均恢复到正常范围,1 例桡神经损伤的患者术后 3 个月神经功能恢复正常,1 例假体松动的患者由于保留了临近关节也获得了满意的疗效。
术后 2 例出现并发症,均发生在 A 组,1 例为桡神经损伤,术后 3 个月神经功能恢复正常。1 例为节段假体近端柄早期松动 (图4),局部无肿瘤复发,肩肘关节活动受限,建议患者翻修,患者及家属选择保守治疗,术后 6 个月患者因肾癌肺转移死亡。为预防假体松动,在假体外附加一块钢板加强假体抗旋转及上肢重力牵拉的能力,B 组 5 例均应用附加钢板的节段假体 (图5),未出现并发症。
讨 论
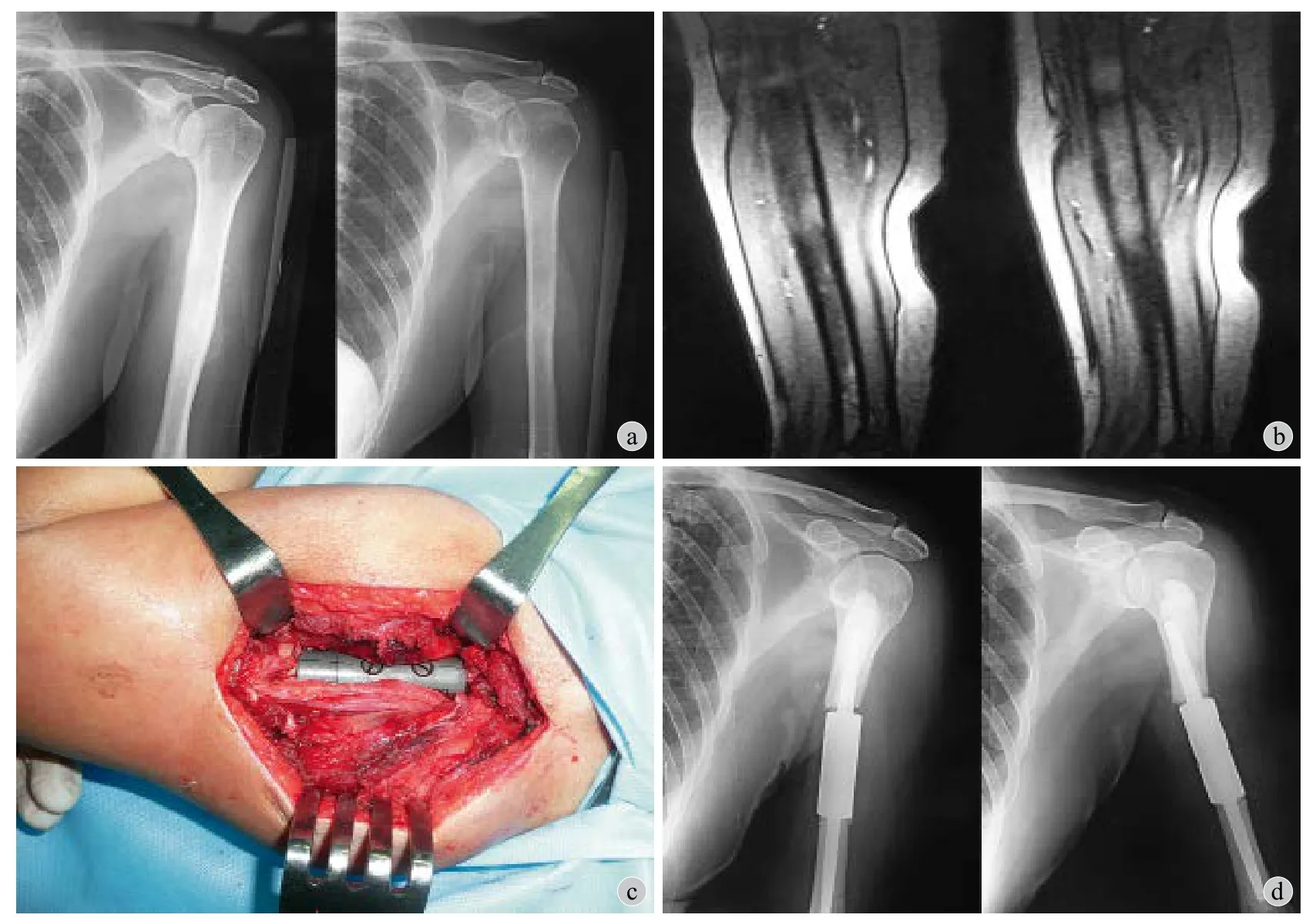
图4 例 1,女,65 岁。左肱骨中段病理性骨折 (乳腺癌骨转移) 行瘤段切除、节段性假体重建 a:术前 X 线示左肱骨中段异常信号,骨皮质膨胀变薄;b:术前 MRI 示左肱骨中段髓腔内高低信号混杂,骨皮质不连续,周围软组织内异常高信号;c:术中远近段假体植入后,2 枚螺栓固定连为一体;d:术后 1 周 X 线示假体近端柄松动移位,假体柄与近端骨髓腔间隙明显增宽Fig.4 Female, 65 years old. Aseptic loosening in a patient who underwent intercalary prosthetic reconstruction for pathological fracture of the left humeral shaft a: Preoperative X-ray showed abnormal signals in the middle portion of the left humeral diaphysis; b: Preoperative MRI showed high-low mixed signals from the marrow cavity, broken bony cortex, abnormal signals in surrounding soft tissues; c: After implantation of the proximal and distal stems, the prosthesis was assembled with 2 screws; d: Postoperative X-ray showed aseptic loosening of the proximal stem of the prosthesis, the proximal stem was displaced

图5 例 9,男,60 岁。左肱骨远段病理性骨折 (肾癌骨转移) 行瘤段截除、节段性假体重建 a~b:术前 X 线及 CT 示左肱骨远段明显骨折移位,断端骨质破坏吸收;c:术中测量截下的瘤段骨;d:远近段假体植入后,2 枚螺栓固定连为一体,纱布保护好桡神经;e:假体外附加一块远端髁钢板固定;f~g:术后 X 线示假体位置良好Fig.5 Male, 60 years old. Implanted intercalary prosthesis with an additional condylar plate for pathological fracture of the distal shaft of the right humerus a - b: Preoperative X-ray and CT films showed pathological fracture of the distal shaft of the right humerus; c: The resected tumor segment was shown; d - e: Intraoperative photographs showed implantation of an intercalary prosthesis with an additional condylar plate; f - g:Postoperative X-ray showed that the prosthesis was in a good position
肱骨干转移瘤病理性骨折的外科重建治疗旨在及时缓解疼痛、实现瘤段切除后的坚强固定、早期最大化恢复临近关节功能[2-4,12,15]。目前常用的重建方式有大段异体骨或自体骨移植钢板固定、锁定髓内针固定、钢板骨水泥固定、牵张成骨、节段假体等[16-20]。异体骨移植可以恢复骨量,提供软组织重建附着点,可变的形状可以与宿主骨很好地匹配,但固定不牢固,且需要长时间制动促进骨愈合[12]。并发症也较高,如不愈合、骨不连、再骨折、感染等[16,21-22]。自体骨可以愈合,但愈合需要一定的时间,且形状、长度受限,也有类似异体骨的并发症。术后的放化疗也不利于自体骨或异体骨的愈合[5-6]。锁定髓内针可以远离病理骨折段固定,但对于骨缺损严重的患者不适合[23]。牵张成骨耗时长,不利于功能恢复及术后的放疗,且有潜在的针道感染问题,不适于转移癌患者[20]。
力学分析证实节段性假体重建肱骨干瘤段切除后的骨缺损比髓内针、异体骨移植、外固定等方式具有更明显的抗挤压、弯曲、扭转的优势[24-25]。尽管如此,节段性假体仍有一定的假体松动发生率。Abudu 等[6]认为节段性假体最短的固定长度是5 cm,短于 5 cm 有早期松动的可能。Damron 等[9]报道使用一代和二代肱骨节段性假体治疗转移瘤的无菌性松动发生率分别为 9.5% (2 / 21)、27.3%(3 / 11),McGrath 等[10]报道节段性假体治疗肱骨恶性骨肿瘤无菌性松动发生率为 30.8% (4 / 13)。Ruggieri 等[11]报道应用节段性假体治疗的不同部位恶性肿瘤假体松动发生率为 25% (6 / 24),所有松动的病例均进行了翻修,处理策略包括更换长柄、改用带定制颈领的假体、桥接异体骨板、钢板骨水泥固定等。Sewell 等[26]主张当髓内固定部分<4 cm时使用皮质外钢板加强固定。Hong-chao 等[27]主张使用节段性假体时,对于短节段髓内固定<5 cm 或者骨缺损超过 10 cm,节段假体应该附加皮质外钢板固定。本研究的病例 4 例行标准节段假体固定,5 例行附加钢板的节段假体固定,远近段假体柄均 ≥ 5 cm,只有 1 例未使用钢板的病例出现了假体松动,假体松动发生率为 11.1% (1 / 9)。研究认为假体松动可能与上肢较高的旋转应力以及肌肉牵拉力有关,同时也与水泥初始固化不够牢固有关。考虑到肱骨周围复杂的力学环境,笔者在假体外附加了一块钢板,皮质外钢板为髓内节段假体转移了部分应力,提高了假体初始稳定性,可以使患肢早期获得坚强的固定,阻止早期假体松动的发生。
笔者发现部分病例假体柄与远近端髓腔连接处形成了骨桥,假体周围亦出现了异位骨化 (图6)。这与之前文献中报道的一致[6,8-9]。有学者认为骨桥可以为假体分担应力,从而可以延长假体的生存率[6,8]。Damron 等[9]使用节段性假体治疗的肱骨转移瘤病例的回顾性分析研究中 1 例术后假体周围出现异位骨化,术后 6 年近端柄虽然发生松动,但上肢功能尚可,并未进行翻修。虽然不清楚假体周围骨桥或者异位骨化形成的机制,但它或许可以延缓假体的松动。
McGrath 等[10]报道的节段性假体治疗肱骨恶性肿瘤的术后平均 MSTS 评分为 77% (60%~90%),Ruggieri 等[11]报道的术后平均 MSTS 评分为 90%(87%~95%)。本研究的病例平均术后 MSTS 评分84.7% (73.3%~90%),平均术后 ASES 评分 86.3%(80%~90%),与文献中报道的功能结果一致[5,10-11]。也与异体骨治疗恶性肿瘤的 MSTS 评分 87% (80%~96%) 相当[28]。
本研究存在一些局限:(1) 受节段性假体的适应证所限,样本量过小;(2) 例 8 和例 9 随访时间过短,无法正确地评估总体生存率。(3) 缺少与其它治疗方式的对照研究。
节段性假体可以及时减轻疼痛、早期恢复患肢功能、保留临近关节,利于肱骨干病理骨折转移瘤段骨切除后的重建。但由于上肢较高的旋转应力以及重力牵拉作用,肱骨干节段假体容易出现早期松动。附加的皮质外钢板为假体转移了部分应力,加强了假体把持力,较好地阻止了假体早期松动的发生。
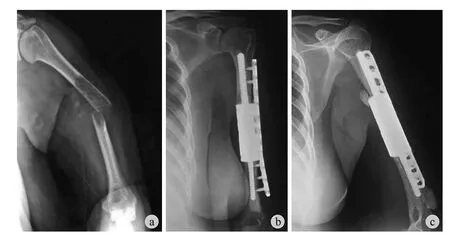
图6 例 6,男,50 岁。左肱骨中段病理性骨折(肺癌骨转移) 行瘤段截除、节段性假体重建a:术前 X 线示左肱骨中段明显骨折移位,断端骨皮质破坏吸收,向外成角;b~c:术后 X 线示假体位置良好,假体与近端骨段连接处形成骨桥,远端假体周围出现异位骨化Fig.6 Male, 50 years old. Implanted intercalary prosthesis with an additional straight plate for the pathological fracture of the middle shaft of the left humerus a: Preoperative X-ray showed fracture displacement, destruction of the cortical bone at the fracture segment, outward angulation; b - c:Postoperative X-ray showed formation of a bone bridge linking the stem and the proximal fragment,encasing the distal implant with heterotopic bone
参 考 文 献
[1]Frassica FJ, Frassica DA. Metastatic bone disease of the humerus[J]. J Am Acad Orthop Surg, 2003, 11(4):282-288.
[2]Sim FH, Pritchard DJ. Metastatic disease in the upper extremity[J]. Clin Orthop Relat Res, 1982, (169):83-94.
[3]Rock MG. Metastatic lesions of the humerus and the upper extermity[J]. Instr Course Lect, 1992, 41:329-333.
[4]Chin HC, Frassica FJ, Hein TJ, et al. Metastatic diaphyseal fractures of the shaft of the humerus. The structural strength evaluation of a new method of treatment with a segmental defect prosthesis[J]. Clin Orthop Relat Res, 1989, (248):231-239.
[5]Damron TA, Sim FH, Shives TC, et al. Intercalary spacers in the treatment of segmentally destructive diaphyseal humeral lesions in disseminated malignancies[J]. Clin Orthop Relat Res,1996, (324):233-243.
[6]Abudu A, Carter SR, Grimer RJ. The outcome and functional results of diaphyseal endoprostheses after tumour excision[J].J Bone Joint Surg Br, 1996, 78(4):652-657.
[7]Aldlyami E, Abudu A, Grimer RJ, et al. Endoprosthetic replacement of diaphyseal bone defects. Long-term results[J].Int Orthop, 2005, 29(1):25-29.
[8]Ahlmann ER, Menendez LR. Intercalary endoprosthetic reconstruction for diaphyseal bone tumours[J]. J Bone Joint Surg Br, 2006, 88(11):1487-1491.
[9]Damron TA, Leerapun T, Hugate RR, et al. Does the second generation intercalary humeral spacer improve on the first[J]?Clin Orthop Relat Res, 2008, 466(6):1309-1317.
[10]McGrath A, Sewell MD, Hanna SA, et al. Custom endoprosthetic reconstruction for malignant bone disease in the humeral diaphysis[J]. Acta Orthop Belg, 2011, 77(2):171-179.
[11]Ruggieri P, Mavrogenis AF, Bianchi G, et al. Outcome of the intramedullary diaphyseal segmental defect fixation system for bone tumors[J]. J Surg Oncol, 2011, 104(1):83-90.
[12]Benevenia J, Kirchner R, Patterson F, et al. Outcomes of a modular intercalary endoprosthesis as treatment for segmental defects of the femur, tibia, and humerus[J]. Clin Orthop Relat Res, 2016, 474(2):539-548.
[13]Enneking WF, Dunham W, Gebhardt MC, et al. A system for the functional evaluation of reconstructive procedures after surgical treatment of tumors of the musculoskeletal system[J].Clin Orthop Relat Res, 1993, (286):241-246.
[14]Richards RR, An KN, Bigliani LU, et al. A standardized method for the assessment of shoulder function[J]. J Shoulder Elbow Surg, 1994, 3(6):347-352.
[15]Harrington KD, Sim FH, Johnston JE, et al. Methylmethacrylate as an adjunct in the internal fixation of pathologic fractures:Experience with 375 cases[J]. J Bone Joint Surg, 1976, 58(8):1047-1055.
[16]Sarahrudi K, Wolf H, Funovics P, et al. Surgical treatment of pathological fractures of the shaft of the humerus[J]. J Trauma,2009, 66(3):789-794.
[17]Makley JT. The use of allografts to reconstruct intercalary defects of long bones[J]. Clin Orthop Relat Res, 1985, (197):58-75.
[18]Pretell J, Rodriguez J, Blanco D, et al. Treatment of pathological humeral shaft fractures with intramedullary nailing[J]. A retrospective study. Int Orthop, 2010, 34(4):559-563.
[19]Weiss KR, Bhumbra R, Biau DJ, et al. Fixation of pathological humeral fractures by the cemented plate technique[J]. J Bone Joint Surg Br, 2011, 93(8):1093-1097.
[20]Tsuchiya H, Tomita K, Minematsu K, et al. Limb salvage using distraction osteogenesis. A classification of the technique[J].J Bone Joint Surg Br, 1997, 79(3):403-411.
[21]Mankin HJ, Gebhardt MC, Jennings LC, et al. Long-term results of allograft replacement in the management of bone tumors[J]. Clin Orthop Relat Res, 1996, (324):86-97.
[22]Ortiz-Cruz E, Gebhardt MC, Jennings LC, et al. The results of transplantation of intercalary allografts after resection of tumors[J]. J Bone Joint Surg Am, 1997, 79(1):97-106.
[23]Dijkstra S, Stapert J, Boxma H, et al. Treatment of pathological fractures of the humeral shaft due to bone metastases:a comparison of intramedullary locking nail and plate osteosynthesis with adjunctive bone cement[J]. Eur J Surg Oncol, 1996, 22(6):621-626.
[24]Henry JC, Damron TA, Weiner MM, et al. Biomechanical analysis of humeral diaphyseal segmental defect fixation[J].Clin Orthop Relat Res, 2002, (396):231-239.
[25]Sakellariou VI, Mavrogenis AF, Babis GC, et al. Comparison of four reconstructive methods for diaphyseal defects of the humerus after tumor resection[J]. J Appl Biomech, 2012,28(5):568-578.
[26]Sewell MD, Hanna SA, McGrath A, et al. Intercalary diaphyseal endoprosthetic reconstruction for malignant tibial bone tumours[J]. J Bone Joint Surg Br, 2011, 93(8):1111-1117.
[27]Huang HC, Hu YC, Lun DX, et al. Outcomes of intercalary prosthetic reconstruction for pathological diaphyseal femoral fractures secondary to metastatic tumors[J]. Orthopaedic Surgery, 2017, 9(2):221-228.
[28]Chen TH, Chen WM, Huang CK. Reconstruction after intercalary resection of malignant bone tumors: comparison between segmental allograft and extracorporeally-irradiated autograft[J]. J Bone Joint Surg, 2005, 87(5):704-709.
