再造丸质量标准研究
2018-05-22程似锦
程似锦,李 恒
(1.长江职业学院生物医药学院,湖北 武汉 430064; 2.武汉药品医疗器械检验所,湖北 武汉 430075)
再造丸,原方为《圣济总录·牛膝木瓜丸》之化裁方,是由秦艽、续断等14味中药材经粉碎后加入蜂蜜以水泛丸制成的纯中药复方制剂,能祛风止痛、除湿舒筋,用于风湿痹证引起的关节疼痛、肢体麻木、行履不健等症。方中秦艽具有祛风湿、清湿热之功效[1],续断补肝肾、强筋骨[2-3],以固其本。为有效控制该药品质量,本研究中建立了秦艽、续断的薄层色谱定性鉴别法以及秦艽中龙胆苦苷的含量测定方法。现报道如下。
1 仪器与试药
1.1 仪器
Ultimate 3000型高效液相色谱仪(包括DAD检测器、UV检测器,美国DIONEX公司);色谱柱,戴安Acclaim 120 C18柱(250 mm × 4.6 mm,5 μm),Phenomenex Synergi柱(250 mm ×4.6 mm,5 μm),依利特 Hypersil BDS C18柱(250 mm ×4.6 mm,5 μm);CAMAG TLC VISUALIZER薄层色谱照相仪,BP211D电子天平(赛多利斯公司,感量 0.01 mg /0.1 mg);硅胶 G 薄层板(青岛海洋化工厂)。
1.2 试药
龙胆苦苷对照品(批号110770-200712,纯度以99.1%计),川续断皂苷Ⅵ对照品(批号 111685-200802),秦艽对照药材(批号 121199-200702),续断对照药材(批号121033-200608),均由中国食品药品检定研究院提供;甲醇为色谱纯,水为超纯水。5批样品由某制药有限公司提供(批号分别为B#05S-0809,B#05L-1009A,B#05L-1009B,B#05S-0306,B#05S-0306A)。
2 方法与结果
2.1 薄层色谱鉴别
秦艽[4-5]:取本品 5 g,研细,加硅藻土 5 g,加甲醇50 mL,加热回流30 min,放冷,滤过,滤液蒸干,残渣加水20 mL,微热使溶解,用乙酸乙酯振摇提取3次,每次25 mL,弃去乙酸乙酯液,水液再用水饱和的正丁醇振摇提取3次,每次25 mL,合并正丁醇液,用正丁醇饱和的水洗涤2次,每次25 mL,弃去水液,正丁醇液蒸干,残渣加甲醇1 mL使溶解,作为供试品溶液。另取秦艽对照药材0.25 g,加甲醇20 mL,同法制成对照药材溶液。再取龙胆苦苷对照品,加甲醇制成每1 mL含1 mg的溶液,作为对照品溶液。按处方比例、制备工艺制备缺秦艽的阴性对照品,按照供试品溶液方法制得。照薄层色谱法[2015年版《中国药典(一部)》附录ⅥB]试验,吸取上述4种溶液各3~5 μL,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶GF254薄层板上,以乙酸乙酯-甲醇-水(20 ∶2 ∶1)为展开剂,展开,取出,晾干,置紫外光灯(254 nm)下检视。供试品溶液色谱中,在与对照药材溶液色谱和对照品溶液色谱相应位置上显相同颜色的斑点,分离度良好,阴性样品(缺秦艽)无干扰。结果见图1A。
续断[5-6]:取秦艽鉴别项下供试品溶液作为供试品溶液。按处方比例,制备工艺制备缺续断的阴性样品,同供试品溶液制备方法制得阴性对照品溶液。另取续断对照药材0.25 g,加甲醇20 mL,同供试品溶液制备方法制成对照药材溶液。再取川续断皂苷Ⅵ对照品,加甲醇制成每1 mL含1 mg的溶液,作为对照品溶液。照薄层色谱法(《中国药典》2015年版一部附录ⅥB)试验,吸取上述4种溶液各3~5 μL,分别点于同一硅胶G薄层板上,以正丁醇-醋酸-水(4∶1∶5)的上层溶液为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰。供试品溶液色谱中,在与对照药材和对照品溶液色谱相应位置上显相同颜色的主斑点,分离度良好,阴性样品(缺续断)无干扰。结果见图1B。
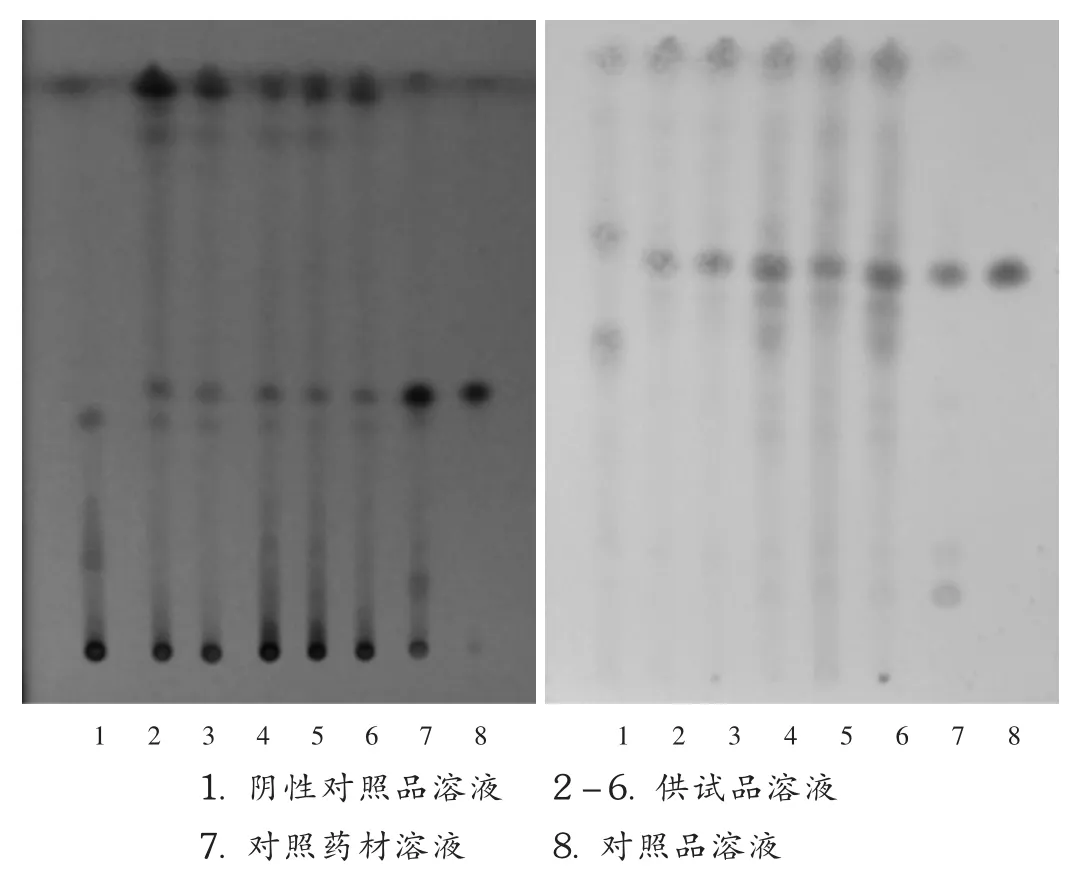
图1 薄层色谱图
2.2 龙胆苦苷含量测定
2.2.1 色谱条件
色谱柱:戴安 Acclaim 120 C18柱(250 mm ×4.6 mm,5 μm);流动相:甲醇 - 水(30 ∶70);检测波长:275 nm;流速:1.0 mL/min;理论板数按龙胆苦苷峰计算应不低于 3 000。柱温:30 ℃;进样量:20 μL。
2.2.2 溶液制备
对照品溶液:取龙胆苦苷对照品适量,精密称定,加50%甲醇制成每1 mL含15 μg的溶液,即得。供试品溶液:取本品,研细,取1 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,称定质量,加热回流1 h,放冷,再称定质量,用甲醇补足减失的质量,摇匀,滤过。精密量取续滤液5 mL置10 mL容量瓶中,用水稀释至刻度,摇匀,用微孔滤膜(0.45 μm)滤过,取续滤液,即得。阴性对照品溶液:按处方比例、制备工艺制备缺秦艽的阴性对照品,按照供试品溶液方法制得。
2.2.3 方法学考察
专属性试验:取2.2.2项下3种溶液,按上述色谱条件进行测定。结果表明,供试品溶液色谱中,在与龙胆苦苷对照品溶液色谱相同保留时间处有相应色谱峰,阴性对照品溶液色谱中无相应色谱峰。样品中其他原辅料未对待测物的检测产生干扰。对供试品溶液色谱中与龙胆苦苷溶液相同保留时间色谱峰进行DAD(190~400 nm)扫描,所得光谱图与龙胆苦苷对照品相一致。详见图2。
线性关系考察:称取龙胆苦苷对照品(纯度99.1% )9.96 mg,精密称定,置 50 mL 容量瓶中,加甲醇溶解并稀释至刻度,摇匀,精密量取25 mL置50 mL容量瓶中,用水稀释至刻度,摇匀,即得到质量浓度为0.098 7 g/L的对照品贮备液。再分别精密量取上述对照品贮备液 1,5 mL 置 100 mL 容量瓶中;1.0,1.5,2.0,5.0,10.0 mL置10 mL容量瓶中,加50%甲醇稀释至刻度,摇匀,制成质量浓度分别为 9.870×10-4g/L,4.935 × 10-3g /L,9.870 × 10-3g /L,1.481 × 10-2g /L,1.974 × 10-2g/L、4.935 ×10-2g/L、9.870 × 10-2g/L的对照品溶液。分别精密吸取上述系列对照品溶液各20 μL,注入液相色谱仪,测定,以进样量为横坐标、峰面积积分值为纵坐标进行线性回归,得回归方程 Y=20.796 6 X-0.076 9,r= 0.999 9(n= 7)。结果表明,龙胆苦苷进样量在 0.019 74 ~ 1.974 1 μg 范围内与峰面积积分值线性关系良好。
精密度试验:吸取质量浓度为 0.014 91 g/L的龙胆苦苷对照品溶液20 μL,连续进样6次,以对照品峰面积计算精密度。结果的 RSD为 0.24%(n=6),表明仪器精密度良好。在不同时间以不同的色谱柱将同批样品依法制备供试品溶液,测定含量。结果3次测定平均含量为 1.39 mg/g,RSD =0.42%(n=3),表明方法中间精密度良好。
稳定性试验:精密吸取同一供试品溶液20 μL,分别在 0,2,4,8,12 h 时进样。结果平均峰面积值为5.783,RSD =0.62%(n=5),表明供试品溶液在 12 h内稳定性良好。
重复性试验:取本品(批号B#05S-0809)9份(取样量分别为 0.7,1.0,1.3 g 各 3 份),依法制备供试品溶液,测定。结果含量平均值为 1.378 mg/g,RSD =0.54%(n=9),表明方法重复性良好。
加样回收试验:精密称定已知含量的样品(批号B#05S-0809,含量 1.378mg/g)0.5g,共取 6 份,分别置于具塞锥形瓶中,再精密量取50 mL质量浓度为0.014 91 g/L的对照品溶液6份,分别加入上述具塞锥形瓶中,再按照供试品溶液项下方法制备供试品溶液,测定并计算回收率。结果回收率在 97%~99%内,平均 98.11%,RSD=0.44%(n=6),表明方法准确性较好。
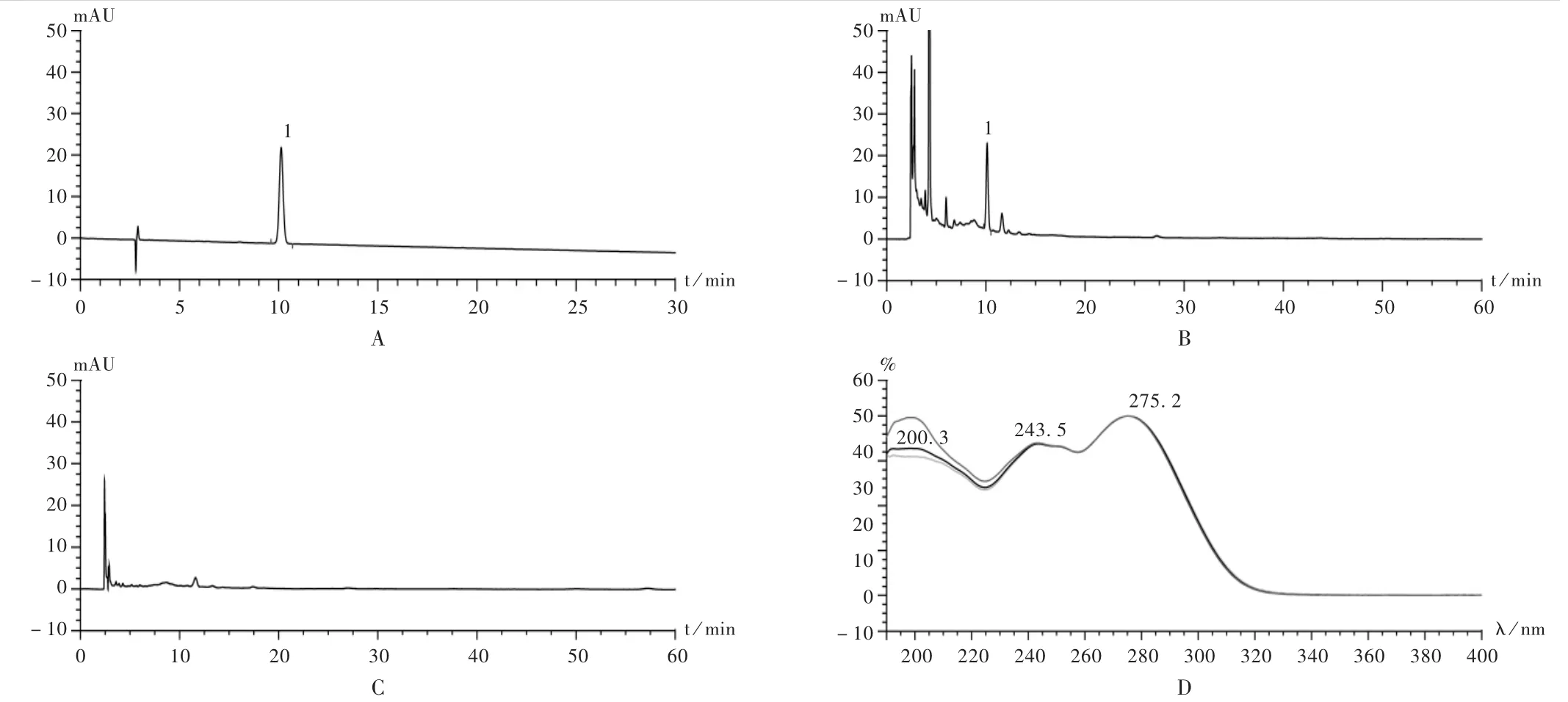
图2 专属性试验色谱图和光谱图
2.2.4 样品含量测定
取5批样品,依法测定含量。结果批号为B#05S-0809,B#05L-1009A,B#05L-1009B,B#05S-0306,B#05S-0306A的样品中,龙胆苦苷含量分别为 1.38,1.34,1.32,0.70,0.73 mg /g。
3 讨论
本品为水蜜丸,且加蜜量为30%,在定性鉴别中加适量硅藻土去除炼蜜,用乙酸乙酯去除脂溶性成分,从而有效减少了杂质干扰。对秦艽、续断薄层色谱进行了展开温度、湿度、不同厂家薄层板的考察,均分离良好,说明此方法可以作为其定性鉴别的方法。
2015 年版《中国药典(一部)》中“秦艽”“龙胆”含量测定项下[5],龙胆苦苷检测波长分别为254 nm和270 nm。按照“2.2.1”项下色谱条件对龙胆苦苷对照品溶液进行测定,并做DAD(190~400 nm)扫描,所得光谱图显示龙胆苦苷在244,275 nm处有较大吸收,供试品色谱中龙胆苦苷在相应波长亦有较大吸收。对供试品溶液、对照品溶液在254 nm及275 nm同时做双波长检测,发现龙胆苦苷峰在275 nm波长所测响应值较254 nm高约20%,且供试品溶液色谱中杂质峰较少。参考其他文献资料[7-10],最终选择275 nm为龙胆苦苷含量测定的检测波长。
本研究中对提取方法,提取时间,提取溶剂的体积进行了考察[11-12],结果加热回流提取的龙胆苦苷含量较高,表明加热回流提取效率更高;加热回流30 min,1 h,2 h时提取的龙胆苦苷含量相当;25,50,100 mL提取的龙胆苦苷含量相当。故选择甲醇50 mL加热回流1 h作为提取方法。
本研究中建立了中药成方制剂再造丸中秦艽、续断的薄层色谱鉴别法,以及秦艽中龙胆苦苷的含量测定方法,为该制剂质量标准的制订提供了方法和依据。
参考文献:
[1] 蔡秋生,张志红,高慧琴.秦艽药理作用及临床应用研究进展[J].甘肃中医学院学报,2010,27(6):55-58.
[2] 高秀芝,马鲁豫,金艳霞,等.川续断化学成分及药理作用研究进展[J].亚太传统医药,2010,6(7):142-146.
[3] 刘二伟,吴 帅,樊官伟.川续断化学成分及药理作用研究进展[J].中华中医药学刊,2010,20(7):1421-1423.
[4] 曹 雯.秦艽的薄层色谱分析[J].时珍国医国药,2003,26(12):746-747.
[5] 国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:270.
[6] 郭征兵,徐 倩.生龙接骨胶囊薄层色谱鉴别[J].江西医药,2010,11(6):585.
[7] 付成国,朱靖平,白 冰,等.灵龙感冒胶囊中龙胆苦苷的含量测定[J]中国中医药信息杂志,2011,18(6):56-57.
[8] 王 琳,段宝忠,聂茜茜,等.高效液相色谱法测定云南产龙胆习用品头花龙胆中3种成分的含量[J].医药导报,2015,34(4):515-516.
[9] 陈岳蓉,刘海青,苏东敏.HPLC法同时测定骨刺消痛胶囊中落干酸和龙胆苦苷的含量[J].药物分析杂志,2009,28(7):1169-1171.
[10] 吴美香,高洪琳,张 霞,等.骨筋丸胶囊中秦艽的龙胆苦苷的检测研究[J].中国药品标准,2011,12(3):202-205.
[11] 杨 帆,钟桂雄,赵洪普,等.不同方法提取淫羊藿苷的正交试验研究[J].中国药房,2005,16(6):16-18.
[12] 朱 英,裘德胜,陈 民,等.金银花叶总黄酮的水提取工艺研究[J].中成药,2007,29(1):60-63.
