日本金星蕨化学成分研究
2018-05-22朱艳玲吴兴德赵勤实宋流东
朱艳玲 ,吴兴德 ,赵勤实,宋流东
(1.昆明医科大学海源学院,云南 昆明 650106; 2.中国科学院昆明植物研究所,云南 昆明 650201;3.昆明医科大学,云南 昆明 650500)
金星蕨科 Thelypteridaceae为世界性的植物大科,约有27属600余种,主要分布于热带及亚热带,我国有20属300多种。长江以南各省区的低海拔山地常见,其中记载可供药用的有9属18种1变种。金星蕨科植物民间用作消炎止痢、清热解毒和拔脓消肿药,多用于疥疮痈肿、痢疾、跌打骨折及烧伤、烫伤等[1]。日本金星蕨是金星蕨属 Parathelypteris(H.Ito)Ching 植物,主要分布于长江流域以南各省区,北至河南、陕西、甘肃,西南到云南[2]。周道年[3]从金星蕨甲醇提取物中提取了16个化合物,付伟等[4]从中日金星蕨中分离出9个黄酮类化合物。为进一步了解其化学成分和生理活性,为发掘蕨类植物资源和扩大蕨类植物药源途径,本研究中对产于云南中甸维西县的日本金星蕨化学成分进行了研究。
1 仪器、材料与方法
1.1 仪器与材料
APIQ star Pulsar型质谱仪(测定 ESIMS和HRESIMS);DRX-500型核磁共振仪(测定H-NRM和CNRM);HP1100型高效液相色谱仪(美国安捷伦公司)。D101聚苯乙烯型大孔树脂和Sephadex LH-20凝胶(天津化工厂);80~100目硅胶拌样,200~300目硅胶层析(德国默克公司);40~60 μm RP-18材料装反相柱(德国默克公司);10%H2SO4的乙醇溶液显色。
1.2 植物来源
金星蕨全草样品于2006年5月采自云南省中甸维西县,标本存放于昆明植物研究所重点实验室,均由中国科学院昆明植物研究所成晓教授鉴定。
1.3 分离方法
取干燥的金星蕨全草11 kg,粉碎后用50 L溶液(丙酮 ∶水 =7∶3)浸泡 24 h,提取 3次,提取液合并,蒸馏除丙酮。剩余提取液用乙酸乙酯萃取3次,合并乙酸乙酯部分,蒸干得650 g浸膏。650 g浸膏加1 000 g粗硅胶(80~100目)拌样后以2 000 g硅胶(200~300目)柱层析,石油醚-丙酮溶剂梯度洗脱(1∶0-0∶1),薄层色谱(TLC)检测,合并相同部分,得Ⅰ~Ⅶ份浸膏。部分Ⅰ和部分Ⅶ未作分离。
部分Ⅱ(97 g):为极性较小部分,用大 MCI以 95%乙醇脱色得51 g,硅胶拌样后,300 g硅胶装柱,用石油醚 -丙酮(9∶1)洗脱,得一大量结晶化合物 2(8 g)。其他部分经反复纯化后得化合物 1(11 mg),化合物 6(30 mg),化合物 11(10 mg)。
部分Ⅲ(59 g):经大 MCI脱色后,用 Sephadex LH-20(甲醇),TLC检测合并相同馏分,得 A,B,C三部分。A部分分别经 Sephadex LH-20(丙酮)层析、硅胶柱层析(石油醚 ∶丙酮=7∶3)得一大量成分化合物4(3 g),其他部分分离纯化得化合物 10(9 mg)。B 部分拌样以硅胶柱层析(石油醚∶丙酮=8∶2)放置3 d,得黄色结晶化合物 5(28 mg)。C 部分(3 g)以硅胶拌样装柱,用石油醚-丙酮(8∶2)洗脱,得黄色粉末化合物 7(51 mg)。
部分Ⅳ(19 g):用 MCI MeOH-H2O梯度洗脱处理后得2个部分,经反复纯化和重结晶得化合物3(2.7 g)和化合物 13(16 mg)。
部分Ⅴ(47 g):经 MCI洗脱,得 90%甲醇部分 28 g。然后经硅胶柱层析(石油醚 ∶丙酮 =7∶3),最后经Sephadex LH-20(丙酮)层析,纯化得化合物 8(6 mg)。
部分Ⅵ(59 g):经 MCI MeOH-H2O 梯度洗脱,得90%甲醇洗脱部分41 g。然后以300 g硅胶柱层析(氯仿 ∶丙酮 = 8.5 ∶1.5)冲柱,然后经 Sephadex LH-20(丙酮)层析,以及半制备经高效液相反复纯化得化合物9(6 mg)、化合物 12(10 mg)、化合物 14(12 mg)。
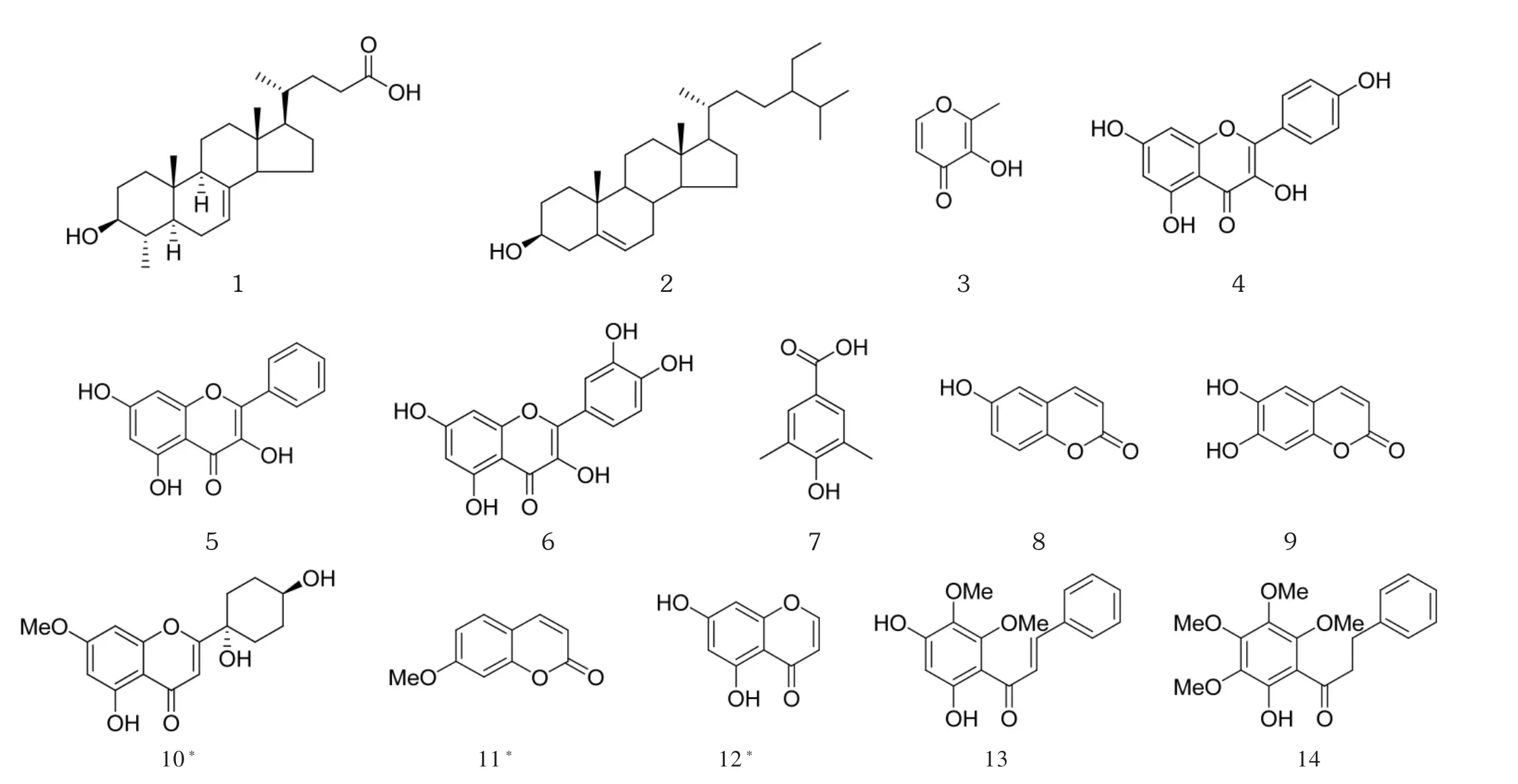
图1 各化合物化学结构图
2 结果
2.1 化学成分
从日本金星蕨提取分离得到共14个化合物,黄酮类化合物6个、香豆素类化合物3个、甾体类化合物2个和其他化合物3个。鉴定为:4a-甲基-3β-羟基雄甾 -7-烯 -17,4’-戊酸(化合物 1),β -谷甾醇(化合物 2),麦芽醇(化合物 3),山柰酚(化合物 4),高良姜素(化合物 5),槲皮素(化合物 6),4- 羟基 -3,5- 二甲基苯甲酸(化合物 7),6- 羟基香豆素(化合物 8),6,7- 二羟香豆素(化合物9),四氢芫花素(化合物10),7-甲氧基香豆素(化合物 11),5,7-二羟基色原酮(化合物12),2’,4’ - 二羟基 -5’,6’ - 羟甲基查尔酮 (化合物13),6’ - 羟基 -2',3',4',5'- 甲氧基二氢查尔酮(化合物14)。其化学结构见图1。
2.2 化合物理化常数和波谱数据
2.2.1 化合物 1
白 色 粉 末 。 [a]D18+0.00°(以 1.0,C5H5N),UV(C5H5N) λmax(logε):205 nm(0.51);IR(KBr) Vmax3 457,2 965,2 940,2 848,1 721,1 681,1 640 cm-1;1H and13C NMR spectra data,see Tables 1 and 2;HRESIMS m /z 411.324 9(calcd.For C25H40O3411.324 9)。
2.2.2 化合物 2
在多种展开体系下与标准品比较,均为同一物质。
2.2.3 化合物 3
C6O3H6。白色晶体。1H NMR(CDCl3):δ6.44(1 H,d,J = 5.5 Hz,H-5),7.72(1 H,d, J = 5.5 Hz,H-6);13C NMR (CDCl3): δ149.3(s, C-2), 143.2(s, C-3),173.1(s,C-4),113.1(d,C-5),154.1(d,C-6)。Positive FAB MS:m /z 126[M]+。
2.2.4 化合物 4
C15H10O6。黄色无定形粉末。1H NMR(DMSO):δ6.19(1 H,s,H-6),6.41(1 H,s,H-8),8.08(2 H,d, J =8.5 Hz,H-2′,6′),6.90(1 H,d,J = 8.5 Hz,H-3′,5′);13C NMR (DMSO): δ158.1(s, C-2), 137.1(s, C-3),177.3(s,C-4),162.4(s,C-5),99.3(d,C-6),165.5(s, C-7), 94.5(d, C-8), 160.5(s, C-9), 104.5(s,C-10),123.6(s,C-1′),130.7(d,C-2′), 116.4(s,C-3′),147.9(s, C-4′),116.4(s, C-5′), 130.7(d,C-6′)。PositiveFAB MS: m /z 286[M]+。
2.2.5 化合物 5
C15H10O5。黄色无定形粉末。1H NMR(DMSO):6.28(1 H,d, J = 1.52 Hz,H-6),6.55(1 H,d, J = 1.52 Hz,H-8),7.49(1 H,t, J = 7.76 Hz,H-5′),7.54(2 H,dd,J=6.60 Hz,7.32 Hz,H-3′,4 ′),8.23(2 H,d, J=7.32 Hz,H-2′,6′);13C NMR (DMSO):δ146.1(s,C-2),137.9(s, C-3), 176.9(s, C-4), 162.4(s, C-5), 99.3(d,C-6), 165.3(s,C-7), 94.6(d, C-8),157.9(s, C-9),104.3(s,C-10),132.1(s,C-1′),128.4(d,C-2′,6′),129.3(d,C-3′,5′),130.8(d,C-4′)。PositiveFAB MS:m /z 270[M]+。
2.2.6 化合物 6
C15H10O7。黄 色 无定形粉 末 。1H NMR(DMSO):δ6.24(1 H,d,J=1.5 Hz,H-6),6.53(1 H,d,J=1.5 Hz,H-6),7.81(1 H,d, J = 1.5 Hz,H-2′),7.00(1 H,d,J= 8.5 Hz,H-3′,5′);13C NMR (DMSO):δ145.1(s,C-2),136.7(s,C-3),176.5(s,C-4),162.3(s,C-5),99.2(d,C-6),165.0(s, C-7), 94.5(d, H-8),157.8(s, C-9), 104.1(s, C-10), 121.5(s, C-1′),115.6(d,C-2′), 145.8(s, C-3′),148.3(s,C-4′),116.2 (d, C-5′), 122.8(d, C-6′)。 PositiveFAB MS:m /z 303[M+1]+。
2.2.7 化合物 7
C9H8O3。白色晶体。1H NMR(Acetone):δ8.07(2 H,s,H-2,6),2.30(6 H,s,H-8,9);13C NMR(Acetone):δ149.5(s,C-1),143.2(d,d,C-2,6),139.1(s,C-3,5),146.3(s,C-4),170.0(s,C-7),14.6(q,C-8,C-9)。MS:m /z 164[M]+。
2.2.8 化合物 8
C9H6O3。黄色无定形粉末。1H NMR(Acetone):δ6.19(1 H,d, J = 12.6 Hz,H-3),7.48(1 H,d, J = 12.9 Hz,H-4),7.10(1 H,d, J = 1.4 Hz,H-5),6.96(1 H,dd,J = 1.4 Hz,6.6 Hz,H-7),6.81(1 H, d, J = 6.6 Hz,H-8);13C NMR(Acetone):δ168.7(s,C-2),115.1(d,C-3),146.6(d,C-4),116.1(d,C-5),148.9(s,C-6),116.4(d,C-7),121.9(d,C-8),127.3(s,C-9),145.4(s,C-10)。MS: m /z 162[M]+。
2.2.9 化合物 9
C9H6O4。黄色无定形粉末。1H NMR(Acetone):δ7.66(1 H,d,J= 9.2,H-3),6.07(1 H,d,J = 9.2,H-4),7.30(1 H, s, H-5), 7.16(1 H, s, H-8);13C NMR(Acetone):δ161.9(s,C-2),122.2(d,C-3),144.3(s,C-4),113.1(d,C-5),144.9(s,C-6),152.6(s,C-7),103.8(d,C-8),150.1(s,C-9),111.7(s,C-10);EIMS: m /z 178([M]+ , 100), 150(66), 137(11), 94(9),69(15)。MS: m /z 176[M]+。
2.2.10 化合物 10
C16H18O6。黄 色 无 定 形 粉 末 。1H NMR(Acetone):δ6.42(1 H,d, J = 2.5 Hz,8-H),6.41(1 H,d,3-H),6.35(1 H,d, J = 2.5 Hz,6-H),4.16(1 H,brs,W1/2=9.0 Hz,4′-H),2.39(2 H,ddd, J = 13.3,13.2,3.9 Hz,3′,5′-axial-H2),1.75(2 H,m, J = 13.7 Hz,3.9 Hz,3′,5′-axial-H2),1.62(2 H,m, J = 13.2,3.9 Hz,3′,5′-axial-H2);13C NMR(Acetone):δ177.6(s, C-2),106.1(d,C-3),184.3(s,C-4),163.5(d,C-5),99.3(d, C-6), 167.2(s, C-7), 93.5(d, C-8), 159.5(s,C-9),106.5(s,C-10),73.4(d,C-1′),30.1(t,C-2′),29.9(t,C-3′),65.4(d,C-4′),29.9(t,C-5′),30.1(t,C-6′),56.9(q,7-OCH3)。EIMS: m /z306[M]+,248,219,193,167,135。
2.2.11 化合物 11
C10H8O3。黄 色 无 定 形 粉 末 。1H NMR(Acetone):δ5.79(1 H,d, J= 11.1 Hz,H-3),7.55(1 H,d, J=11.6 Hz,H-4),6.89(1 H,d, J = 6.71 Hz,H-5),6.70(1 H,d, J = 6.50 Hz,H-7),7.03(1 H,s,H-8),3.87(3 H, s, 7-OCH3);1C NMR(Acetone): δ171.9(s,C-2),116.5(d,C-3),149.3(d,C-4),125.9(d,C-5),123.8(d,C-6),150.3(s,C-7),111.7(d,C-8),146.3(s,C-9),128.0(s,C-10)。MS: m /z 176[M]+。
2.2.12 化合物 12
C9H6O4。黄色无定形粉末。1H NMR(Acetone):δ6.21(1 H,d,J= 6.00 Hz,H-2),8.05(1 H,d, J = 6.00 Hz,H-3),6.24(1 H,d, J = 2.15 Hz,H-6),6.35(1 H,d,J = 2.15 Hz,H-8);13C NMR(Acetone):δ157.6(d,C-2),111.6(d,C-3),182.5(s,C-4),165.0(s,C-5),94.7(d,C-6),159.2(s,C-7),99.8(d,C-8),163.5(s,C-9),106.5(s,C-10)。MS:m /z 178[M]+。
2.2.13 化合物 13
C17H18O4。黄 色 无 定 形 粉 末 。1H NMR(DMSO):δ3.91(3 H,s,5′-Me),3.93(3 H,s,6′-Me),6.34(1 H,s, 3′-H),6.34-7.50(5 H,m,ph-H),7.81(1 H,d,J = 15.6 Hz,β -H),8.02(1 H,d,J = 15.6 Hz,a-H),13.39(2′-OH);13C NMR(DMSO): δ131.2(d,C-1),129.9(2 × d,C-2,6),129.3(2 × d, C-3,5),131.2(d, C-4), 134.3(s, C-1), 127.4(d, C- α),143.5(d,C- β),191.8(C = O),104.2(s,C-1′),164.3(s,C-2′),96.7(d,C-3′),160.6(s,C-4′),136.3(s,C-5′),165.7(s,C-6′)。MS:m /z 300[M]+。
2.2.14 化合物 14
稠 油 。eim m /z[M+]346,331,241;hrms m/z 346.141 8(calcd for C19H22O6, 346.141 5);1H NMR(Acetone):δ3.03(2 H,t, J = 7.4 Hz,β -H),3.38(2 H,J = 7.4 Hz,a-H),3.79,3.86,3.91,4.08 (12 H,s× 4,4 × OMe),7.18-7.33(5 H,m,Ar-H),13.03(1 H,s,OH);13C NMR(Acetone): δ205.6(C = O), 154.4(C-4′),153.6(C-6′),151.2(C-2′),141.4(C-1),138.1(C-5′), 136.9(C-3′), 128.5(C-2, 3, 5, and 6),126.0(C-4), 110.4(C-1′), 61.3(2 × Me), 61.0(2 ×OMe),45.2(C-a),30.4(C- β)。
3 讨论
本研究中,从日本金星蕨提取分离得到6个黄酮化合物,分别是化合物4(山柰酚,3 g),化合物5(高良姜素,28 mg),化合物 6(槲皮素 30 mg),化合物 10(四氢芫花素,9 mg),化合物 13(2’,4’ - 二羟基 -5’,6’ - 羟甲基查尔酮,16 mg),化合物 14(6’ - 羟基 -2',3',4',5'-甲氧基二氢查尔酮,12 mg),其中化合物10为首次从金星蕨中分离得到。
黄酮类化合物本身具有很多生物活性。文美琼等[5]研究发现,长根金星蕨总黄酮具有较有效的清除氧自由基活性,对DNA氧化损伤有显著的抑制作用。而本研究中提取分离得到最多的黄酮山柰酚药理研究报道非常多,如山柰酚能抑制离体人子宫肌瘤细胞增殖,下调ER、IGF-1和VEGF mRNA和蛋白的表达[6],以及山柰酚是一种有效的蛋白激酶CK2的抑制剂,作用机制可能与其阻碍CK2与ATP及底物的结合等有关[7]。因日本金星蕨中山柰酚含量相对高,值得关注其应用价值。
分离得到的其他黄酮也是药理研究的热门化合物。如高良姜素可能通过干扰细胞周期循环和介导线粒体功能障碍,诱导细胞凋亡,从而抑制胃癌SGC-7901细胞的生长[8]。槲皮素不仅在自然界中广泛分布,其药理作用也很广泛,具有抗氧化及清除自由基的作用,还具有抗癌、抗炎、抗菌、抗病毒、降糖、降压、免疫调节及心血管保护作用等[9]。
香豆素化合物3个,分别是化合物8(6-羟基香豆素,6 mg),化合物 9(6,7- 二羟香豆素,6 mg),化合物11(7-甲氧基香豆素,10 mg),均是首次从日本金星蕨中分离得到。香豆素具有抗肿瘤、抗凝血、抗艾滋病毒、抗炎、抗氧化、抗菌等多种药理活性,目前是抗肿瘤药物的研究热点[10]。
甾体化合物2个,分别是化合物1(4a-甲基 -3β -羟基雄甾 -7-烯 -17,4’-戊酸,11 mg),化合物2(β -谷甾醇)。
分离得到其他化合物3个,包括化合物3(麦芽醇,2.7 g),化合物 7(4-羟基 -3,5-二甲基苯甲酸,51 mg),化合物12(5,7-二羟基色原酮,10 mg)。麦芽醇含量最高,且用途非常广泛,是各种食品及化妆品的热门添加剂。最近研究显示,麦芽醇在肾氧化应激性损伤中还具有一定保护和协助修复的作用[11]。
参考文献:
[1] 中国科学院《中国植物志》编辑委员会.中国植物志·第4卷(第 1 分册)[M].北京:科学出版社,1999:15.
[2] 张文霞,钟希文.金星蕨科药用植物化学成分与药理作用研究进展[J].中国药房,2011,22(27):2582-2584.
[3] 周道年.副叶耳蕨和金星蕨化学成分及生物活性的研究[D].武汉:华中科技大学,2009.
[4] 付 伟,雷永芳,周道年,等.中日金星蕨黄酮类成分的研究[J].中国药学杂志,2010,45(3):166.
[5] 文美琼,李 璐,徐成东,等.长根金星蕨总黄酮抗氧化活性研究[J].楚雄师范学院学报,2014,29(3):44-48.
[6] 林小聪,陈小文,梁念慈,等.山奈酚抑制蛋白激酶CK2活性[J].中国生物化学与分子生物学报,2006,22(11):894-901.
[7] 蔡云朗,高永星,沈 杨,等.山奈酚对子宫肌瘤体外抑制作用的实验研究[J].实用妇产科杂志,2014,30(5):350-353.
[8] 许云霞,赵新淮.高良姜素对人胃癌SGC-7901细胞增殖、周期循环和凋亡的体外影响[J].中国药学杂志,2013,48(15):1274-1278.
[9] 孙 涓,余世春.槲皮素的研究进展[J].现代中药研究与实践,2015,44(6):748-749.
[10] 夏令先,王玉斌,钱 海,等.香豆素类化合物的抗肿瘤作用研究进展[J].中国新药杂志,2013,22(20):2392.
[11] 王 王景,吴小燕,姚 涛.麦芽醇对缺血性急性肾功能衰竭的影响[J].武汉大学学报(医学版),2010,31(4):514-516.
