黑色素瘤优先表达抗原在骨肉瘤组织中的表达及其临床意义
2018-05-22谭平先
谭平先, ,,,,, ,
(1.深圳市龙岗中心医院脊柱、骨肿瘤科,广东 深圳 518116;2.中山大学附属第一医院骨肿瘤科,广东 广州 510080)
肿瘤相关抗原能够刺激并被细胞毒性T淋巴细胞(cytotoxic T cell, CTL)识别,成为肿瘤免疫治疗的靶向抗原,有着较好的临床治疗前景,1997年Ikeda等[1]发现黑色素瘤优先表达抗原(preferentially expressed antigen of melanoma,PRAME)在黑色素瘤患者中表达,并且能被CTL识别,该肿瘤抗原位于22号染色体上,由509个氨基酸编码的抗原性蛋白,目前功能尚不清楚,其能被HLA-24识别,并递呈给CTL。作者应用免疫组化技术检测骨肉瘤患者治疗前穿刺活检标本中PRAME表达情况,并分析PRAME表达与患者预后关系,探讨其在骨肉瘤患者中的临床意义。
1 资料与方法
1.1一般资料95例骨肉瘤术前穿刺活检病理切片及16例术后骨纤维结构不良病理切片(阴性对照)均取自中山大学附属第一医院病理科病理组织标本库,95例骨肉瘤术前穿刺活检病理切片取自1998年至2008年间中山大学附属第一医院收治的骨肉瘤患者,均为所有治疗发生之前进行穿刺活检确定骨肉瘤诊断送病理检查的标本。所有标本活检及术后病理均确诊为骨肉瘤,且患者随访资料齐全。95例患者均获得了肿瘤广泛性切除和规范的新辅助化疗。
1.2方法主要试剂:羊抗人抗PRAME抗体(英国Abcam公司),兔抗羊二抗(美国Proteintech Group公司),羊抗人抗GAPDH抗体(美国Invitrogen公司)。具体方法:1)石蜡切片脱蜡水化,过氧化氢封闭内源性过氧化物酶,抗原修复,PBS洗涤,正常血清封闭。滴加一抗,4 ℃冰箱过夜孵育。PBS洗涤,滴加生物素化的二抗,37 ℃孵育40 min。PBS洗涤。滴加SAB复合物,37 ℃孵育40 min。PBS洗涤。DAB显色,镜下观察,适时终止,避免过度染色(自来水冲洗终止)。自来水充分冲洗。苏木素复染,室温滴加苏木素,孵育30 s,自来水冲洗。自来水冲洗返蓝,15 min。梯度酒精脱水:80%,2 min;95%,2 min;100%,5 min,2次。二甲苯透明。中性树胶封片。
1.3免疫组化染色判断从5个视野中选取100个细胞,根据阳性染色细胞的读数及染色的强度进行分级判断PRAME表达情况:0分:无肿瘤细胞阳性染色,阴性结果;1分:<10%肿瘤细胞阳性染色;2分:<50%肿瘤细胞阳性染色;3分:≥50%肿瘤细胞阳性染色。0分:无染色;1分:染色弱;2分:中度染色;3分:重度染色。根据上面评分标准设定阳性染色肿瘤细胞<50%为弱阳性,阳性染色肿瘤细胞≥50%为强阳性。由2名病理科医生阅片判断PRAME免疫组化染色分级及PRAME表达强弱程度。
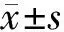
2 结果
2.1穿刺活检取材标本患者临床病理特征95例骨肉瘤就诊时穿刺活检标本病理切片均来自病理科组织库,95例患者中,男65例,女30例,平均年龄17.2(6~45)岁,平均随访时间86(6~144)个月。见表1。
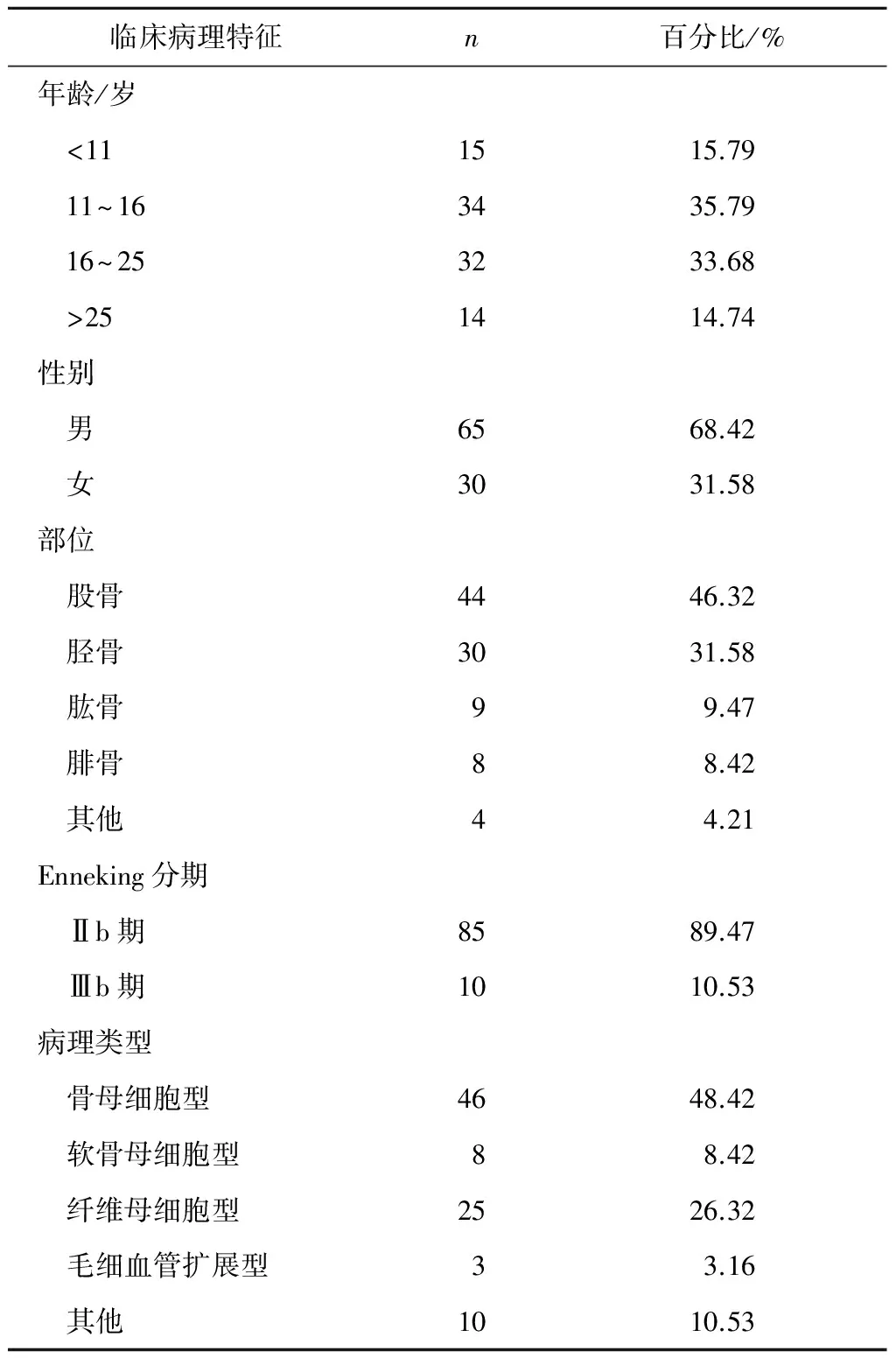
表1 95例患者的临床病理特征
2.2PRAME蛋白在骨肉瘤组织中表达情况免疫组化技术分析95例骨肉瘤治疗前穿刺活检病理切片发现,阳性染色肿瘤细胞既有细胞浆内PRAME蛋白阳性染色,又有细胞核内PRAME蛋白阳性染色,也有肿瘤细胞的细胞浆、细胞核均有PRAME蛋白阳性染色。因此PRAME蛋白既有在肿瘤细胞的细胞核内分布,也有在细胞浆内分布。部分标本肿瘤细胞的细胞浆、细胞核PRAME蛋白染色均为阴性,无PRAME蛋白表达。95例病理切片中PRAME蛋白阴性26例,阳性69例。69例阳性染色标本中32例为强阳性,37例为弱阳性,另外作为阴性对照的16例骨纤维结构发育不良患者的组织病理切片PRAME蛋白染色均为阴性,骨纤维结构发育不良组织中未检测到PRAME蛋白表达。见图1。
2.3PRAME蛋白表达与骨肉瘤患者临床病理特征的关联性及预后意义单因素回归分析示,PRAME蛋白在骨肉瘤组织中的表达与患者的年龄、性别、肿瘤部位、Enneking分期及病理类型等无关(P>0.05,表2)。Kaplan-Meier生存分析显示,治疗前穿刺活检病理切片PRAME蛋白强阳性患者预后差,5 a总生存率仅为29.9%;而治疗前穿刺活检病理切片PRAME蛋白阴性或弱阳性患者预后较好,5 a总生存率60.4%,差异有统计学意义(P=0.010)。另外治疗前穿刺活检标本病理切片PRAME蛋白染色强阳性患者较PRAME蛋白阴性或弱阳性患者发生肺转移的风险明显增加(P=0.032,表3)。
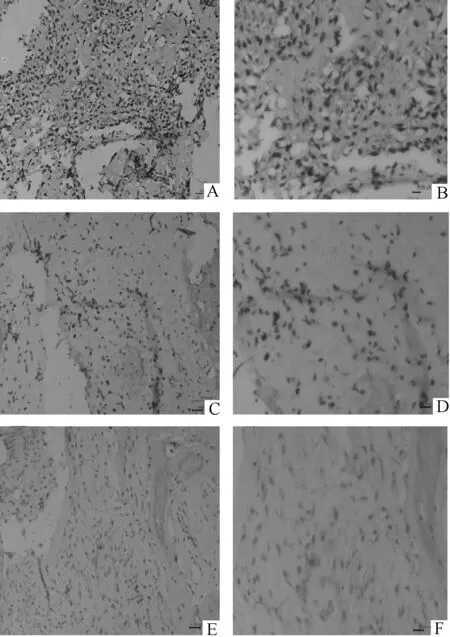
图1 PRAME蛋白在骨肉瘤和
A、B:PRAME蛋白强阳性骨肉瘤标本;C、D:PRAME蛋白弱阳性骨肉瘤标本;E、F:PRAME蛋白阴性骨纤维结构发育不良标本
3 讨论
骨肉瘤是多发于儿童、青少年人群的恶性肿瘤,新辅助化疗明显的提高了患者生存率,但肺转移和肿瘤复发仍是威胁患者生存的重要因素。寻找新的免疫治疗方法和靶向药物是目前研究的热点,肿瘤抗原可以刺激机体产生针对肿瘤抗原的CTL从而杀伤肿瘤细胞,还可以作为肿瘤免疫和生物治疗的靶向目标。PRAME最早由Ikeda等[1]从黑色素瘤细胞中分离出来的一种肿瘤相关抗原,能够被HLA-A24分子递呈给CTL。PRAME蛋白能够刺激产生CTL,并被CTL-17识别和溶解。PRAME除了在卵巢、睾丸生殖细胞表达外,还在肾上腺、胎盘及子宫内膜有少量的表达。但其微弱的表达量不能被CTL所识别,而在大多数恶性血液病及实体瘤中PRAME异常高表达,因此被认为是肿瘤免疫治疗理想的靶向目标[2]。本课题组的前期研究[3-4]证实,通过骨肉瘤蛋白质组学及肿瘤分子标志物基因芯片的筛选研究发现PRAME在骨肉瘤组织中异常表达,现在我们对其在骨肉瘤组织中的具体表达情况及其表达变化与患者临床预后的关系进行了更深入的研究。结果发现,PRAME蛋白在大多数患者标本中有表达,且PRAME蛋白在骨肉瘤患者中的表达变化与肺转移的发生和疾病的预后有着密切的联系。
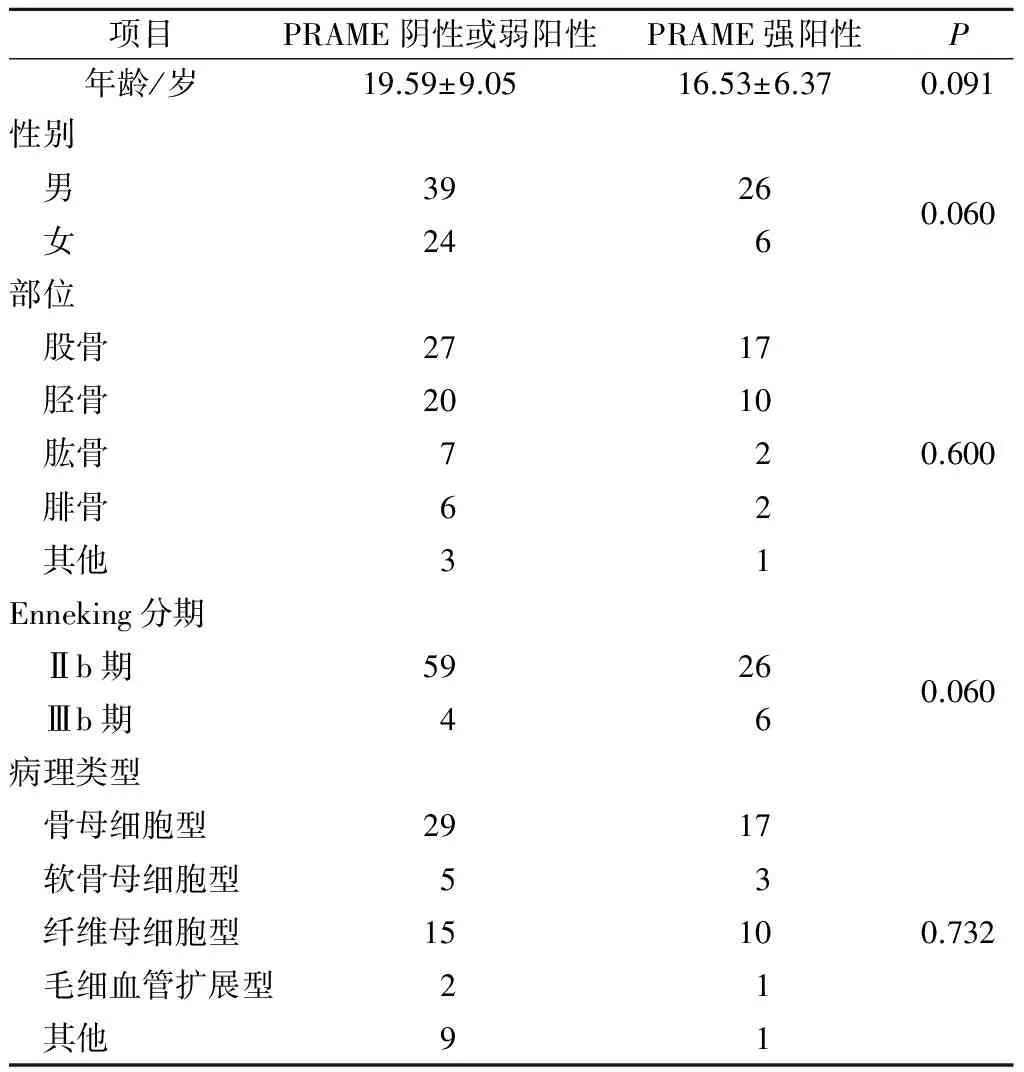
表2 95例骨肉瘤组织中PRAME的表达与临床病理特征的关系
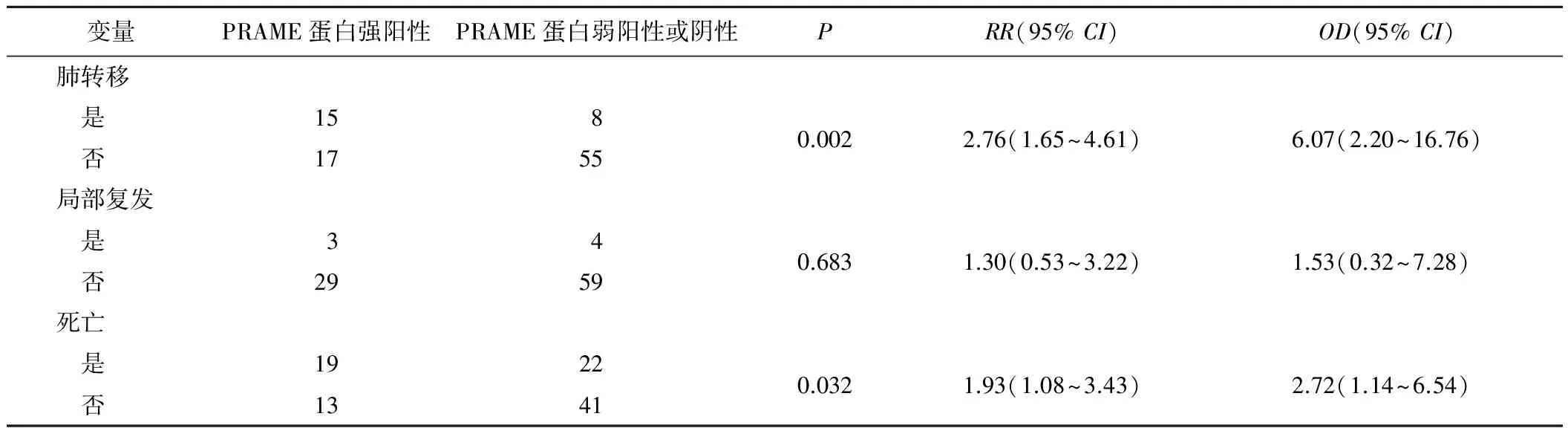
表3 PRAME蛋白表达与骨肉瘤患者临床预后的关联性 n
有研究[5-9]报道在一些类型的恶性血液病及实体瘤中检测到PRAME基因有不同程度的高表达,其中在神经母细胞瘤和绝经前乳腺癌患者中,PRAME基因转录文本表达水平的高低还与疾病的预后有关。另外,在一些恶性肿瘤中PRAME表达变化除与疾病进展、预后有关外,系统化疗前后PRAME表达变化还与治疗效果有关,如在一些类型的白血病患者中经过化疗后PRAME基因表达水平明显下降。因此,PRAME除被看作疾病进展变化及预后的指标外,还被作为检测肿瘤治疗后微小病灶残存和化疗效果评价的指标[10-14]。Haqq等[15]发现PRAME表达水平的高低与黑色素瘤分期有关。Oberthue等[8]报道PRAME高表达的神经母细胞瘤患者生存时间短,预后差。Tajeddine等[10]报道在急性髓样白血病(Acute myeloid leukemia,AML)中,PRAME基因转录文本高表达的患者预后较好,分析认为PRAME基因转录文本高表达患者预后好的原因可能是由于PRAME刺激机体CTL的增殖和活性,杀伤和攻击肿瘤细胞所致。Partheen等[16]报道在卵巢腺癌患者中PRAME高表达往往预示着疾病的进展和预后不良。Watari等[17]报道PRAME基因转录文本高表达与慢性髓样白血病的恶化相关,并认为PRAME是BCR/ABL的诱导基因,与造血干细胞的恶性转化有一定关联。我们的研究发现PRAME蛋白在治疗前穿刺活检标本中强阳性表达的骨肉瘤患者往往预后较差。免疫组化分析PRAME蛋白强阳性表达骨肉瘤患者5 a生存率仅29.9%,而弱阳性或阴性表达PRAME蛋白的骨肉瘤患者5 a生存率是60.4%,后者明显升高。另外,PRAME在治疗前穿刺活检标本中强阳性表达的骨肉瘤患者较PRAME弱阳性或阴性患者有着更高发生肺转移的风险,而与肿瘤复发和其他因素无明显关联性。这预示着PRAME对肿瘤的发生、发展及疾病的预后有着一定的影响。当然,影响骨肉瘤患者预后的因素很多,包括手术是否彻底、肿瘤对化疗反应等。同时,治疗的差异也影响PRAME与骨肉瘤患者预后的关联性,关于PRAME与骨肉瘤患者预后的关联性仍需大样本、多中心、长期的临床观察和验证,我们仅观察到了初步的现象。PRAME在骨肉瘤细胞中的功能、作用机制及对疾病发生、发展作用尚需进一步研究、探索。
我们仅在实验和临床中观察到PRAME在人骨肉瘤细胞和组织标本中异常表达,其异常表达的具体原因和意义尚不清楚,有待进行更深入的研究和探索。研究观察到PRAME高表达和骨肉瘤患者预后差、发生肺转移风险增加这种关联性尚需大样本、多中心、长期的观察随访。因为影响骨肉瘤患者预后的因素是多方面,不同患者之间治疗方法的差异(手术、化疗),肿瘤对化疗的反应,肿瘤负荷等都会影响患者的预后,这些混杂因素很可能妨碍判断及结论的正确性。虽然PRAME作为很有潜在应用价值的肿瘤特异性抗原,但利用其开发新药及新的治疗手段仍面临很多困难。
参考文献:
[1] IKEDA H, LETHE B, LEHMANN F, et al. Characterization of an antigen that is recognized on a melanoma showing partial HLA loss by CTL expressing an NK inhibitory receptor[J]. Immunity,1997,6(2):199-208.
[2] VAN BAREN N, CHAMBOST H, FERRANT A, et al. PRAME, a gene encoding an antigen recognized on a human melanoma by cytolytic T cells, is expressed in acute leukaemia cells[J]. Br J Haematol,1998,102(5):1376-1379.
[3] ZOU C, SHEN J, TANG Q, et al. Cancer-testis antigens expressed in osteosarcoma identified by gene microarray correlate with a poor patient prognosis[J]. Cancer,2012,118(7):1845-1855.
[4] JIN S, SHEN JN, GUO QC, et al. 2-D DIGE and MALDI-TOF-MS analysis of the serum proteome in human osteosarcoma[J]. Proteomics Clin Appl,2007,1(3):272-285.
[5] PROTO-SIQUEIRA R, FIGUEIREDO-PONTES LL, PANEPUCCI RA, et al. PRAME is a membrane and cytoplasmic protein aberrantly expressed in chronic lymphocytic leukemia and mantle cell lymphoma[J]. Leuk Res,2006,30(11):1333-1339.
[6] IKEDA H, MATSUSHITA M, KAWAKAMI H. PRAME protein expressed in leukemia cells as a target molecule for immunotherapy[J]. Rinsho Ketsueki,1999,40(6):484-486.
[7] STEINBACH D, HERMANN J, VIEHMANN S, et al. Clinical implications of PRAME gene expression in childhood acute myeloid leukemia[J]. Cancer Genet Cytogenet,2002,133(2):118-123.
[8] OBERTHUER A, HERO B, SPITZ R, et al. The tumor-associated antigen PRAME is universally expressed in high-stage neuroblastoma and associated with poor outcome[J]. Clin Cancer Res,2004,10(13):4307-4313.
[9] EPPING MT, HART AA, GLAS AM, et al. PRAME expression and clinical outcome of breast cancer[J]. Br J Cancer,2008,99(3):398-403.
[10] PAYDAS S, TANRIVERDI K, YAVUZ S, et al. PRAME mRNA levels in cases with chronic leukemia: Clinical importance and review of the literature[J]. Leuk Res,2007,31(3):365-369.
[11] TAJEDDINE N, LOUIS M, VERMYLEN C, et al. Tumor associated antigen PRAME is a marker of favorable prognosis in childhood acute myeloid leukemia patients and modifies the expression of S100A4, Hsp 27, p21, IL-8 and IGFBP-2 in vitro and in vivo[J]. Leuk Lymphoma,2008,49(6):1123-1131.
[12] KAWANO R, KARUBE K, KIKUCHI M, et al. Oncogene associated cDNA microarray analysis shows PRAME gene expression is a marker for response to anthracycline containing chemotherapy in patients with diffuse large B-cell lymphoma[J]. J Clin Exp Hematop,2009,49(1):1-7.
[13] SANTAMARIA C, CHILLON MC, GARCIA-SANZ R, et al. The relevance of preferentially expressed antigen of melanoma (PRAME) as a marker of disease activity and prognosis in acute promyelocytic leukemia[J].Haematologica,2008,93(12):1797-1805.
[14] TAJEDDINE N, MILLARD I, GAILLY P, et al. Real-time RT-PCR quantification of PRAME gene expression for monitoring minimal residual disease in acute myeloblastic leukaemia[J]. Clin Chem Lab Med,2006,44(5):548-555.
[15] HAQQ C, NOSRATI M, SUDILOVSKY D, et al. The gene expression signatures of melanoma progression[J]. Proc Natl Acad Sci U S A,2005,102(17):6092-6097.
[16] PARTHEEN K, LEVAN K, OSTERBERG L, et al. Four potential biomarkers as prognostic factors in stage Ⅲ serous ovarian adenocarcinomas[J]. Int J Cancer,2008,123(9):2130-2137.
[17] WATARI K, TOJO A, NAGAMURA-INOUE T, et al. Identification of a melanoma antigen, PRAME, as a BCR/ABL-inducible gene[J]. FEBS Lett,2000,466(2/3):367-371.
