肺腺鳞癌临床病理特征及预后分析
2018-05-22梁文昌
梁文昌,,,,,
(1.安阳市肿瘤医院内科,河南 安阳 455000;2.安阳市肿瘤医院胸外科,河南 安阳 455000)
肺腺鳞癌是一种特殊类型的非小细胞肺癌[1],混合有2种恶性肿瘤成分,其中任一种肿瘤成分至少占全部肿瘤的10%[2]。由于肺腺鳞癌的组织成分较为复杂,侵袭性高,预后较肺腺癌或肺鳞癌差,目前并未形成统一的标准治疗方案[3]。本研究选取2010年1月至2015年12月我院收治的60例肺腺鳞癌患者为研究对象,进行回顾性分析,旨在了解其临床病理特征及预后相关因素。
1 资料与方法
1.1一般资料选取2010年1月至2015年12月我院收治的60例肺腺鳞癌患者作为研究对象,所有患者均经经皮肺穿活检、纤维支气管镜、术后病理活检等一系列检查确诊为肺腺鳞癌。其中男35例,女25例,男女之比为1.41。年龄32~85(56.7±14.3)岁。重度吸烟者(吸烟指数≥400支/a)32例(53.3%),吸烟史10~50(25.7±5.3) a,不吸烟者28例(46.7%)。无明显症状经体检发现18例(30.0%),其余患者主要肺部特征:咳嗽22例(36.7%),痰中带血11例(18.3%),胸闷气短4例(6.7%),胸痛3例(5%),声音嘶哑1例(1.6%),发热1例(1.6%)。同时经影像学检查发现,周围型肺癌45例(75.0%),中央型肺癌15例(25.0%)。肿瘤位于左肺上叶9例(15.0%),位于左肺下叶13例(21.7%),位于右肺上叶14例(23.3%),位于右肺中叶4例(6.7%),位于右肺下叶16例(26.7%);侵犯双叶肺者4例(6.7%)。全组60例患者自然病程为2.8(0.9~10.8)个月。
1.2临床病理特征所有患者均经经皮肺穿活检、纤维支气管镜、术后病理活检等一系列检查确诊为肺腺鳞癌,其中术前共43例(71.7%)接受痰脱落细胞学检查、纤维支气管镜、经皮肺穿活检、病理活检等检查,最终确诊为肺腺鳞癌6例,术前诊断为鳞癌16例,腺癌17例,非小细胞癌4例。全组患者Ia期2例,Ib期4例,Ⅱa期4例,Ⅱb期7例,Ⅲa期22例,Ⅲb期15例,Ⅳ期6例。
1.3治疗情况
1.3.1 手术情况 未行手术治疗的患者6例,行手术治疗的患者54例,其中标准肺叶切除+纵膈淋巴结清扫术44例,双叶均切除4例,全肺均进行切除6例。
1.3.2 术后情况 60例肺腺鳞癌患者中,未行手术的6例患者中有3例行全身化疗,2例行局部放疗,1例行同步放化疗。进行手术治疗但未进行术后辅助化疗或放疗5例,进行术后辅助化疗29例,进行术后辅助放疗14例,进行术后辅助放化疗6例。患者术后出现复发或转移之后,有14例(23.3%)行表皮生长因子受体(epidermal growth factor receptor,EGFR)基因检测突变阳性,口服小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKIs)治疗,每天口服吉非替尼150 mg、厄洛替尼250 mg或埃克替尼375 mg。9例疗效较好,疾病无进展时间超过6个月。
1.4统计学处理采用SPSS 17.0对数据进行处理。计数资料分析用χ2检验,用Kaplan-Meier法计算中位生存时间、生存率及绘制生存曲线,组间总体生存比较采用log rank检验,多因素分析用COX风险比例回归模型,建立COX回归方程,检验水准α=0.05。
2 结果
2.1治疗效果60例肺腺鳞癌患者5 a生存率为21.5%,中位生存时间为21.0个月,54行手术治疗的患者5 a生存率为24.6%,中位生存时间为25.1个月(图1)。54例接受手术治疗的患者中术后有35例(64.8%)出现局部区域复或远处转移,术后最短的复发和转移时间2.3~36.2个月,术后常见的复发转移部位为肺转移,纵隔、锁骨上淋巴结转移,脑转移,骨转移,肝转移,也可见心包转移及肾上腺转移。
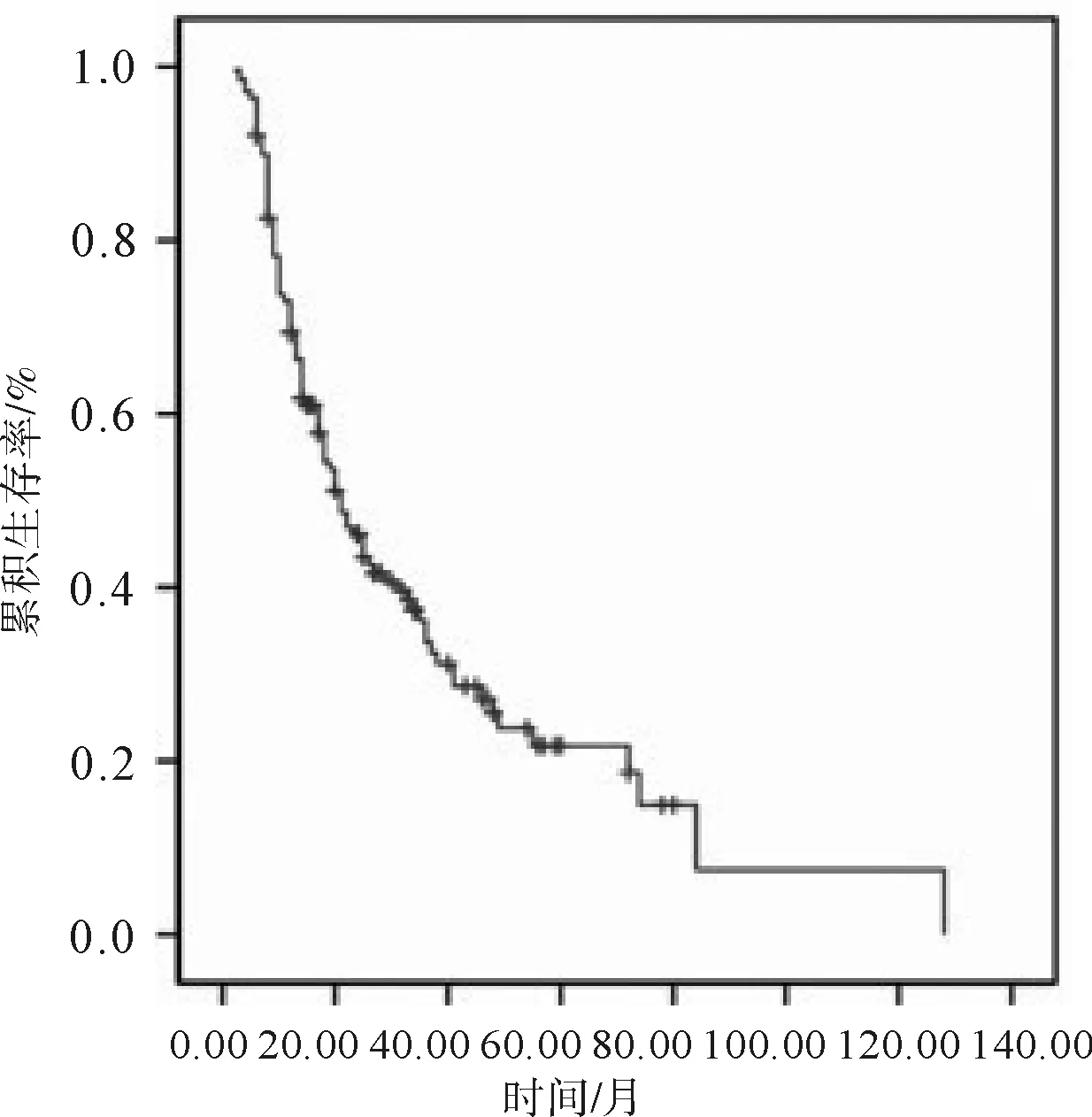
图1 60例肺腺鳞癌患者的生存曲线
2.2单因素分析肺腺鳞癌患者影响预后的因素本研究对肺腺鳞癌患者的年龄、性别、吸烟年龄、自然过程、肿瘤大小、是否转移或复发、病理分期、基因突变、是否手术、治疗模式等一系列因素对生存时间的影响进行单因素分析,结果显示:年龄、性别、吸烟年龄、自然病程、肿瘤大小等对患者预后无明显影响(P>0.05);肿瘤大小、是否复发或转移、病理分期、基因突变、是否手术、治疗模式则对患者预后影响较大(P<0.05)。肿瘤长径<3 cm者生存时间明显长于≥3 cm者(P<0.05);术后无复发或转移患者生存时间明显优于发生复发或转移患者(P<0.05);早期患者生存时间明显优于晚期患者(P<0.05);基因突变阳性患者生存时间明显优于基因突变阴性患者(P<0.05);行手术治疗的患者生存时间明显长于未行手术治疗的患者(P<0.05);行手术治疗且术后接受辅助治疗的患者生存时间长于行手术治疗但术后未行辅助治疗的患者(P<0.05)。
2.3多因素分析肺腺鳞癌患者影响预后的因素本研究采用COX风险比例回归模型,建立COX回归方程,进行多因素分析,结果显示:病理分期、基因突变、是否手术是肺腺鳞癌独立的预后因素(P<0.05)。
3 讨论
肺腺鳞癌是非小细胞肺癌中一种特殊的混合细胞类型,是肺癌中比较少见的一种病理类型,是指肺癌组织既包含有鳞癌成分也包含有腺癌成分。据国外文献[4]报道,肺腺鳞癌在非小细胞肺癌中占0.4%~4.0%。肺腺鳞癌兼具有腺癌和鳞癌的临床特征,一方面影像学检查显示肿瘤多数为周围型,符合肺腺癌特点;另一方面,肺腺鳞癌绝大部分患者为重度吸烟人群,肿瘤直径相对较大,与肺鳞癌相似。Ichinose等[5]研究表明,肺腺鳞癌的肿瘤细胞具有双向分化的迹象,但是其肿瘤细胞又没有进行分化,也体现了肺腺鳞癌的肿瘤细胞拥有较强的异质性。但是肺腺鳞癌在临床上发病率低,其临床表现也不典型,但是其又是属于肺癌的一种类型,在发生机制、临床特征、预后影响因素等方面也有与肺癌的相同之处,但是又有其不同。据文献[6]报道,其临床特征为:1)与腺癌或鳞癌比较,其淋巴结转移发生较早,其次是骨转移;2)其转移容易到达脏层胸膜;3)其手术效果较差,恶性程度较高。
Tochigi等[7]检测23例西方人群肺腺鳞癌患者,EGFR基因突变率为13.0%,KRAS基因突变率为13.0%,这与西方人群肺腺癌EGFR和KRAS基因突变率相似。Sasaki等[8]报道日本肺腺鳞癌患者EGFR基因突变率为15.4%,Kang等[9]报道韩国肺腺癌患者EGFR基因突变率为44.0%。本研究中EGFR突变率为23.3%,与国外文献报道并不一致,有待进一步扩大样本量探讨我国肺腺癌基因突变状态。
非小细胞肺癌是恶性肿瘤死亡的主要原因之一,5 a总生存率为25%[10]。有研究[11-12]显示,肺腺鳞癌患者术后5年生存率为6.2%~59.4%。Mordant等[13]报道141例肺腺鳞癌术后患者5 a生存率为37.0%,低于肺鳞癌和腺癌(43.4%和42.8%)。Shimizu等[14]分析1 284例接受手术的原发性肺癌患者,其中肺腺鳞癌44例,5 a生存率为18.5%,明显低于鳞癌和腺癌(38.7%和39.2%)。本组60例患者5 a生存率为21.5%,54例手术患者5 a生存率为24.6%,与文献报道一致。肺腺鳞癌的生存率明显低于其他类型非小细胞肺癌,死亡风险也较大,因此,肺腺鳞癌还需要在分子水平上大力研究,进一步提高其生存率。由于肺腺鳞癌具有生物学特殊性,影响其预后的因素尤为重要。李鉴等[15]整理分析了361例肺腺鳞癌患者的临床资料,总结出病理分期及是否手术对患者预后具有比较明显的影响。本研究多因素分析显示,病理分期、基因突变、是否手术是肺腺鳞癌独立的预后因素。
综上所述,肺腺鳞癌具有较强的异质性,且临床症状不典型,恶性程度高、预后差,应加大其临床研究,提高早期诊断率,治疗上采取以手术为主的综合治疗模式,延长患者生存时间。
参考文献:
[1] MAEDA H, MATSUMURA A, KAWABATA T,et al. Adenosquamous carcinoma of the lung: surgical results as compared with squamous cell and adenocarcinoma cases[J].Eur J Cardiothorac Surg,2012,41(2):357-361.
[2] MORDANT P, GRAND B, CAZES A,et al. Adenosquamous carcinoma of the lung: surgical management, pathologic characteristics, and prognostic implications[J].Ann Thorac Surg,2013,95(4):1189-1195.
[3] 郭雷鸣.EGFR-TKI联合放疗对晚期非小细胞肺癌EGFR-TKI治疗后新发骨转移的临床疗效[J].肿瘤基础与临床,2017,30(5):403-406.
[4] SHUNDO Y,TAKAHASHI T,ITAYA T,et,al.Clinical study of forty-two patients who underwent resection for pulmonary adenosquamous carcinoma[J]. Kyobu Geka,2011,64(10):871-876.
[5] ICHINOSE Y,HARA N,TAKAMORI S,et al. DNA ploidy pattern ofeach carcinomatous component in adenosquamous lung carcinoma[J]. Ann Thorac Surg , 1993,55(3):593-596.
[6] PIROZYNSKI M.100 years of lung cancer[J]. Respir Med,2006,100 (12): 2073-2084.
[7] TOCHIGI N,DACIC S,NIKIFOROVA M,et al.Adenosquamous carcinoma of the lung:a microdissection study of KRAS and EGFR mutational and amplification status in a western patient population[J]. Am J Clin Pathol,2011,135(5):783-789.
[8] SASAKI H, ENDO K, YUKIUE H, et al. Mutation of epidermal growthfactor receptor gene in adenosquamous carcinoma of the lung[J]. Lung Cancer, 2007, 55(1): 129-130.
[9] KANG SM, KANG HJ, SHIN JH, et al. Identical epidermal growth factor receptor mutations in adenocarcinom-atous and squamous cell carcinomatous components of adenosquamous carcinoma of the lung [J]. Cancer, 2007, 109(3): 581-587.
[10] PELLETIER MP,EDWARDES MD,MICHEL RP,et al. Prognostic markers in resectable non-small cell lung cancer:a multivariate analysis.[J].Can J Surg,2001,44(3):180-188.
[11] COOKE DT, NGUYEN DV, YANG Y, et al. Survival comparison of adenosquamous, squamous cell, and adenocarcinoma of the lung after lobectomy[J]. Ann Thorac Surg, 2010, 90(3): 943- 948.
[12] NAKAGAWA K, YASUMITU T, FUKUHARA K, et al. Poor prognosis after lung resection for patients with adenosquamous carcinoma of the lung[J]. Ann Thorac Surg, 2003, 75(6): 1740-1744.
[13] MORDANT P, GRAND B, CAZES A, et al. Adenosquamous carcinoma of the lung: surgical management, pathologic characteristics, and prognostic implications[J]. Ann Thorac Surg, 2013, 95(4): 1189-1195.
[14] SHIMIZU J, ODA M, HAYASHI Y, et al. A clinicopathologic study of resected cases of adenosquamous carcinoma of the lung[J]. Chest, 1996, 109(4):989-994.
[15] 李鉴,张德超,赫捷,刘向阳,牟巨伟,张良泽.肺腺鳞癌临床病理特点和外科治疗预后研究[J].中国现代手术学杂志,2009,13(4):241-244.
