程序性死亡受体1和程序性死亡配体1在食管鳞癌组织中的表达
2018-05-22朱卫伟
朱卫伟,, ,
(1.河南科技大学临床医学院,河南 洛阳 471003;2.安阳市肿瘤医院,河南 安阳 455000)
食管癌是人类常见的消化道恶性肿瘤,在肿瘤致死疾病中位居前列。食管癌的发病不但具有地域性[1],高发区集中在河南省的林州市和河北省的磁县;而且具有性别差异,男性居多,高发区男性发病率约为女性的2~3倍[2]。根据组织学分类,可将食管癌分为食管鳞癌、食管腺癌和未分化癌等,其中食管鳞癌占90%以上[3]。虽然针对食管癌的发病机制已经进行了大量研究和流行病学调查,但是目前食管癌的病因尚不完全清楚明了。
程序性死亡受体1(programmed death 1,PD-1)是CD28家族的成员之一,主要介导信号的抑制,在造血组织中广泛表达,并参与一部分CD4-CD8-胸腺细胞、未成熟的B细胞和某些外周T细胞的表达。程序性死亡配体1(programmed death ligand 1,PD-L1)是PD-1的主要配体,又名CD274,B7家族成员之一,其可广泛表达于淋巴细胞上,但也可表达在肿瘤细胞上,PD-1/PD-L1信号通路是负性免疫调节的关键通路之一。PD-1和PD-L1在原发性肝癌、胃癌、肺癌、乳腺癌等肿瘤中存在高表达,本研究采用免疫组化S-P法检测PD-1及PD-L1在未行新辅助治疗食管鳞癌及癌旁正常食管黏膜组织中的表达情况,并分析两者在食管鳞癌中表达与临床病理特征的关系。
1 资料与方法
1.1一般资料选取2016年2月至2017年2月在安阳市肿瘤医院行根治性手术的49例食管鳞癌患者的石蜡组织标本,所有患者均有明确的鳞癌的病理诊断结果,且为未接受任何治疗的初治患者,并且排除存在有明显的免疫性疾病的患者。40例患者中,男28例,女21例;年龄53~74岁,中位年龄63岁。
1.2主要试剂PD-1抗体购自英国Abcam公司,PD-L1抗体购自美国RD公司,通用型S-P试剂盒和DAB显色试剂盒购自北京中杉金桥生物技术有限公司,柠檬酸修复液购自意大利BBI公司。
1.3检测方法指标检测应用免疫组化S-P法进行。蜡块均由病理科专业技术人员处理制备切片。实验操作步骤均按照说明书严格进行。其中PD-1抗体按照1200倍稀释,PD-L1抗体按照120倍稀释。
1.4染色判读高倍镜下随机挑选4~5个视野观察,根据细胞膜及细胞质染色强度(阴性=0、弱阳性=1、中度阳性=2、强阳性=3)和阳性肿瘤细胞数(0%=0、1%~10%=1、11%~50%=2、51%~75%=3、>75%=4)的乘积进行免疫综合评分,<2分为阴性,≥2分为阳性。所有的免疫组化切片均由固定的2名资深病理科副主任医师以上职称的医生独立进行评价。
1.5统计学处理采用SPSS 17.0处理数据,计数资料用百分数表示,比较用χ2检验,检验水准α=0.05。
2 结果
2.1PD-1在不同食管组织中的表达PD-1阳性表达主要表达于肿瘤浸润性淋巴细胞,呈棕黄色或黄色颗粒。PD-1在食管鳞癌及其癌旁正常食管黏膜组织中的阳性表达率分别为36.7%(18/49)、16.3%(8/49),差异有统计学意义(P<0.05)。见图1、表1。
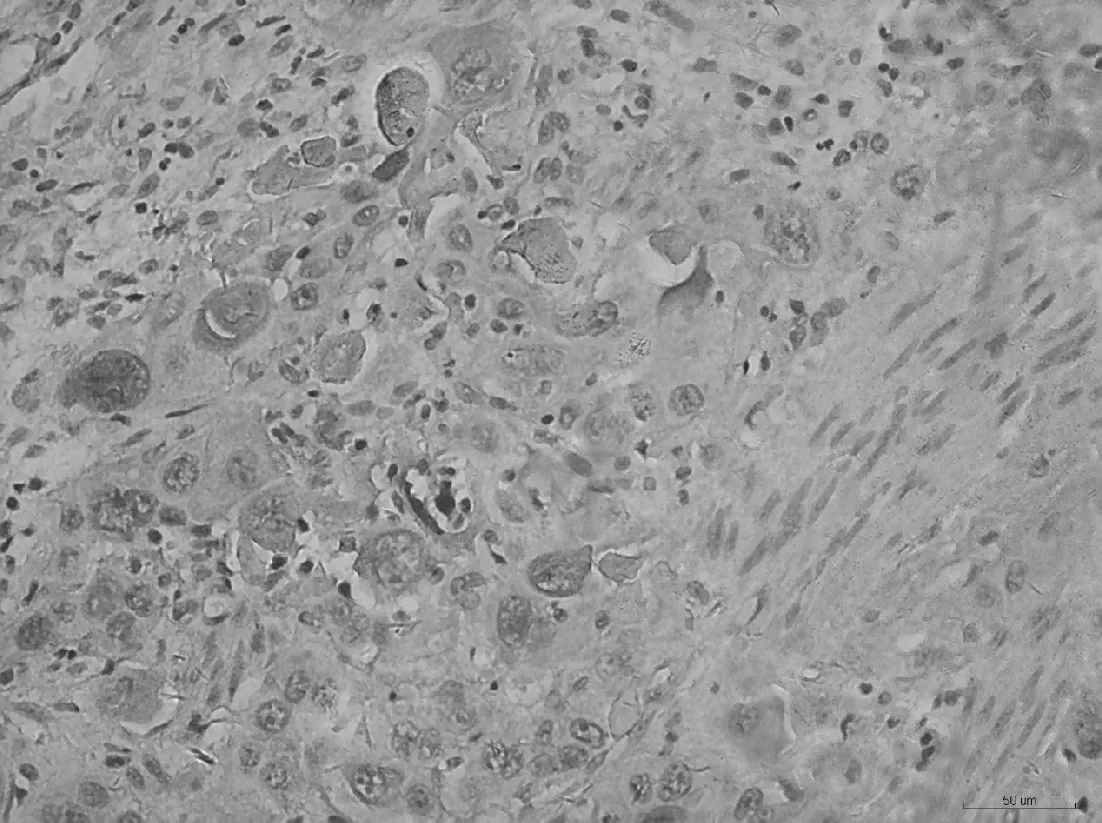
图1 PD-1在食管鳞癌组织中的表达(S-P,×200)

表1 PD-1在食管鳞癌和癌旁正常食管黏膜组织中的表达
2.2PD-L1在不同食管组织中的表达PD-L1在肿瘤细胞膜和细胞质中均有发现,呈棕黄色或黄色颗粒。PD-L1在食管鳞癌及其癌旁正常食管黏膜组织中的阳性表达率分别为49.0%(24/49)、22.4%(11/49),差异有统计学意义(P<0.05)。见图2、表2。
2.3PD-1和PD-L1的表达与食管鳞癌患者临床病理特征的关系PD-L1在食管鳞癌中的表达与食管癌的肿瘤浸润深度及TNM分期有关(P均<0.05)。见表3、4。
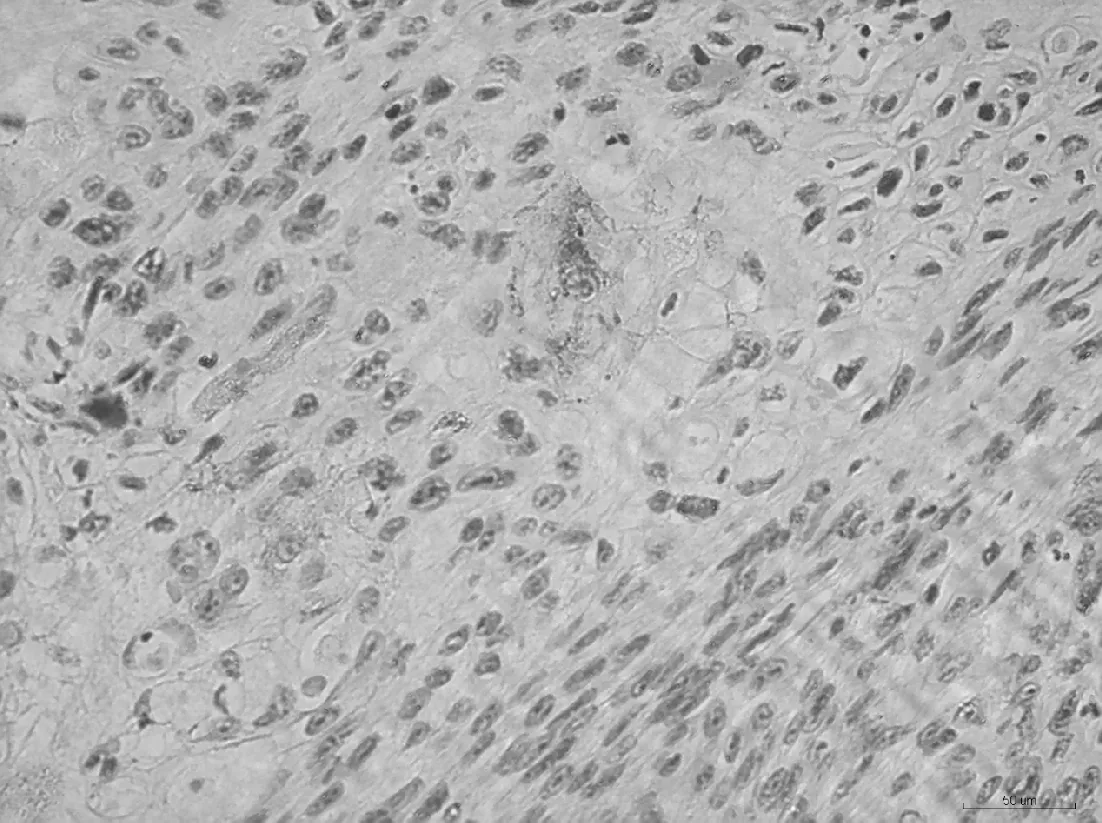
图2 PD-L1在食管鳞癌组织中的表达(S-P,×200)
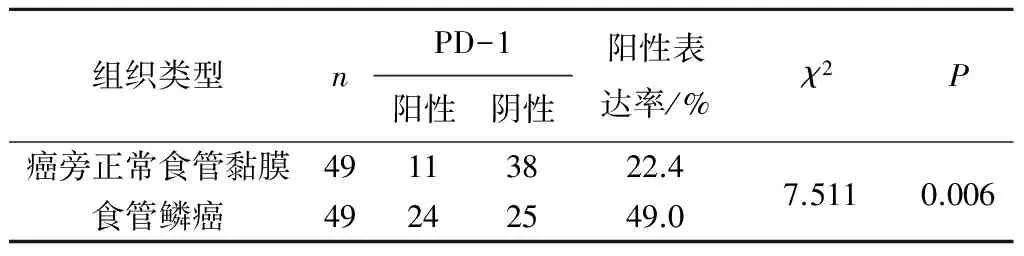
表2 PD-L1在食管鳞癌和癌旁正常食管黏膜组织中的表达
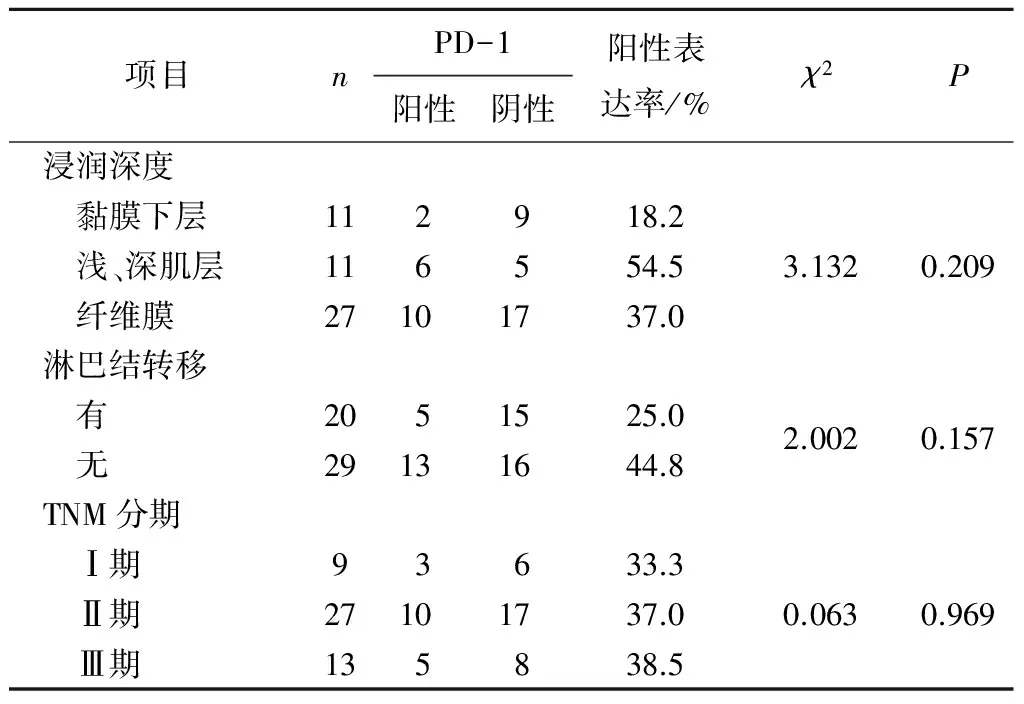
表3 PD-1在食管鳞癌组织中的表达与临床病理特征的关系
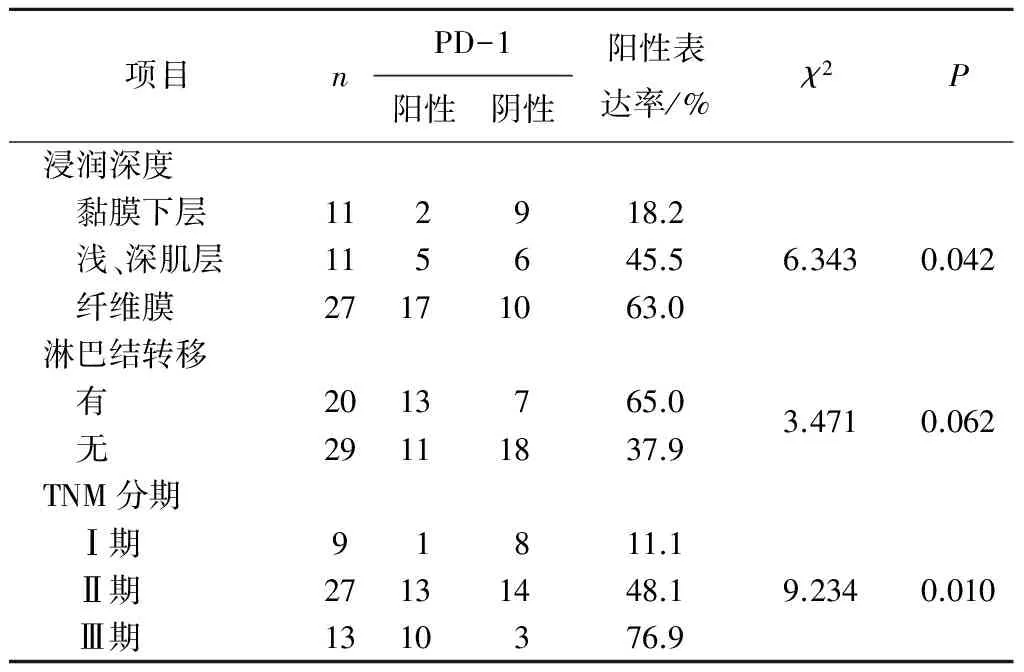
表4 PD-L1在食管鳞癌组织中的表达与临床病理特征的关系
3 讨论
PD-1是CD28超家族中的一种重要免疫抑制分子。PD-L1是人体内一种由CD274基因编码的蛋白质。PD-L1与PD-1的结合,可以传导抑制性信号。以PD-1和PD-L1为靶点的免疫调节在抗肿瘤、抗感染、抗自身免疫疾病等过程中均有重要意义。PD-1/PD-L1信号通路的激活有助于肿瘤细胞的免疫逃逸。体内外实验证实,阻断该通路可增强机体内源性抗肿瘤免疫效应。
Wu等[4]曾经对102例胃癌组织标本进行免疫组化检测,结果发现,PD-L1在胃癌组织中的阳性表达率为42.2%,而正常胃黏膜组织中没有表达,且PD-L1在胃癌组织中的表达与患者的肿瘤大小、肿瘤浸润程度、淋巴结是否有转移有相关性。吴圣[5]随后通过对安徽医科大学第一附属医院2007年至2009年218例胃癌组织标本和随机选取的20例癌旁组织标本进行免疫组化检测,结果发现PD-1和PD-L1在胃癌组织的阳性表达率分别为40.8%和66.9%,癌旁组织不表达。PD-L1在胃癌组织中的表达与患者的TNM分期、浸润深度、是否有淋巴结转移有相关性。PD-1在胃癌组织中的表达与临床病理特征无显著相关性。
Chen等[6]通过对浙江省肿瘤医院于2008年至2012年接受手术治疗的536例食管鳞癌患者的手术标本进行免疫组化检测,发现PD-1和PD-L1在其标本的阳性表达率分别为33.5%和41.4%,还发现PD-L1的表达与肿瘤的位置、肿瘤的分化程度、是否有淋巴结转移及TNM分期有关,而PD-1的表达与患者的临床病理特征没有任何相关性。在本研究中,PD-1和PD-L1在食管鳞癌组织中的阳性表达率分别为36.7%和49.0%。PD-1和PD-L1在食管鳞癌组织中的表达均高于其对应的癌旁正常食管黏膜组织。PD-L1的阳性表达与肿瘤的浸润深度和TNM分期有关。这些前述研究一致。但是PD-L1的表达与淋巴结是否发生转移没有相关性,这与前述报道不一致,这可能与本次实验的样本量少不具备代表性有关。
PD-1和PD-L1的相互作用导致免疫抑制,这可能是对肿瘤细胞产生免疫抵抗的部分原因。但是PD-L1高表达也可能与其他未知的受体结合导致T细胞增殖分泌一些细胞因子,如IL-10和IFN-γ,这些会对肿瘤进行攻击。在本次研究中,PD-1和PD-L1在食管鳞癌组织和癌旁正常食管黏膜组织中的表达差异有统计学意义,这说明PD-1和PD-L1参与了食管鳞癌的发生;并且食管鳞癌患者TNM分期越高,食管癌细胞浸润程度越深,其PD-L1表达率越高,这可能提示PD-L1在食管癌的发展中起到重要作用。
综上所述,PD-1和PD-L1在食管鳞癌组织中存在高表达,且PD-L1在食管鳞癌的发生、发展中起到重要的作用。因此,阻断PD-1/PD-L1信号通路可能是对肿瘤患者开展免疫治疗的有效途径,为食管癌患者的免疫治疗提供新思路和方法。
参考文献:
[1] JEMAL A, BRAY F, CENTER MM, et al. Global cancer statistics [J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[2] ARNOLD M, SOERJOMATARAM I, FERLAY J, et al. Global incidence of oesophageal cancer by histological subtype in 2012[J]. Gut,2015, 64(3): 381-387.
[3] 毛友生,赫捷,程贵余.我国食管癌外科治疗的现状与未来对策[J].中华肿瘤杂志,2010, 32(6):401-404.
[4] WU C,ZHU Y, JIANG J, et al. Immunohistochemical localization of programmed death-1 ligand-1 (PD-L1) in gastric carcinoma and its clinical significance[J]. Acta Histochem,2006,108(1): 19-24.
[5] 吴圣. PD-1和PD-L1在胃癌组织中的表达及其临床意义[D].安徽:安徽医科大学,2015.
[6] CHEN K,CHENG G,ZHANG F,et al. Prognostic significance of programmed death-1 and programmed death-ligand 1 expression in patients with esophageal squamous cell carcinoma [J]. Oncotarget,2016,7(21 ):30772-30780.
