高温对大鼠组织CS、OGDH含量和下丘脑线粒体数量的影响
2018-05-21姚凤云张大玲王炳志刘春花翁美芝左铮云
姚凤云,张大玲,王炳志,刘春花,翁美芝,左铮云
(江西中医药大学基础医学院,江西南昌 330004)
高温作业是当前从事农业、建筑业、环卫、炼油、交通、冶炼、炼焦、石油地质勘探等众多行业群体不可回避的现实问题[1-2]。高温已成为职业病的主要危害因素之一[3-4]。如何预防或降低高温环境对高温作业者的损害,成为各国领导人、管理者、科学家以及广大劳动者共同关注的突出问题。本文主要从能量代谢角度探讨高温环境对正常大鼠和中枢神经麻醉大鼠相关指标的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 试验用SPF级SD雄性大鼠,体重280 g~300 g,购自湖南斯莱克景达实验动物有限公司,许可证号SCXK(湘)2013-0004。
1.1.2 主要试剂与仪器 葡萄糖(GLU)、总胆固醇(TC)、甘油三酯(TG),安徽伊普诺康生物技术股份有限公司产品,批号分别为20160607、20160604和20160509;柠檬酸合成酶(citrate synthase,CS)、酮戊二酸脱氢酶(oxoglutarate dehydrogenase,OGDH)试剂盒,武汉优尔生科技股份有限公司产品,批号分别为L161125087、L161125095;ULTRACUT UCT超薄切片机,德国莱卡公司产品;TECNAI SPIRIT透射电子显微镜,美国FEI公司产品;RXZ 智能型人工气候箱,宁波江南仪器公司产品;AU480 型全自动生化分析仪,美国贝克曼库尔特有限公司产品;Tissuelyser-24 多样品组织研磨机,上海净信科技产品;BT25S 电子分析天平,德国赛多利斯产品;Chromate 4300酶标仪,美国Awareness公司产品。
1.2 方法
1.2.1 动物分组 大鼠常温饲养1周后,按体重随机分为4组,即常温正常对照组(常对组)、高温正常对照组(高对组)、常温中枢麻醉组(常麻组)、高温中枢麻醉组(高麻组),每组10只。
1.2.2 饲养环境 动物分组后,常对组和常麻组放于常温(23℃~25℃)下饲养,高对组与高麻组放置人工气候箱中饲养,仪器条件设置:白天温度为32℃,湿度为55%;夜晚温度为30℃,湿度为66%;昼夜交替光照,24 h为一个循环。
1.2.3 检测方法 饲养期间,让大鼠自由饮水和进食,均普通饲料喂养,并记录每只大鼠日平均摄食量,每3 d称取大鼠体重1次。连续饲养30 d后,常麻组与高麻组先用戊巴比妥钠(30 mg/kg)腹腔麻醉,2 h后再用氨基甲酸乙酯(1 g/kg)腹腔麻醉,其他各组均用氨基甲酸乙酯(1 g/kg)腹腔麻醉,仰卧固定,打开腹腔,自腹主动脉采血8 mL~10 mL,室温静置30 min,放置于低温离心机,4℃、6 500 r/min离心10 min,分离血清检测TC、TG、FGB含量。迅速剥离肝脏、腓肠肌,PBS缓冲液洗净残留血液,分别剪取相同部位组织0.1 g左右,精细称重,加9倍体积预冷的PBS缓冲液,置预冷的全自动组织研磨仪内,以频率60Hz匀浆1.5 min,制成浓度为10%的组织匀浆液,4℃、6 500 r/min离心10 min,分离上清液,按照ELISA试剂盒说明书检测CS、OGDH含量。快速沿背侧正中线开颅,仔细翻开取出整个脑组织用PBS缓冲液洗净,并迅速切取下丘脑,下丘脑取材后将组织置于25 g/L戊二醛溶液固定,用透射电子显微镜检测线粒体数量。动物处理前禁食但不禁水14 h。
2 结果
2.1 对大鼠体质量的影响
由表1结果示,试验前各组体重无差异。饲养30 d后,与常对组比较,高对组和高麻组的体重极显著下降(P<0.01)。与常麻组比较,高对组和高麻组的体重也极显著下降(P<0.01)。
2.2 对大鼠血清TC、TG、FBG的影响
由表2结果示,与常对组比较,常麻组和高麻组血清TC的含量均显著下降(P<0.05,P<0.01);高对组和高麻组血清TG的含量均显著升高(P<0.05,P<0.01)。与常麻组比较,各组血清TC的含量均无显著差异(P>0.05);高对组和高麻组血清TG的含量均显著升高(P<0.05)。与常对组比较和常麻组比较,各组血清FBG含量都无显著差异(P>0.05)。
2.3 对大鼠腓肠肌、肝组织CS的影响
由3表结果示,与常对组比较,常麻组和高麻组腓肠肌CS的含量均显著升高(P<0.05,P<0.01);高对组和常麻组肝组织CS的含量均显著下降(P<0.05,P<0.01)。与常麻组比较,高对组腓肠肌CS的含量显著下降(P<0.05),其余都无显著差异(P>0.05);高麻组肝组织CS的含量极显著升高(P<0.01),其余都无显著差异(P>0.05)。
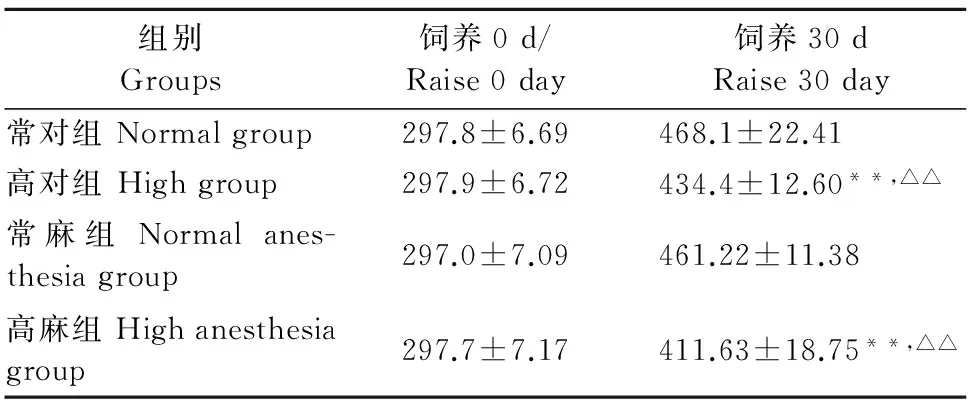
表1 高温对大鼠体质量的影响
注:与常对组比较,*P<0.05,**P<0.01;与常麻组比较,△P<0.05,△△P<0.01。
Note:Compared with the normal group,*P<0.05,**P<0.01;Compared with the normal anesthesia group,△P<0.05,△△P<0.01.
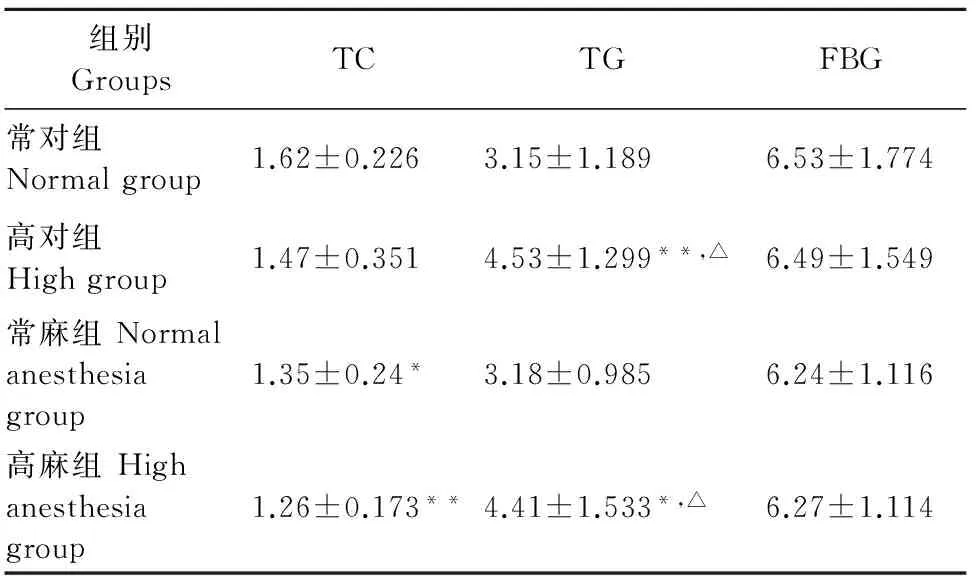
表2 高温对大鼠血清TC、TG、FBG的影响
注:与常对组比较,*P<0.05,**P<0.01;与常麻组比较,△P<0.05,△△P<0.01。
Note:Compared with the normal group,*P<0.05,**P<0.01;Compared with the normal anesthesia group,△P<0.05,△△P<0.01.
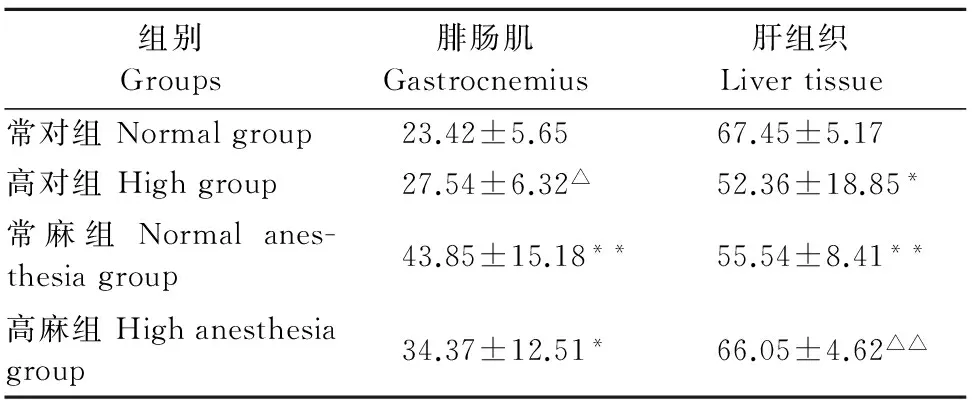
表3 高温对大鼠腓肠肌、肝组织CS的影响
注:与常对组比较,*P<0.05,**P<0.01;与常麻组比较,△P<0.05,△△P<0.01。
Note:Compared with the normal group,*P<0.05,**P<0.01;Compared with the normal anesthesia group,△P<0.05,△△P<0.01.
2.4 对大鼠腓肠肌、肝组织OGDH的影响
由表4结果示,与常对组比较,高对组和高麻组腓肠肌OGDH的含量均显著升高(P<0.05);高对组和高麻组肝组织OGDH的含量均显著下降(P<0.05,P<0.01)。与常麻组比较,各组腓肠肌OGDH的含量都无显著差异(P>0.05);高对组和高麻组肝组织OGDH的含量均显著下降(P<0.05,P<0.01)。

表4 高温对大鼠腓肠肌、肝组织OGDH的影响
注:与常对组比较,*P<0.05,**P<0.01;与常麻组比较,△P<0.05,△△P<0.01。
Note:Compared with the normal group,*P<0.05,**P<0.01;Compared with the normal anesthesia group,△P<0.05,△△P<0.01.
2.5 对大鼠下丘脑线粒体数量影响
由表5和图1结果示,与常对组比较,常麻组和高麻组下丘脑线粒体数量均极显著升高(P<0.01)。与常麻组比较,高对组下丘脑线粒体数量极显著下降(P<0.01)。

表5 高温对大鼠下丘脑线粒体数量影响
注:与常对组比较,*P<0.05,**P<0.01;与常麻组比较,△P<0.05,△△P<0.01。
Note:Compared with the normal group,*P<0.05,**P<0.01;Compared with the normal anesthesia group,△P<0.05,△△P<0.01.
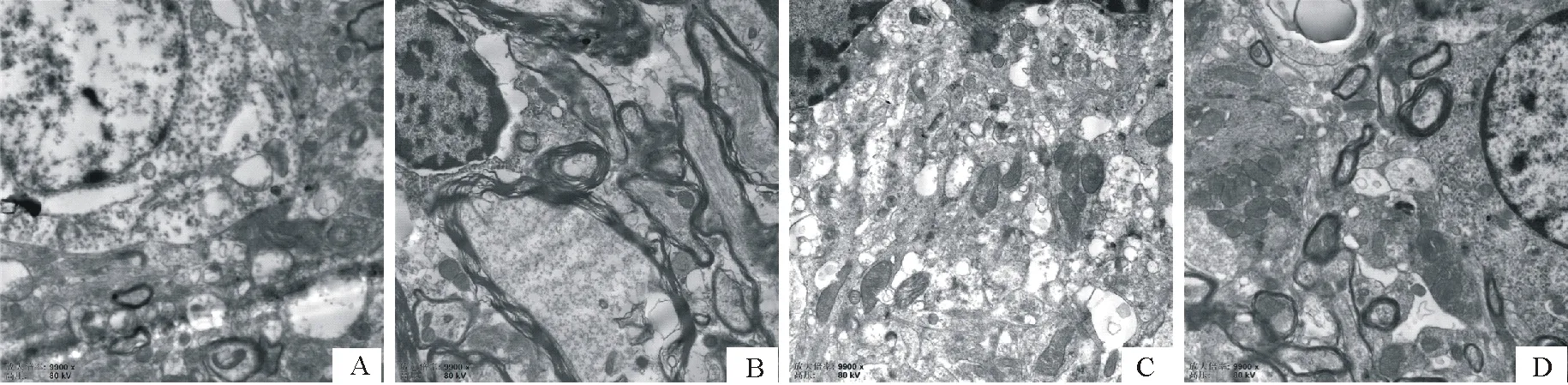
A.常对组;B.高对组;C.常麻组;D.高麻组A.Normal group; B.High group; C.Normal anesthesia group; D.High anesthesia group
3 讨论
环境温度是影响能量代谢的主要因素之一。当环境温度升为30℃~45℃时,代谢率相应增加,这是由于体内化学反应速度加快,发汗功能旺盛及循环、呼吸功能增强的缘故[5]。CS是三羧酸循环(tricarboxylic acid cycle,TCA)循环入口的关键酶,催化乙酰辅酶A与草酰乙酸缩合生成柠檬酸和辅酶A,该反应具有高度的立体专一性[6]。同时OGDH在TCA中作为物质代谢速率的重要调节点,组织中OGDH含量的高低将直接影响到有氧氧化和能量代谢的速度和效率[7]。TCA循环是需氧生物体内普遍存在的代谢途径,在线粒体中进行。是三大营养素(糖类、脂类、氨基酸)的最终代谢通路,又是糖类、脂类、氨基酸代谢联系的枢纽。本研究结果表明,高温可使大鼠体重、血清TC、肝组织OGDH含量显著降低,使血清TG、腓肠肌OGDH、CS含量显著增加(P<0.05,P<0.01),中枢神经麻醉对以上结果均有一定的协同作用。而对于大鼠肝组织CS结果,高温和中枢神经麻醉均可使大鼠肝组织CS含量显著降低,而高温环境下麻醉大鼠组织CS含量又与正常组大鼠无差异,此结果有待进一步探讨。
线粒体是真核生物重要的细胞器,不仅通过氧化磷酸化为细胞生长发育提供能量,并且能为人体提供95%以上的能量,是人体生命活力的重要体现者,同时也参与了细胞钙离子稳态、活性氧水平、凋亡及信号传导的调控[8-10]。同时,大量研究表明线粒体的数量、分布、结构与功能变化等与神经退行性病变、代谢型疾病、心血管疾病及癌症等病症关系密切[11-15],并且通过摄取促进线粒体活性的化合物改善卵母细胞线粒体功能和预防线粒体疾病都具有临床益处[16]。整个中枢神经系统中存在着调节体温的中枢结构,试验证明,下丘脑被认为是体温调节中枢整合机构的中心部位[5]。本研究结果显示,中枢神经麻醉可显著增加大鼠下丘脑线粒体数量,高温环境对其增加有一定协同作用。
参考文献:
[1] 朱 慧,张 超,唐仕川,等.高温环境下不同体力劳动强度对心血管负荷指数影响研究[J].中国安全生产科学技术,2015,11(9):70-76.
[2] 黄鲁众,杨腾飞,黄晶晶,等.高温作业对工人心电图影响的Meta分析[J].中国循证医学杂志,2011,11(2):174-180.
[3] 侯书强.探讨高温作业对高血压病的影响[J].疾病监测与控制杂志,2017,11(5):395-396.
[4] 樊树利.高温作业人员心电图检查研究[J].中西医结合心血管病杂志,2017,5(8):63.
[5] 樊小力.生理学[M].北京:人民卫生出版社,2005:165-172.
[6] 葛亚东,潘 蔚,汪 劼,等.柠檬酸合酶的分子生物学研究进展[J].生物学杂志,2010,27(3):59-62.
[7] 查锡良.生物化学[M].北京:人民卫生出版社,2008:90-100.
[8] 贾振伟.线粒体与多潜能干细胞功能[J].遗传,2016,38(7):603-611.
[9] Lees J G,Rathjen J,Sheedy J R,et al.Distinct profiles of human embryonic stem cell metabolism and mitochondria identified by oxygen[J].Reproduction,2015,150(4):367-382.
[10] 姚凤云,彭淑红,左铮云,等.桂枝甘草汤对低温环境大鼠心肌PGC1α、CS、α-KGDHC 含量的影响[J].时珍国医国药,2015,26(2):263-264.
[11] 李杨洁,吕子奇,刘 敏,等.线粒体荧光探针研究新进展[J].有机化学,2016,36(5):962-975.
[12] Mohammed A,Musthafa M E,Ghazi D,et al.Mitochondrial dysfunction and cell death in neurodegenerative diseases through nitroxidative stress[J].Brain Res,2016,1637:34-55.
[13] Bhatti J S, Bhatti G K, Reddy PH.Mitochondrial dysfunction and oxidative stress in metabolic disorders-A step towards mitochondria based therapeutic strategies[J].Biochim Biophys Acta,2017,1863(5):1066-1077.
[14] 陶 婷,张 荣.线粒体融合蛋白2在心血管疾病方面的研究现状[J].中国临床药理学杂志,2017,33(7):668-672.
[15] 王 戡,张亚军.线粒体与癌细胞的代谢[J].中国医药生物技术,2017,12(1):72-75.
[16] Babayev E,Seli E.Oocyte mitochondrial function and reproduction[J].Curr Opin Obstet Gynecol,2015,27(3):175-181.
