猪9型链球菌的分离鉴定及其生物学特性研究
2018-05-21张振江杜毅超任鹏飞陆晨阳霍孔林唐海波刘金凤吴健敏
张振江,杜毅超,任鹏飞,陆晨阳,霍孔林,唐海波,刘金凤,吴健敏*
(1.广西大学动物科学技术学院,广西南宁 530004;2.广西兽医研究所,广西南宁 530001)
链球菌(Streptococcus)可感染人、猪、牛、羊等,是一种重要的人畜共患病病原体,其主要传播方式为经口或呼吸道传播,也可垂直传播。猪链球菌(Streptococcussuis)是一种革兰阳性菌,对任何品种、年龄及性别的猪均易感[1],可引起脑膜炎、关节炎、多发性浆膜炎、败血症、肺炎和猝死等[2]。目前,链球菌有35种血清型,其中1、2、7、9型是猪的主要致病菌,以2型流行最广,致病性最强,其次为7型和9型。致病性猪链球菌主要的毒力因子有荚膜多糖(capsular polysaeeharide,CPS)、溶菌酶释放蛋白(muramidase-released protein,MRP)、胞外蛋白因子( extracellular protein factor,EF)、溶血素(suilysin,Sly)、谷氨酸脱氢酶(glutamic acid dehydrogenase,GDH)、纤连蛋白/血纤蛋白原结合蛋白( fibronectin-and fibrinogen-binding protein,FBPS)和毒力相关基因(orf2)等,我国目前流行的2型强毒株是同时具有上述7种毒力基因的高致病性菌株[2]。
2016年10月初,广西玉林某猪场保育猪突然采食下降或废绝,精神萎靡,随后10多头猪死亡,大部分为中等膘情猪。为确诊疫情,本实验室对送检死猪进行剖检,然后进行细菌分离鉴定、药敏试验及致病性、毒力因子、耐药性检测。
1 材料与方法
1.1 材料
1.1.1 样品来源 广西玉林市某猪场45日龄病死仔猪的病料。
1.1.2 主要试剂 普通营养肉汤,北京陆桥技术股份有限公司产品;细菌微量生化管、药敏纸片,杭州微生物试剂有限公司产品;电泳凝胶回收试剂盒,北京康为世纪公司产品;DNA Ladder Marker、PCR Mix,TaKaRa公司产品;血琼脂培养基(50 mL/L山羊血),广西兽医研究所按常规方法配制;其他常规试剂均为分析纯。
1.1.3 实验动物 昆明小鼠16只,体重20 g±2 g,购于广西医科大学实验动物中心。
1.2 方法
1.2.1 细菌分离与纯化 病死猪剖检特征为脑膜充血和出血,关节肿胀并有积液,脾肿大呈深红色和边缘出现褐色梗死区域。无菌取病猪的心、脑、脾脏制成匀浆,与关节液一起分别划线接种血琼脂平板和普通营养琼脂平板,37℃培养24 h后,观察菌落颜色和形态特征,并挑取形态特征一致的优势菌落进行革兰染色、镜检及纯化,并将菌种接种于营养肉汤中备用。
1.2.2 生化试验 将分离纯化的菌株接种于山梨醇、水杨素、β半乳糖苷、马尿酸盐、七叶苷、甘露醇、松三糖、乳糖、核糖、甘露糖、棉籽糖、山露醇、阿拉伯糖、精氨酸双水解酶和精氨酸脱羟酶等细菌生化反应管,按说明书进行操作,依据伯杰细菌鉴定手册对各生理生化反应结果进行判定[3]。
1.2.3 16 S rDNA序列测定及分析 按常规方法提取菌株的基因组DNA并作为模板,参照文献[4]合成16 S rDNA基因通用引物进行PCR扩增。引物序列为:PF:5′-AGAGTTTGATCATGGCTCAG-3′;PR:5′-GTGTGACGGGCGGTGTGTAC-3′;回收PCR产物送上海生工生物工程技术服务有限公司测序。测序结果用BLAST进行同源性比对,选取同源性较高的部分菌株16 S rDNA参考序列(表1),用MEGA 6.0软件中Neighbor-Joing(NJ)法构建系统发育树,进行遗传进化分析。
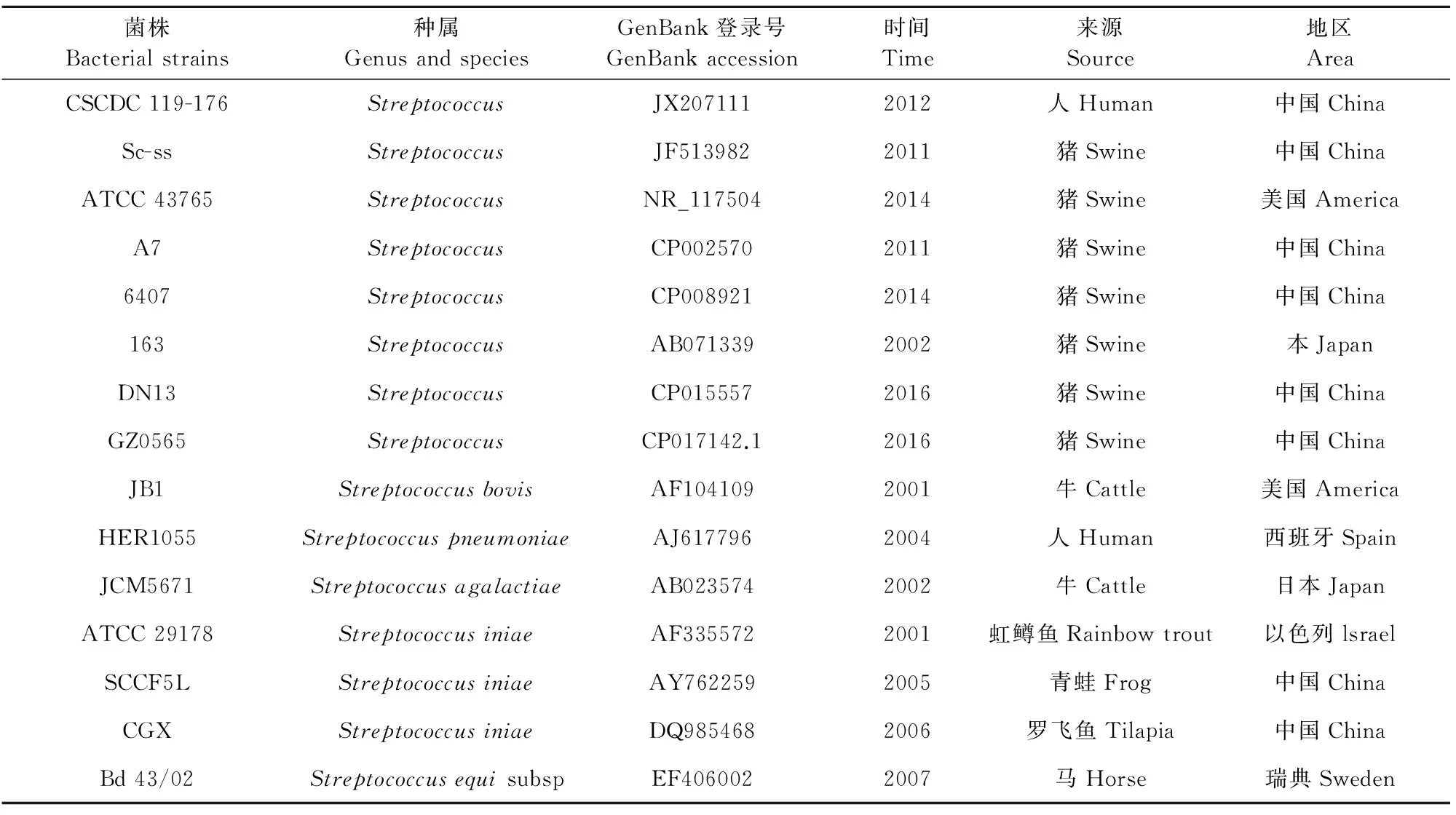
表1 参考序列
1.2.4 PCR分型检测 用已提取的基因组DNA为模板,参照文献[5-6]根据猪链球菌不同血清型菌株荚膜多糖cps基因的特异性设计引物,用于猪链球菌1、2、7、9型的鉴定(表2)。PCR反应体系为25 μL,分别为PCR Mix 12.5 μL、ddH2O 9.5 μL、引物各0.5 μL、模板DNA 2 μL,各种引物的退火温度参照表2,退火时间为45 s。PCR反应结束后,进行电泳并记录结果。

表2 猪链球菌鉴定所用引物
1.2.5 药敏试验及耐药基因检测 药敏试验根据美国临床实验室标准化协会(Clinical and Laboratory Standards lnstitute,CLSI)所推荐的Kirly-Baue纸片扩散法[7-10]进行,判定分离菌株对药物的敏感性。
耐药基因检测参照文献[4]用PCR进行,检测头孢菌素类、大环内脂类、青霉素类、氨基糖苷类、氯霉素类、喹诺酮类、四环素类及磺胺类药物耐药基因的共8大类18种耐药基因的存在情况。
1.2.6 毒力因子的测定 参照文献[2,11]选择猪链球菌的主要毒力因子溶菌酶释放蛋白(MRP)、胞外蛋白因子(EF)、谷氨酸脱氢酶(GDH)、荚膜多糖基因(cps)、纤连蛋白/血纤蛋白原结合蛋白(FBPS)、溶血素(Sly)及毒力相关序列(orf2)设计引物(表3),进行PCR检测。反应体系为25 μL,包括PCR Mix 12.5 μL、ddH2O 9.5 μL、引物各0.5 μL、模板DNA 2 μL,各种引物的退火温度参照表3。PCR反应结束后,进行电泳并记录结果。
1.2.7 小鼠致病性试验 将分离菌株接种普通营养肉汤,37℃恒温箱培养24 h后,进行细菌计数。然后将16只昆明小鼠随机分为4组,每组4只,1组~3组分别通过腹腔注射稀释梯度为原液、10-1、10-2的细菌稀释液,0.3 mL/只。第4组每只腹腔注射等量的生理盐水,连续观察1周,观察小鼠发病及死亡情况,分析分离菌株的致病性。

表3 毒力基因引物序列
2 结果
2.1 分离菌的形态特征
将病猪的心、脑、脾脏匀浆和关节液分别划线接种于血琼脂平板和普通营养琼脂平板,经培养在血琼脂平板上生长出针尖大小、灰白透明、表面光滑的圆形菌落。将分离菌纯化后染色、镜检观察为革兰阳性菌,并以多个圆形或卵圆形构成的短链形式存在(图1)。
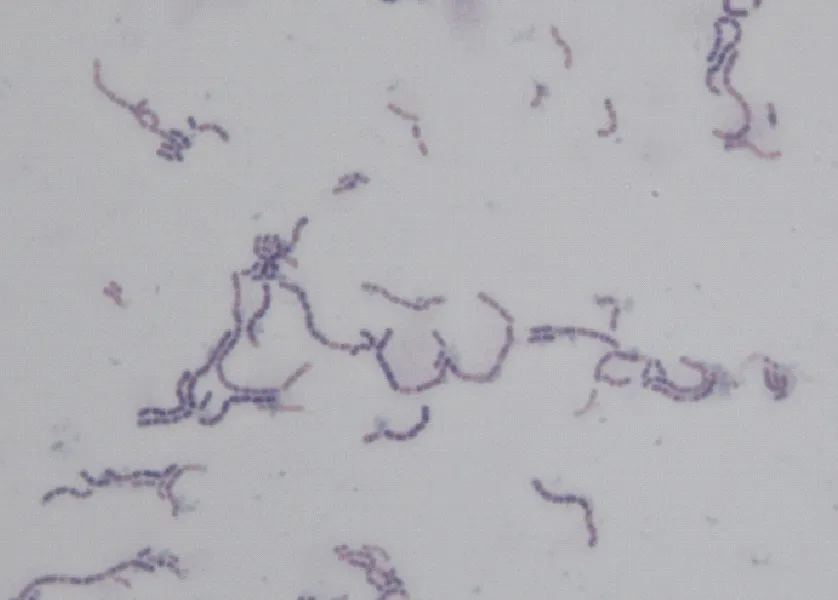
图1 分离菌革兰染色观察 (100×)
2.2 生化特性的鉴定
将纯化后分离菌分别进行生化检测,结果分离菌株糖、醇发酵能力及各种生化鉴定结果均与猪链球菌(Streptococcussuis)生化特性完全一致(表4)。
2.3 16 S rDNA序列鉴定和进化树分析
以分离菌株DNA为模板,采用16 S rDNA通用引物进行PCR扩增,获得大小约1.3 kb片段,经BLAST比对,与猪链球菌序列GZ0565(CP017142)同源性高达99.9%,进一步与GenBank中猪链球菌的16 S rDNA序列进行比对分析,构建系统发育树(图2),结合分离菌株的形态特征及生理生化特性,确定分离株为猪链球菌,并命名为StreptococcussuisYL1689。

表4 分离株的生理生化特征
注:+.阳性;-.阴性。
Note: +.Positive; -.Negative.
2.4 猪链球菌的分型鉴定
以猪链球菌的分型特异引物来进行PCR扩增,结果猪链球菌1、2、7型均未扩出目的条带,但猪链球菌9型扩增出目的条带,表明该分离株为猪链球菌9型(图3)。
2.5 药敏试验和耐药基因的测定
分离菌药敏试验和耐药基因检测结果见表5。由表5可见,YL1689菌株对呋喃妥因、环丙沙星、头孢哌丁等11种药物高度敏感,对头孢西丁、链霉素、万古霉素等3种药物中度敏感,对苯唑西林、氨曲南、卡那霉素、复方新诺明、多黏菌素B、林可霉素等8种药物完全耐药。在8大类18种耐药基因中tetO(四环素类)、aph-(3)-lia(氨基糖苷类)、SulⅢ(磺胺类)、parC(喹诺酮类)检测结果为阳性,药敏试验和耐药基因的检测结果基本符合。
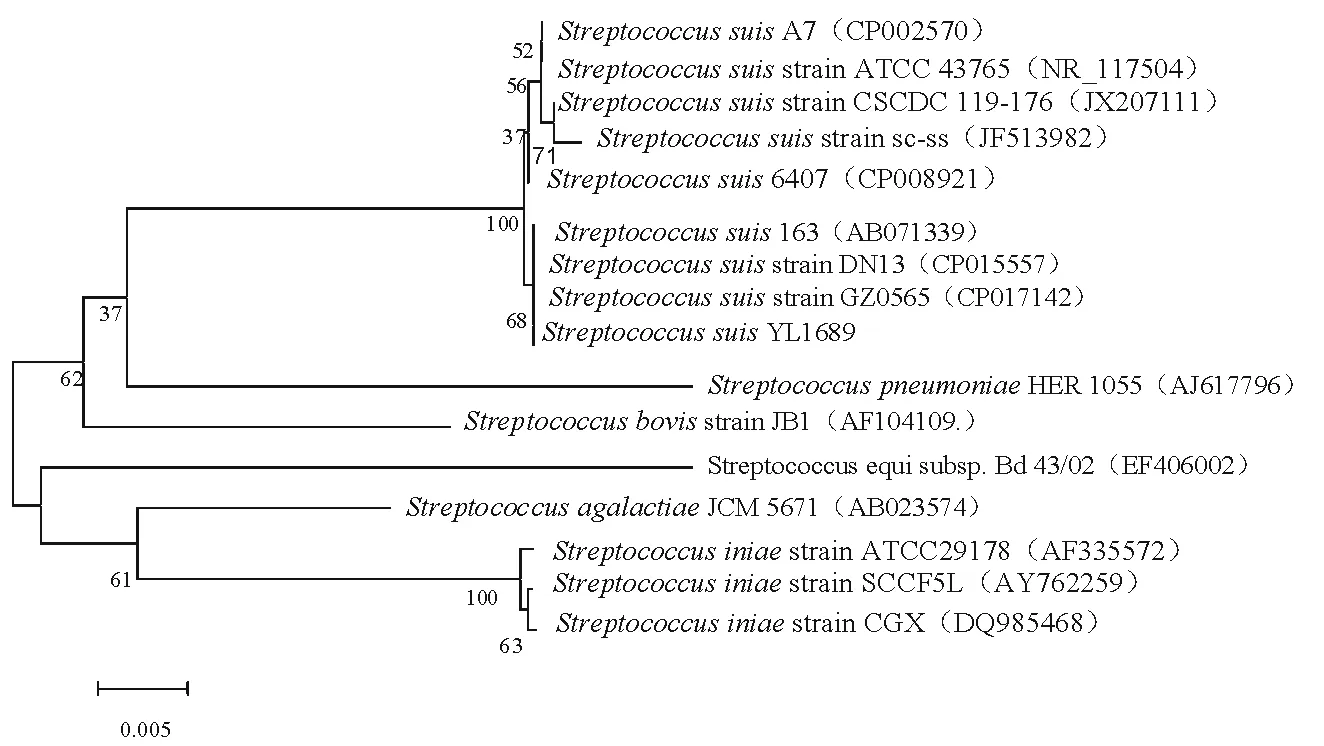
图2 分离菌16 S rDNA基因系统发育树
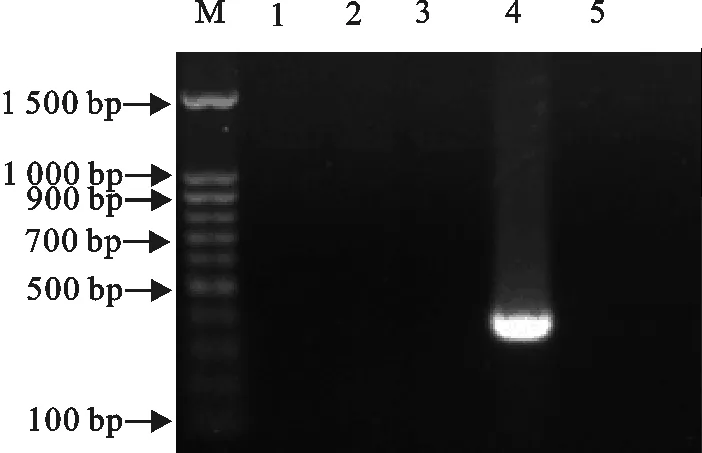
M.DNA 标准DL 1 500;1.1型;2. 2型;3. 7型;4. 9型;5.空白对照
M.DNA Marker DL 1 500;1.Type 1;2.Type 2;3.Type 7;4.Type 9;5.Blank control
图3猪链球菌1、2、7、9型的PCR鉴定
Fig.3 PCR identification ofStreptococcussuistypes 1,2,7,9
2.6 毒力基因的测定结果
以PCR的方法测定YL1689菌株的毒力基因。结果cps9H、orf2、gdh、fdps为阳性,epf、sly、mrp为阴性(图4)。由此可见,YL1689菌株毒力基因表型为cps9H+gdh+fdps+epf-sly-mrp-orf2+。
2.7 小鼠致病性试验
将YL1689菌株接种普通营养肉汤,37℃恒温箱培养24 h 后,细菌计数为2×108CFU/mL,攻毒24 h后小鼠开始发病,表现为精神萎靡,食欲不振,四肢痉挛导致全身颤抖,注射原液的小鼠72 h内全部死亡,其他攻毒组7 d后逐渐恢复精神状态,又持续观察数天未见死亡,对照组7 d内未见异常。将死亡小鼠剖检,发现其脾脏、肾脏、肝脏出血肿大,胸腔及脑有积液,无菌接种于50 mL/L羊血琼脂培养基上,形态特征一致,PCR检测鉴定为猪链球菌。
3 讨论
本试验从患病猪体内分离到1株病原菌,经形态学观察和生理生化鉴定确定该菌株为链球菌科、链球菌属。16 S rDNA测序及BLAST比对结果显示,该病原菌为猪链球菌。通过PCR对荚膜多糖(cps)基因的检测证明该菌株为猪链球菌9型。在小鼠致病性试验中,参照Wei Z G等[12]的方法进行毒力判定,结果注射5×108CFU/只剂量组,半数(含)以上死亡的判为强毒(HV);注射3×109CFU/只剂量组,半数(含)以上死亡的,5×108CFU/只剂量组,半数(不含)以上未死亡的,判为中等毒力(MV);3×109CFU/只剂量组,半数(不含)以上未死亡的,判为低毒力(LV)。本试验以2×108CFU/mL,0.3 mL/只(实际注射量为6×107CFU/只)对小鼠进行腹腔注射,就可以致小鼠100%死亡,据此可以判定本试验分离的猪链球菌为强毒株。因此,可以诊断此次疫情是猪群感染了猪链球菌血清9型强毒株引起的。
从药敏试验及耐药基因检测结果来看,本试验分离的猪链球菌对苯唑西林、氨曲南、复方新诺明、林可霉素、米诺环素、多黏菌素B等药物完全耐药,对头孢西丁、链霉素、万古霉素等3种药物中度敏感。在耐药基因测定时也检出存在tetO(四环素类)、aph-(3)-lia(氨基糖苷类)、SulⅢ(磺胺类)耐药基因,与该菌株的耐药谱基本一致。由于该菌株对苯唑西林完全耐药,对万古霉素敏感性降低与人医临床上的耐甲氧西林金黄色葡萄球菌(MRSA)类似,常表现为多重耐药应引起高度重视。相关的报道也显示近年来血清9型猪链球菌在国内的分离率也呈上升趋势[11],而本试验发现一株具多重耐药的9型链球菌菌株,因此加强对9型猪链球菌及其耐药性的监测十分必要。

表5 分离株的药敏试验及耐药基因检测结果
注:S.高敏(d>15 mm); I.中敏(10 mm≤d≤15 mm); R.低敏或不敏感(0 mm≤d<10 mm); +阳性; -.阴性。
Note: S.High sensitivity(d>15 mm);I.Moderate sensitivity(10 mm≤d≤15 mm); R.Low or no sensitivity(0 mm≤d<10 mm);+.Positive;-.Negative.
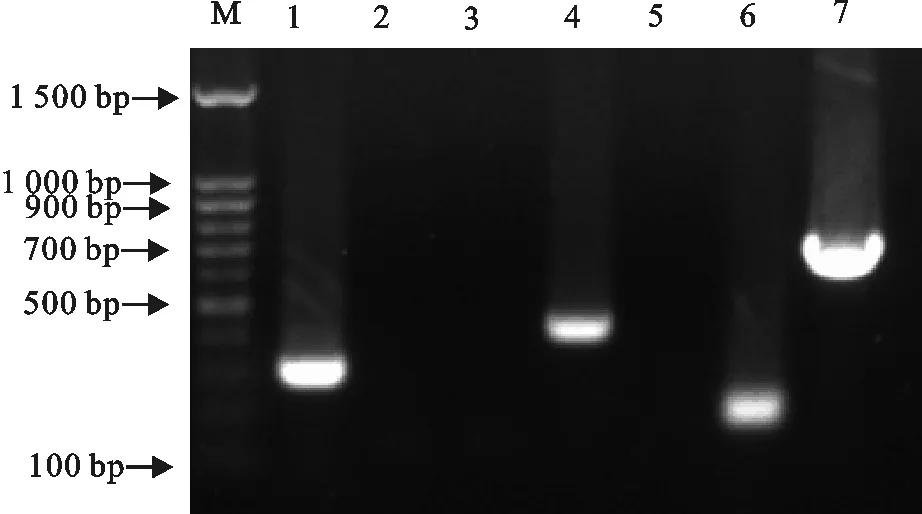
M.DNA 标准DL 1 500;1.cps9h;2.epf;3.siy;4.orf2;5.mrp;6.gdh;7.fdps
M.DNA Marker DL 1 500;1.cps9h;2.epf;3.siy;4.orf2;5.mrp;6.gdh;7.fdps
图4分离菌株毒力基因检测结果
Fig.4 Detection of virulence genes in isolated strains
相关研究表明,猪链球菌的主要毒力因子有7种,在致病性菌株中毒力基因mrp和epf有很高的检测率,而非致病菌株中检出率极少,作为判断致病性的指标之一[13-14],欧美等国家认为致病性最强的基因型为cps+epf+mrp+sly+。修福晓[15]在研究猪链球菌9型毒力基因时发现7株国内分离株均具有cps9H、gdh、fdps,缺失sly、epf,而由猪脑脊髓液分离株orf2为阳性,其他健康猪扁桃体分离株缺失orf2。本试验分离株YL1689毒力基因为cps9H+gdh+fdps+epf-sly-mrp-orf2+,与所报道的猪脑脊髓液分离株毒力基因型基本相同。本分离株虽然缺失致病性最强的epf、mrp、sly毒力基因,但在小鼠致病性试验中亦表现很强的致病力,且该菌株还能引起猪的脑膜炎,因此对猪链球菌9型致病机理的研究仍需进一步加强。
参考文献:
[1] 刘 金.猪树突状细胞在猪链球菌2型感染致炎症风暴中的作用研究[D].湖北武汉:华中农业大学,2015.
[2] Staats J J,Feder I,Okwumabua O,et al.Streptococcussuis:Past and present[J].Vet Res Commun,1997,21(6):381-407.
[3] 布坎南R E,吉本斯N E.伯杰细菌鉴定手册[M].8版.北京:科学出版社,1984:483-486.
[4] 谢 彬,袁 洁,袁书智,等.猪源绿色气球菌的分离鉴定与药敏特性研究[J].中国微生态学杂志,2010,22(3):238-243.
[5] Smith H E,Veenbergen V,Velde J V D,et al.The cps genes ofStreptococcussuisserotypes 1,2,and 9:Development of rapid serotype-specific PCR assays[J].J Clin Microbiol,1999,37(10):3146-3152.
[6] Smith H E,Van B L,Buijs H,et al.Rapid PCR test forStreptococcussuisserotype 7[J].Fems Microbiol Let,1999,178(2):265-270.
[7] 许宏涛,张秀珍.2004年美国临床实验室标准化委员会药敏试验判断标准[J].中国临床药理学杂志,2005(7):318-320.
[8] Andrews J M.BSAC working party on susceptibility testing ft.BSAC standardized disc susceptibility testing method[J].J Antimicr Chemoth,2001,48(S1):43-57.
[9] 张彩芳,张爱君.纸片扩散法药敏试验条件的选择[J].宁夏医学杂志,2006,28(12):946-947.
[10] 管远志,王艾琳,李 坚.医学微生物学实验技术[M].北京:化学工业出版社,2008:115-117.
[11] 祝昊丹.猪链球菌9型毒力基因的筛选及鉴定[D].江苏南京:南京农业大学,2011.
[12] Wei Z G,Li R,Zhang A D,et al.Characterization ofStreptococcussuisisolates from the diseased pigs in China between 2003 and 2007[J].Vet Microbiol,2009,137(1-2):196-201.
[13] 欧 瑜,陆承平.猪链球菌2型国内分离株毒力相关蛋白的分析[J].微生物学报,2002,42(1):105-109.
[14] Vecht U,Wisselink H J,Jellema M L,et al.Identification of two proteins associated with virulence ofStreptococcussuistype 2.[J].Infect Immun,1991,59(9):3156-3162.
[15] 修福晓.猪链球菌9型国内分离株的毒力特性分析[D].江苏南京:南京农业大,2008.
