HR-ICP-MS定磷法在定量检测DNA分子中的应用
2018-05-21李春华
李 妍, 李春华, 梁 文, 许 丽, 刘 刚
(上海市计量测试技术研究院 化学与电离辐射所, 上海 201203)
0 引 言
与传统化学样品相比,目前基因检测的量值溯源水平有待提高,可溯源的DNA准确定量方法非常缺乏,无法满足相关检测过程中工作标准赋值、方法验证、质量控制等的需求,影响了相关分析仪器的计量校准规程的建立。常用的定量DNA方法主要有紫外分光光度法(UV)、荧光染料法、qPCR(Quantitative PCR)、dPCR(Digital PCR),前两种方法在灵敏度和稳定性方面还有待提高[1];后两种方法存在假阳性的风险较大,而且对于以上DNA定量方法,量值溯源性问题仍然是很大挑战。
随着元素分析方法的发展,定磷法成为一种可行的DNA定量检测方法,由于对于特定的DNA分子来说,其磷含量是一个固定参数,通过检测DNA分子中的磷含量,就可以计算DNA分子的含量,该方法的灵敏度较高,可以溯源到国际单位,而且检测成本较低。电感耦合等离子体发射光谱技术(ICP-OES)是一种溯源清晰的DNA定量方法[2], 韩国标准与科学研究院(KRISS)及美国标准与技术研究院(NIST)[3]等, 将该方法用于基因组核酸[4]、质粒DNA[5-7]和寡聚核酸[8-9]等核酸纯品物质的定量测量。中国计量科学研究院也在核酸ICP-OES 定量分析方面做了大量的尝试[10]。高分辨电感耦合等离子体质谱(HR-ICP-MS)定量的质量数能精确到0.000 1,其对痕量和超痕量元素良好的检测能力以及谱图的简单易识,使其成为分析痕量和超痕量元素的常规方法[11-14]。
本文研究HR-ICP-MS定量检测DNA中磷含量从而定量DNA的方法,考察纯化和微波消解等样品前处理步骤,考察生物实验中常用的TE溶液对该方法的影响,对标准曲线的配制进行优化,保证检测结果量值可溯源,且提高该方法与其它DNA定量方法的可比性。本方法具有良好的最低检出限和精密度,可以应用于较低浓度质粒DNA标准物质的定值,符合相关技术文件要求[15-16],有助于提高基因检测领域的量值溯源水平,保证相关检测项目的结果准确可靠。
1 材料与方法
1.1 试剂及仪器
试剂:高纯度硝酸(HNO3,10 mg/L,日本多摩化学),磷酸二氢铵标准物质(GBW06502,中国计量科学研究院),钇标准物质(GBW08657,中国计量科学研究院),HR-ICP-MS测试试验所用试剂均为分析纯以上,实验用水经超纯水系统制备,所用器皿均经30%的硝酸浸泡,超纯水清洗。Tris(生工生物公司),EDTA(生工生物公司),优级纯盐酸(国药集团化学试剂有限公司),脱氧核糖核酸酶I(宝生物公司),异丙醇(国药集团化学试剂有限公司),无水乙醇(国药集团化学试剂有限公司),质粒提取试剂盒(OMEGA)、质粒纯化试剂盒(德国MN公司),NIST P标准物质(SRM3139a),小牛胸腺DNA含量标准物质(中国计量院 GBW09801),鲑鱼精DNA成分标准物质(中国计量院BW2701-1),转基因大豆质粒DNA标准物质(上海计量院GBW(E)100274)。
仪器:Element2 高分辨电感耦合等离子发射光谱仪(美国Thermo公司),MARS 微波消解仪(MILESTONE微波消解仪公司),Millipore Q 超纯水系统(美国Millipore 公司),分析天平(瑞士梅特勒公司),eppendorf高速冷冻离心机(德国eppendorf 公司), nanodrop2000紫外分光光度计(美国Thermo公司),电泳仪和电泳槽(美国伯乐公司),凝胶成像分析系统(美国伯乐公司),冷藏冰箱(海尔公司),冷冻冰箱(海尔公司),超低温冷冻冰箱(美国Thermo公司),立式压力蒸汽灭菌器(上海申安医疗器械厂),恒温混匀仪(德国eppendorf 公司),涡旋振荡器(德国IKA公司),pH计(上海精科公司),移液枪(德国eppendorf公司)。
1.2 实验方法
1.2.1TE溶液的配制
1 mol/L Tris-HCl(pH7.4):称量121.1 g Tris置于1 L烧杯中,加入800 mL去离子水,充分搅拌溶解,调节pH值,定容至1 L,高温高压灭菌后,室温保存。
10×TE Buffer (pH7.4):量取100 mL 1 mol/L Tris-HCl Buffer(pH7.4),20 mL 500 mmol/L EDTA(pH8.0)置于1 L烧杯中,加入800 mL去离子水,混合均匀,定容至1 L,高温高压灭菌后,室温保存。
1.2.2琼脂糖凝胶电泳鉴定DNA纯度
吸取2 μL质粒pXL02于1.5 mL EP管中,加入1 μL EcoRI核酸内切酶, 2 μL酶解缓冲液和15 μL无菌水,置于37 ℃水浴酶解2 h。取10 μL酶切液上样0.8%琼脂糖凝胶,电泳条件为电压80~100 V、30 min,电泳后凝胶成像分析DNA条带。
1.2.3样品的微波消解
天平称重空微波消解管质量记为mo,加适量的样品于微波消解管中称重记为mp,再加入适量2%硝酸溶液,微波消解条件为200 ℃,1 500 W,4 h;将消解后的微波消解管称重质量记为mp;根据公式计算样品的稀释倍数
1.2.4计算样品中磷元素的含量
根据基因测序测得DNA样品的碱基数和相对分子质量,计算DNA样品中P元素含量百分比:
wP%=碱基数×磷的原子量÷
DNA相对分子质量×100%
1.2.5HR-ICP-MS定磷法计算模型
根据定磷法原理,建立HR-ICP-MS检测核酸浓度的计算模型:
式中:c为核酸样品浓度;cs为由标准曲线求得样品中P含量;Vs为检测时样品最终体积;V为吸取核酸样品原液的体积;wP%为核酸样品中P元素含量百分比。
将高浓度DNA样品稀释后用HR-ICP-MS检测DNA样品中磷元素的质谱信号丰度,再根据HR-ICP-MS检测核酸浓度的计算模型得出DNA浓度。
1.2.6HR-ICP-MS定磷法和UV法的最低检出限(LOD)
利用小牛胸腺DNA含量标准物质配制标准溶液,P浓度分别为1、2、3、4、5 ng/mL,用HR-ICP-MS对上述5种P标准溶液进行测定,计算标准曲线的斜率k。以DNA储存液TE buffer为空白样品,用HR-ICP-MS连续测量6次超纯水和空白样品的信号,计算标准偏差SD和 SDICP;根据公式计算:HR-ICP-MS定磷法检测磷元素的最低检出限
LODP=3SDICP/k
以wP%的DNA样品为例,换算成HR-ICP-MS定磷法检测DNA的最低检出限
LODDNA=3SDICP/(0.1k)
核酸分子含有嘌呤环和嘧啶环的共轭双键,其紫外可见吸收光谱在260 nm附近有一强的吸收峰,针对双链DNA,样品浓度和吸光值之间有以下关系:
双链DNA浓度=A260×50,其中A260为核酸在260 nm处的吸光值,单位为ng/μL。本项目中用TE buffer做空白样品,用紫外分光光度计测量6次空白样品在260 nm处的吸光值,计算标准偏差SDUV。UV法检测DNA的最低检出限
LODUV=3SDUV×50
1.2.7HR-ICP-MS定磷法的精密度
HR-ICP-MS定磷法测量转基因大豆质粒DNA标准物质,连续测量8次,计算相对标准偏差,考察HR-ICP-MS定磷法的精密度。
2 结果与分析
2.1 样品处理
以人工设计并合成的质粒DNA样品(编号pXL02)为目标,开展HR-ICP-MS定量分析,并考察了前处理条件优化的必要性。质粒DNA样品基因测序得到的基本信息如下:质粒名称pXL02,碱基数4 266 bp,相对分子质量2 593 133 D,磷元素含量(质量分数)10.19%。
(1) DNA样品的纯度。用碱裂解法提取的质粒DNA样品中常混有细菌基因组DNA和RNA杂质,而HR-ICP-MS定磷法根据核酸中的磷定量,不能区分DNA和RNA。因此,保证样品中不含有目标DNA外的核酸杂质,才能进行定磷法检测。
将质粒DNA 样品PXL02用限制性内切酶EcoRI 单酶切消化成线性片段,然后进行琼脂糖凝胶电泳分析。由于质粒DNA 序列上有且仅有一个EcoRI酶切位点,环装质粒DNA经过酶切消化后变成一条线性DNA(分子大小不变,仍为4 266 bp)。从图1中可以看出清晰的DNA条带,没有细菌基因组DNA和RNA、蛋白质等杂质污染,满足琼脂糖凝胶电泳鉴定标准。理论上,高纯度DNA样品的A260/A280检测结果应为1.8~2.0,而A260/A230检测结果应达到2.0;本实验中,经过纯化后的样品pXL02用紫外分光光度计检测,A260/A280=1.9,A260/A230=2.0,满足紫外分光光度法鉴定标准。表明,实验室制备的质粒DNA样品纯度已经足够高,没有RNA污染,因此无需进一步增加纯化步骤。

M-核酸标准片段DL 5 000 Marker; 1-PXL02 经限制性内切酶EcoRI 酶切后的产物
图1 PXL02 电泳分析结果
(2) 微波消解的必要性。由于微波消解是HR-ICP-MS检测样品常用的前处理方法,因此,设计试验考察质粒DNA样品是否需要微波消解的前处理方法及其对检测结果的影响。同样的DNA样品分成两组,一组经过微波消解;另一组不经过微波消解,分别开展HR-ICP-MS检测,数据如表1所示。结果发现,微波消解后的样品HR-ICP-MS检测信号降低9%,标准偏差增加32%。原因可能是低浓度的DNA在长时间的高温微波消解过程中容易吸附在管壁上,导致部分DNA样品损失,使样品间检测结果标准偏差增大。

表1 微波消解质粒样品对HR-ICP-MS影响的统计检验
t-test统计分析微波消解和未微波消解质粒样品浓度的检测结果(表1)t(t-crit,说明两种方法的实验结果不存在显著性差异。因此,微波消解DNA样品的方法会降低质谱信号,并引入更多的质谱检测信号标准偏差,但对检测结果准确度没有实质性影响。
因此,通过考察分析样品的前处理条件,确定HR-ICP-MS定磷法定量DNA样品的前处理过程无需进行微波消解,但需要鉴定样品DNA纯度,保证样品中不含有目标DNA外的核酸杂质。
2.2 工作标准的选择
考虑到DNA样品的生物特殊性,用无机磷做标准曲线可能与实际DNA样品有差异。因此,分别用无机磷标准物质和小牛胸腺DNA含量标准物质配制标准溶液,考察两种标准曲线对HR-ICP-MS检测DNA的影响。根据3次独立试验的标准曲线(见图2)分析,小牛胸腺DNA含量标准物质配制的标准曲线斜率小于无机磷标准物质配制的标准曲线。经过统计分析t-test统计结果见表2,两种标准曲线的斜率存在显著性差异。因此,小牛胸腺DNA含量标准物质配制的标准曲线与无机磷标准物质配制的标准曲线有很大不同。

(a)

图2 无机磷标准物质配制的标准曲线和小牛胸腺DNA含量标准物质配制的标准曲线((a)~(c)分别表示在不同时间进行的3次独立实验,每次实验每种标准曲线做3个重复)表2 无机磷和小牛胸腺DNA含量标准物质配制的标准曲线差异统计分析
为进一步选择适合检测DNA的工作标准,将鲑鱼精DNA成分标准物质作为被测样品。HR-ICP-MS测量样品依据无机磷工作标准曲线计算结果为843.37 mg/L,依据小牛胸腺DNA工作标准曲线计算结果为944.68 mg/L。鲑鱼精DNA标准物质证书上标明其标准值为(968±38) mg/L,k=2。用小牛胸腺DNA工作标准计算得到的HR-ICP-MS测量结果符合标准值,而用无机磷工作标准计算得到的结果与比标准值明显偏低12.9%。分析原因,认为在检测核酸样品时,DNA标准物质比无机磷标准物质与样品具有更好基体一致性,HR-ICP-MS定磷法测量DNA样品时应该选择小牛胸腺DNA含量标准物质配制的标准曲线作为工作标准。
2.3 灵敏度和精密度
利用仪器调试溶液对仪器进行各项参数的调试,仪器的最优化条件为:冷却气流量16.86 L/min,辅助气流量0.99 L/min,雾化气流量1.123 L/min,功率1 350 W。
以小牛胸腺DNA含量标准物质中磷的质量浓度为横坐标(x),质谱信号丰度为纵坐标(y)绘制标准曲线,如图3所示,线性拟合度良好。
用HR-ICP-MS连续测量6次超纯水和空白样品,两者质谱信号值差别很小,说明空白样品中没有干扰HR-ICP-MS检测的元素。其中空白样品的SDICP为35.06 cps。HR-ICP-MS定磷法的磷元素最低检出限LODP为0.032 ng/mL,换算成HR-ICP-MS定磷法检测DNA的最低检出限LODDNA为0.000 32 ng/μL,UV法连续测量6次空白样品的SD为0.002 Abs,检测DNA的最低检出限LODUV为0.3 ng/μL,可见HR-ICP-MS检测DNA的最低检出限优于紫外分光光度法3个数量级。因此,HR-ICP-MS定磷法检测DNA的灵敏度更低,适用于定量低浓度DNA样品。用HR-ICP-MS定磷法8次测量转基因大豆质粒DNA标准物质,测量结果的相对标准偏差为2.15%,证明该方法精密度良好。
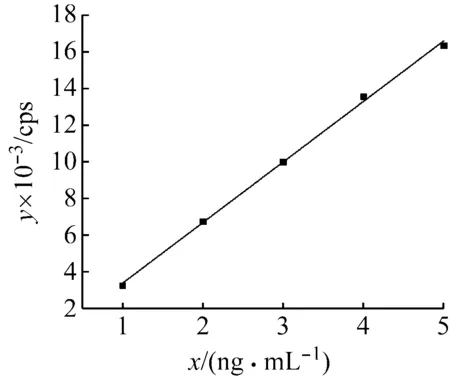
图3 小牛胸腺DNA含量标准物质配制的标准曲线
2.4 HR-ICP-MS定磷法应用于标准物质的定值
在标准物质研制中,将HR-ICP-MS定磷法应用于阪崎肠杆菌检测质粒DNA标准物质的定值。4个阪崎肠杆菌检测质粒DNA标准物质(PXL04、PXL05、PXL06、PXL07)采用UV法和HR-ICP-MS定磷法2种方法定值;HR-ICP-MS检测数据见表3。汇总全部原始数据后经统计检验确认各组数据无离群值、各组数据等精度、每组数据的平均值之间不存在显著性差异后,取检测结果的平均值为各质粒DNA 标准物质的标准值,分别为52.4,61.6,74.4,85.4 ng/μL。因此,HR-ICP-MS定磷法的精确度和灵敏度都能很好的满足质粒DNA标准物质的定值,在今后研究中可以应用于质粒DNA标准物质的定值。

表3 HR-ICP-MS定磷法测量阪崎肠杆菌质粒DNA标准物质
3 结 语
本文通过实验研究,建立了一种HR-ICP-MS定磷法定量检测DNA分子的方法。该方法可作为常规制备DNA稀释后直接定量检测的标准物质定值方法,具有简便快捷、灵敏度高、精密度好等优点,满足DNA实际定量测量的应用需求。该方法重点攻克生物分析量值溯源领域的瓶颈问题,实现DNA分子HR-ICP-MS可溯源定值,推动DNA标准物质的研制工作,为生物检测过程提供量值传递依据。
参考文献(References):
[1] Haynes H M J,Rabb R J, Satija S A J. Factors Affecting Quantification of Total DNA by UV Spectroscopy and PicoGreen Fluorescence [J]. Agr Food Chem, 2009, 57(16): 7221-7226.
[2] English C A, Merson S, Keer J T. Use of Elemental Analysis To Determine Comparative Performance of Established DNA Quantification Methods [J]. Anal Chem, 2006, 78(13): 4630-4633.
[3] O’Connor G, Dawson C, Woolford A,etal. Quantitation of oligonucleotides by phosphodiesterase digestion followed by isotope dilution mass spectrometry: proof of concept [J]. Anal Chem,2002(15), 74:3670-3676.
[4] Little D P, Cornish T J, O’ Donnell M J,etal. MALDI on a chip: analysis of arrays of low-femtomole to subfemtomole quantities of synthetic oligonucleotides and DNA diagnostic products dispensed by a piezoelectric pipet[J]. Anal Chem, 1997, 69(22): 4540-4546.
[5] Zhang L K, Gross M L. Matrix-assisted laser desorption/ionization mass spectrometry methods for oligodeoxynucleotides: Improvements in matrix, detection limits, quantification,and sequencing[J]. Journal of the American Society for Mass Spectrometry, 2000, 11(10): 854-865.
[6] 许 丽. 4 种阪崎肠杆菌检测质粒DNA 标准物质的研制[J]. 实验室研究与探索,2016,35(3): 4-8.
[7] 梁 文. 转基因大豆质粒DNA 标准物质的研制[J]. 实验室研究与探索,2016,35(5): 4-8.
[8] Lowry M, Fakayode S O, Geng M L,etal. Molecular Fluorescence, Phosphorescence, and Chemiluminescence Spectrometry [J]. Anal Chem, 2008, 80(12): 4551-4574.
[9] Oefner P J, Umlauft F, Berti G N,etal. High-Resolution Liquid Chromatography of Fluorescent Dye-Labeled Nucleic Acids[J]. Anal Biochem, 1994, 223(11): 39-46.
[10] Li P, Wang J, Gao Y H. Analysis of Fluorescent Dye-labeled Oligonucleotides by Ion-Pair Reversed-Phase High-Performance Liquid Chromatography [J]. Chin J Anal Chem, 2009, 37(12): 1722-1726.
[11] Hai F L. Study on time function revision of ICP-OES signal drift [J]. China Measurement & Test,2009, 35(2): 11-13.
[12] Liang W, Xu L, Sui Z. W. Quantification of plasmid DNA reference materials for Shiga toxin-producing Escherichia coli based on UV, HR?ICP?MS and digital PCR[J]. Chemistry Central Journal, 2016, 55(10):1-10.
[13] Olga Leclerc. Method development for genomic Legionella pneumophila DNA quantification by inductively coupled plasma mass spectrometry [J]. Analytical Biochemistry ,2013,435: 153-158.
[14] Holden M J, Rabb S A, Tewari Y B,etal. Traceable phosphorus measurements by ICP-OES and HPLC for the quantitation of DNA[J]. Anal Chem,2007, 79(3):1536-1541.
[15] JJF 1343-2012. 标准物质定值的通用原则及统计学原理[S]. 2012.
[16] ISO Guide 35. Reference materials-General and statistical principles for certification [S]. 2006.
