荧光铁载体、铽(Ⅲ)与四环素相互作用的研究
2018-05-21宋凯丽杨斌盛
宋凯丽,杨斌盛
(山西大学 分子科学研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006)
0 引言
铁离子是几乎所有生物生长发育的必需微量元素,在缺铁的条件下,微生物会通过自身分泌或利用其他微生物产生的铁载体吸收环境中微量的铁离子以满足自身对铁离子的需求。Pyoverdine (Pvd,其结构见图1A)即荧光铁载体,是荧光假单胞菌在缺铁条件下分泌的水溶性良好、具有黄绿色荧光的小分子化合物[1-4]。Pvd由发荧光的喹啉衍生基团及肽链组成,现已有100多种不同的Pvd结构被确定,其中肽链的组成和序列的不同导致了Pvd结构的不同[5-8]。铁(Ⅲ)离子是Pvd的天然结合金属,除此之外,Pvd还可与Ag+,Cd2+,Cu2+,Mn2+,Zn2+等金属离子结合[9]。Pvd也可与稀土离子探针Tb3+以1∶1结合,其结合常数为4.44×1014L/mol[10]。四环素(TC,其结构见图1B)是一种广谱抗生素,具有低毒性,可口服等优点,被广泛用于预防、治疗疾病以及促进畜牧业和水产养殖业发展等方面。四环素的结构中存在许多潜在的金属结合位点:酮-苯酚体系的氧原子、烯醇氧、氮原子以及甲酰胺基团,其可与Zn2+,Al3+,Mg2+等金属离子结合[11]。TC分子由具有多个可离子化官能团的4环系统组成,已经报道了三个pKa值,分别是C1-C3:pKa=3.3,C4:pKa=9.6,C10-C12:pKa=7.8[11-12]。
四环素可能通过废水和作物新陈代谢进入水环境中,对水生和陆生生物产生潜在的影响[13]。近年来,抗生素的广泛使用使得荧光假单胞菌铁吸收等是否受这些抗生素干扰的微生物学问题备受关注。本文采用紫外光谱、荧光光谱及等温滴定量热法并利用Tb3+探究了四环素对荧光假单胞菌铁吸收的影响。

Fig.1 Structures of pyoverdine (A) and tetracycline (B)图1 荧光铁载体(A)和四环素(B)的分子结构
1 实验
1.1 材料
四环素(TC),北京百灵威科技有限公司;荧光铁载体(Pvd),Sigma公司;七氧化四铽(Tb4O7),纯度达99.99%,湖南稀土金属材料研究所;三羟甲基氨基甲烷(Tris),生工生物工程(上海)股份有限公司,其他试剂均为分析纯。
1.2 紫外-可见光谱与荧光光谱测定
使用Cary 50 Bio UV-Visible 紫外-可见吸收光谱仪分别测定以TC和Pvd-Tb3+为空白,Tb3+滴定TC及TC滴定Pvd-Tb3+时的紫外-可见吸收光谱;以400 nm为激发波长,使用HORIBA-FluoroMax-4型荧光光谱仪[14]分别扫描TC在410~750 nm范围和Pvd在410~630 nm范围的荧光光谱,Tb3+滴定TC时,激发与发射狭缝均为5 nm,TC与TC-Tb3+滴定Pvd时,激发狭缝与发射狭缝均为2.5 nm。
1.3 等温滴定量热分析(ITC)
采用MicroCal Isothermal Titration Calorimetry 200在pH=8.0, 50 mmol/L的Tris-HCl中进行等温滴定量热分析[15]。25℃每隔180 s将注射器中样品逐滴滴入样品池中,共32滴,第一滴滴定体积为0.4 μL,以后每滴滴定体积均为1 μL,参比池中加入纯净水作为样品池的热平衡参照,得出反应物之间的热力学参数。
2 结果与讨论
2.1 四环素与Tb3+的结合
2.1.1 紫外差光谱分析
在水溶液中TC在274,358 nm处出现特征吸收峰,其中358 nm处的吸收峰为C10-C12的共轭体系引起的。图2A为不同pH条件下TC的紫外-可见吸收光谱。可见pH变化对274 nm处吸收峰没有明显影响,而358 nm处的吸收峰随着pH的增大发生红移,这是由于pH不同,质子化程度不同所引起共轭基团的变化造成的。在pH 8.0, 50 mmol/L Tris-HCl条件下,Tb3+滴定TC的紫外-可见光谱如图2B所示。可见,随着Tb3+的滴加,274 nm和360 nm处的吸收峰逐渐减弱,385~403 nm处为配合物的吸收峰,在372 nm处出现等吸收点。表明在pH 8.0, 50 mmol/L Tris-HCl条件下,Tb3+与四环素结合改变了C10-C12的共轭体系使得385~403 nm处产生了新的宽吸收峰。图2B插图为Tb3+对TC的滴定曲线,可见在403 nm处的吸光度ΔA随Tb3+的滴加线性增加并且在CTb/CTC=0.56处出现明显的拐点,表明Tb3+与TC形成1∶2的配合物。假设两个TC与Tb3+的结合是等同的,根据迭代法[16]使用Sigma Plot 10.0中单位点结合模式由403 nm处的紫外-可见吸收光谱数据,将ΔA/[TC]t对[Tb]f/(Kd+[Tb]f)进行最小二乘拟合,其中第一次拟合使用[Tb]t代替[Tb]f,之后由Kd计算每一滴定点的[Tb]f,经多次拟合至Kd值基本保持不变。其中ΔA为生成物的吸光度,[TC]t为TC的总浓度,[Tb]f为Tb3+的游离浓度,Kd为该反应的解离常数。如图2C分别为第一次与第六次所得的拟合曲线,可得解离常数Kd值为1.70×10-5mol/L, Ka为5.89×104L/mol,故Tb(TC)2配合物表观结合常数K为3.47×109L2/mol2。

Fig.2 (A) UV-Vis spectra of TC in different pH (B) UV-Vis spectra, titration curve and (C) fitting of ΔA/[TC]tat 403 nm as a function of free concentration of [Tb3+]f, to a single-site binding modelusing iteration method by Sigma Plot 10.0 generated by the titration approximately TC (0.05 mmol/L)with Tb3+(0.60 mmol/L) at pH 8.0, 50 mmol·L-1 Tris-HCl图2 (A) 不同pH条件下TC的紫外-可见吸收光谱;(B) Tb3+滴定TC的紫外-可见吸收光谱,插图为滴定曲线;(C) Tb3+滴定TC的拟合曲线。在50 mmol/L, pH 8.0的Tris-HCl溶液中,Tb3+浓度为0.60 mmol/L,TC浓度为0.05 mmol/L;使用Sigma Plot 10.0中单位点结合模式进行拟合
2.1.2 荧光光谱分析
在pH 8.0, 50 mmol/L Tris-HCl缓冲溶液中,Tb3+滴定TC得到的荧光光谱如图3A所示。由图3A可知,TC在466 nm处有最大发射峰,随着Tb3+的滴加,466 nm处的荧光发射峰逐渐降低。将466 nm处的荧光强度对CTb/CTC作图得到图3A插图,可见,466 nm处的荧光强度随Tb3+的滴加而线性减小并且在CTb/CTC=0.50处出现明显的拐点,表明Tb3+与TC形成1∶2的配合物。按照图2C数据处理方法,使用Sigma Plot 10.0中数据拟合的单位点结合模式,将(F0-Fi)/(F0-F∞)对[Tb]f/(Kd+[Tb]f)进行最小二乘拟合,经多次拟合至Kd基本不变。其中F0为四环素的荧光强度,Fi为加入不同浓度Tb3+时四环素的荧光强度,F∞为加入足量Tb3+时四环素的最小荧光强度,[Tb]f为Tb3+的游离浓度,Kd为该反应的解离常数。四次拟合后(图3B),得到Kd值为2.21×10-5mol/L,即Ka值为4.52×104L/mol,进而得到Tb(TC)2的表观结合常数K为2.04×109L2/mol2,得到的结果与紫外-可见光谱所得数据基本一致。
2.1.3 等温滴定量热分析
图4为25℃时,在pH=8.0,50 mmol/L Tris-HCl缓冲溶液中,用Tb3+滴定TC的ITC曲线,所得数据用单位点序列结合模式拟合后得到其结合比为(0.46±0.01),表明在pH 8.0, 50 mmol/L Tris-HCl溶液中,Tb3+与TC形成1∶2的配合物,结合常数为(4.31±0.59)×104L/mol,假设Tb3+与所结合的两个TC是等同的,则其表观结合常数约为1.86×109L2/mol2,与紫外-可见光谱、荧光光谱所得结论一致。所得焓变为(5.87±0.22) kcal/mol,熵变为40.6 cal/mol/deg,根据热力学方程(1)可得吉布斯自由能为-6.23 kcal/mol,表明该反应为熵驱动的自发的吸热反应。
ΔG=ΔH-TΔS
(1)

Fig.3 (A) Fluorescence spectra, titration curve and (B) fitting of (F0-Fi)/(F0-F∞) as afunction of free concentration of [Tb3+]f, to a single-site binding model using iterationmethod by Sigma Plot 10.0 generated by the titration approximately TC (0.2 mmol/L) withTb3+(2.4 mmol/L) at pH 8.0, 50 mmol·L-1 Tris-HCl图3 (A) Tb3+滴定TC的荧光光谱,插图为滴定曲线 (B) Tb3+滴定TC的拟合曲线50 mmol/L, pH 8.0的Tris-HCl溶液中,Tb3+浓度为2.4 mmol/L,TC浓度为0.2 mmol/L;使用Sigma Plot 10.0中单位点结合模式进行拟合

Fig.4 Isothermal titration calorimetry measurements produced by the titration of Tb3+ to TC at pH 8.0 and 25℃.The concentration of the TC was 0.4 mmol/L. The panel shows the integrated heat curve pointsnormalized per mole of injectant as a function of molar ratio.图4 25℃时Tb3+滴定TC的等温量热曲线
2.2 Pvd-Tb-TC三元配合物
2.2.1 紫外差光谱分析
图5A为以Pvd-Tb3+为参比,TC滴定Pvd-Tb3+的紫外-可见吸收光谱,加入TC后,274,360,426 nm处出现了吸收峰。274,360 nm为TC的吸收峰,随着TC的滴加,274,360 nm的吸收峰强度逐渐增强,而426 nm处的峰为Pvd-Tb3+中的Tb3+与四环素C10-C12处共轭体系中的氧原子螯合配位所产生,其强度随TC的滴加先增大后不变。将426 nm处的吸光度ΔA对CTC/CPvd-Tb作图可得图5B,可见,426 nm处的吸光度ΔA随着TC的滴加逐渐增大且在CTC/CPvd-Tb=0.89(接近1)处出现明显的拐点,表明TC可与Pvd-Tb3+结合形成1∶1的配合物。

Fig.5 (A) Difference UV spectra, (B) titration curve of TC binding with Pvd-Tb3+ and (C)fitting of log[ΔA/(ΔA∞-ΔA)] at 426 nm as a function of free concentration of TC.The concentration of TC is 0.21 mmol/L and the concentration of Pvd-Tb3+ is0.01 mmol/L at pH 8.0, 50 mmol·L-1 Tris-HCl图5 (A) TC滴定Pvd-Tb3+的紫外差光谱,(B) TC对Pvd-Tb3+的滴定曲线 (C) TC滴定Pvd-Tb3+的拟合曲线。50 mmol/L, pH 8.0的Tris-HCl溶液中,Pvd-Tb3+浓度为0.01 mmol/L,TC浓度为0.21 mmol/L
前期研究表明Pvd可与Tb3+以1∶1生成配合物,其结合常数为4.44×1014L/mol[10]。Tb3+与TC结合的紫外-可见吸收光谱(图2)、荧光光谱(图3)和等温滴定量热分析(图4)均给出,在pH=8.0, 50 mmol/L Tris-HCl缓冲条件下,Tb(TC)2的表观结合常数约为109L2/mol2。说明在TC与Pvd-Tb3+结合生成1∶1的配合物时,没有TC对Pvd的置换,而是对Pvd-Tb3+中Tb3+配位水的置换,即TC可与Pvd-Tb3+反应形成1∶1∶1的三元配合物Pvd-Tb3+-TC。
假设TC与Pvd-Tb3+间发生(2)反应
nTC+Pvd-Tb3+→Pvd-Tb3+-TCn
(2)
则有:
由此得:
ΔAi∝[Pvd-Tb3+-TCn]
ΔA∞-ΔAi∝[Pvd-Tb3+]f
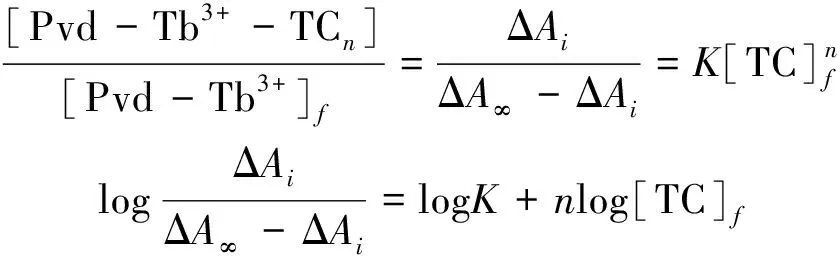
(3)
其中ΔAi代表以Pvd-Tb3+为参比加入TC后的吸光度变化,ΔA∞代表TC与Pvd-Tb3+全部结合形成配合物时的吸光度变化,[TC]f和[Pvd-Tb3+]f分别是TC和Pvd-Tb3+的游离浓度,[Pvd-Tb3+-TCn]代表三元配合物的浓度。由(3)式将log(ΔAi/(ΔA∞-ΔAi))对log[TC]作图可得到直线的斜率为结合比n,截距为logK。
使用426 nm处的吸光度变化,按照(3)式将log(ΔAi/(ΔA∞-ΔAi))对log[TC]作图可得到直线如图5C所示。即在pH=8.0, 50 mmol/L Tris-HCl缓冲条件下,TC与Pvd-Tb3+反应生成Pvd-Tb3+-TC三元配合物的结合常数K为(4.24±0.02)×105L/mol,结合比n为(1.09±0.03)。
2.2.2 荧光光谱分析
在pH 8.0, 50 mmol/L Tris-HCl缓冲溶液中,TC滴定Pvd-Tb3+得到的荧光光谱如图6A所示,可见,457 nm处的荧光强度随着TC的滴加先增强后不变。由于TC与Tb3+的结合常数(104L/mol)远小于Pvd与Tb3+的结合常数(1014L/mol),因此TC与Pvd-Tb3+不会发生配体取代反应。Tb3+的配位数为8到12[17],Pvd为六齿配体与天然底物Fe3+结合,故Pvd-Tb3+的Tb3+至少有两个配位水,TC能与Tb3+的配位水发生配体置换反应从而使Pvd-Tb3+的荧光增强,表明TC与Pvd-Tb3+形成了Pvd-Tb3+-TC三元配合物。
将457 nm处的荧光强度对CTC/CPvd-Tb作图如图6B,Pvd-Tb3+的荧光强度随TC的滴加线性增加且在CTC/CPvd-Tb=1.12(接近1)处出现明显的拐点,表明TC与Pvd-Tb3+形成1∶1的配合物。类似于紫外差光谱数据拟合方法,以log((Fi-F0)/(F∞-Fi))对log[TC]作图(图6C)可得其结合比n为(1.13±0.04),结合常数K为(4.77±0.03)×105L/mol。与紫外差光谱所得出的结论基本一致。
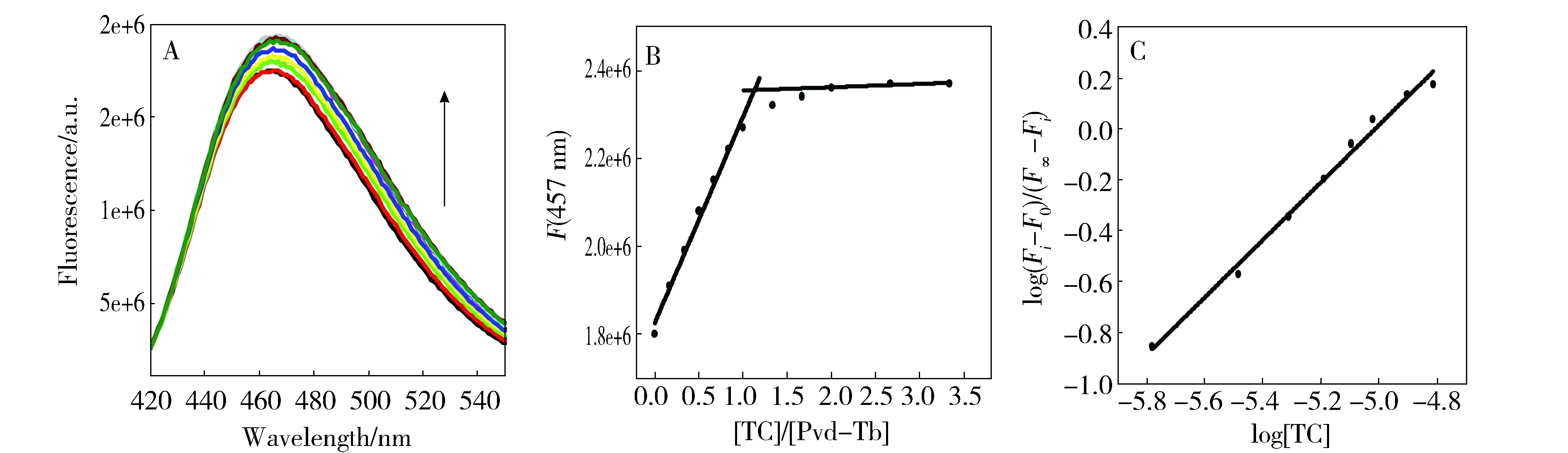
Fig.6 (A) Fluorescence spectra and (B) titration curve of TCbinding with Pvd-Tb3+ (C) Fitting of log[(Fi-F0)/(F∞-Fi)] at 457 nm as a function of free concentration of TC. The concentration of TC is 0.21 mmol/Land the concentration of Pvd-Tb3+ is 0.01 mmol/L at pH 8.0, 50 mmol·L-1 Tris-HCl图6 (A) TC滴定Pvd-Tb3+的荧光光谱,(B) TC对Pvd-Tb3+的滴定曲线 (C) TC滴定Pvd-Tb3+的拟合曲线。50 mmol/L, pH 8.0的Tris-HCl溶液中,Pvd-Tb3+浓度为0.01 mmol/L,TC浓度为0.21 mmol/L
2.2.3 等温滴定量热分析
25℃时,在pH=8.0, 50 mmol/L Tris-HCl缓冲溶液中,TC滴定Pvd-Tb3+的ITC曲线如图7所示,所得数据用单位点序列结合模式拟合后得到其热力学参数。其中,结合比为(0.78±0.01),表明在pH 8.0, 50 mmol/L Tris-HCl条件下,TC与Pvd-Tb3+形成1∶1的配合物,结合常数为(4.34±0.79)×105L/mol,与紫外差光谱、荧光光谱所得结论一致。所得焓变为(24.24±0.77) kcal/mol,熵变为106 cal/mol/deg,根据热力学基本方程(1)可得吉布斯自由能为-7.35 kcal/mol,表明该反应为熵驱动的自发的吸热反应。

Fig.7 Isothermal titration calorimetry measurements produced by the titration of TC to Pvd-Tb3+at pH 8.0 and 25℃. The concentration of the Pvd-Tb3+ was 0.09 mmol/L. The panelshows the integrated heat curve points normalized per mole of injectant as a function of molar ratio图7 Pvd-Tb3+浓度为0.09 mmol/L, 反应温度为25℃下,等温滴定量热法测定TC与Pvd-Tb3+的相互作用
3 结论
本文通过紫外差光谱、荧光光谱及等温滴定量热法探究了四环素与Tb3+及Pvd-Tb3+的相互作用。结果表明:在pH=8.0, 50 mmol/L Tris-HCl缓冲条件下,四环素与Tb3+以2∶1结合,其表观结合常数为109L2/mol2,是一个吸热的、熵驱动的自发反应;四环素与Pvd-Tb3+以1∶1结合生成Pvd-Tb3+-TC三元配合物,其表观结合常数为105L/mol,也是一个吸热的、熵驱动的自发反应;四环素与Pvd-Tb3+相互作用的研究为抗生素对荧光假单胞菌铁吸收机理的深入研究提供了一定的实验依据。
参考文献:
[1] Mislin G L,Schalk I J.Siderophore-dependent Iron Uptake Systems as Gates for Antibiotic Trojan Horse Strategies Against Pseudomonas Aeruginosa[J].Metallomics,2014,6(3):408-420.DOI:10.1039/c3mt00359k.
[2] Martin L W,Reid D W,Sharples K J,etal.Pseudomonas Siderophores in the Spetum of Patients with Cystic Fibrosis[J].Biometals,2011,24(6):1059-1067.DOI:10.1007/s10534-011-9464-z.
[3] Yang B S,Hoegy F,Mislin G L A,etal.Terbium,a Fluorescent Probe for Investigation of Siderophore Pyochelin Interactions with Its Outer Membrance Transporter FptA[J].JInorgBiochem,2011,105(10):1293-1298.DOI:10.1016/j.jinorgbio.2011.03.016.
[4] Gasser V,Guillon L,Cunrath O,etal.Cellular Organization of Siderophore Biosynthesis in Pseudomonas Aeruginosa:Evidence for Siderosomes[J].JInorgBiochem,2015,148:27-34.DOI:https:∥doi.org/10.1016/j.jinorgbio.2015.01.017
[5] Meyer J M,Geoffroy V A,Baysse C,etal.Siderophore-mediated Iron Uptake in Fluorescent Pseudomonas:Characterization of the Pyoverdine-receptor Binding Site of Three Cross-reacting Pyoverdines[J].ArchBiochemBiophys,2002,397(2):179-183.DOI:10.1006/abbi.2001.2667.
[6] Boukhalfa H,Reilly S D,Michalczyk R,etal.Iron(Ⅲ) Coordination Properties of a Pyoverdin Siderophore Producedby Pseudomonas Putida ATCC 33015[J].Inorg.Chem,2006,45(14):5607-5616.DOI:10.1021/ic060196p.
[7] Mashiach R,Meijler M M.Total Synthesis of Pyoverdin D[J].Org.Lett,2013,15(7):1702-1705.DOI:10.1021/ol400490s.
[8] Schalk I J.Metal Trafficking Via Siderophores in Gram-negative Bacteria:Specificities and Characteristic of the Pyoverdine Pathway[J].JInorgBiochem,2008,102(5-6):1159-1169.DOI:10.1016/j.jinorgbio.2007.11.017.
[9] Braud A,Hoegy F,Jezequel K,etal.New Insights Into the Metal Specificity of the Pseudomonas Aeruginosa Pyoverdine-iron Uptake Pathway[J].EnvironMicrobiol,2009,11(5):1079-1091.DOI:10.1111/j.1462-2920.2008.01838.x.
[10] 张文龙,许彩虹,杨斌盛.铽(Ⅲ)与PvdA作用的光谱研究[J].无机化学学报,2014,30(1):106-112.DOI:10.11862/CJIC.2014.069.
[11] Wang H,Yao H,Sun P Z,etal.Oxidation of Tetracycline Antibiotics Induced by Fe(Ⅲ) Ions Without Light Irradiation[J].Chemosphere,2015,119:1255-1261.DOI:10.1016/j.chemosphere.2014.09.098.
[12] Stephens C,Murai K,Brunings K,etal.Acidity Constants of the Tetracycline Antibiotics[J].JAmChemSoc,1956,78:4155-4158.DOI:10.1021/ja01597a081.
[13] Guerra W,Silva-Caldeira P P,Terenzi H,etal.Impact of Metal Coordination on the Antibiotic and Non-antibiotic Activities of Tetracycline-based Drugs[J].CoordChemRev,2016,327-328:188-199.DOI:https:∥doi.org/10.1016/j.ccr.2016.04.009.
[14] 赵亚琴,楚雪峰.TNS与人中心蛋白2作用的荧光光谱研究[J].山西大学学报:自然科学版,2016,39(1):103-107.DOI:10.13451/j.cnki.shanxi.univ(nat.sci).2016.01.017.
[15] Kantonen S A,Henriksen N M,Gilson M K.Evaluation and Minimization of Uncertainty in Isothermal Titration Calorimetry binding Measurements:Heat Error,Concentration Error,Saturation,and Stoichiometry[J].BiochimBiophysActa,2017,1861:485-498.DOI:10.1016/j.bbagen.2016.09.002.
[16] Shi E X,Zhang W L,Zhao Y Q,etal.Binding of Euplotes Octocarinatus Centrin to Peptide from Xeroderma Pigmentosum Group C Protein (XPC)[J].RSCAdv,2017,7(44):27139-27149.DOI:10.1039/C7RA03079G.
[17] 杨频,杨斌盛.离子探针方法导论[M].北京: 科学出版社,1994:167-168.
