人参皂苷的抗血小板作用△
2018-05-21郑思道刘韶英谢芳
郑思道,刘韶英,谢芳
(北京市中西医结合医院 心内科,北京 100039)
人参是国内外临床应用最广泛的传统中药之一,具有多种药理作用,尤以心血管领域的研究最为深入和广泛,而药效基础主要在于其含有的两百余种人参皂苷(Ginsenoside,GS)[1]。GS按照分子结构不同分为原人参二醇(Protopanaxadiol,PPD)和原人参三醇(Protopanaxatriol,PPT)两个类型,并根据其C-20位置上的手性构型不同进一步分为S型和R型。GS临床作用的发挥主要与下丘脑-垂体-肾上腺轴及免疫系统有关,而对血小板的抑制是其调控免疫功能的重要机制之一[2]。虽然人参通过GS显示出多种心血管药理作用,但有关GS抑制动脉硬化、心肌梗死等血小板相关病理生理过程研究较少[1-3]。本文在现有资料基础上,探讨GS抗血小板研究的理论依据、研究实践,分析目前存在的问题,并提出参考意见和建议。
1 人参皂苷抗血小板理论
抗血小板治疗理念源于现代医学,目前的抗血小板理论即是GS抗血小板的研究基础:内皮细胞受损后暴露内皮下基质成分,如胶原蛋白、血管性血友病因子(von Willebrand Factor,vWF)等,引起基质蛋白与血小板糖蛋白受体结合,导致血小板激动剂二磷酸腺苷(Adenosine Diphosphate,ADP)、肾上腺素、5-羟色胺、凝血酶、血栓素(Thromboxane,TX)A2等高度释放,最终形成糖蛋白Ⅱb/Ⅲa与纤维蛋白原结合,并导致血小板聚集和血栓形成[4]。不同激活途径之间存在复查交互作用,并且在血栓形成过程中的作用也不同[5]。上述过程中的黏附、活化和聚集等环节是抗血小板治疗的关键,目前常用的阿司匹林是通过阻断TX A2途径抗血小板,P2Y12受体拮抗剂(氯吡格雷等)主要通过阻断ADP途径抗血小板,而沃拉帕沙等则通过阻断凝血酶途径抗血小板(见图1)[4]。此外,抗血小板治疗可以通过阻断血小板与受损内皮结合进而抑制血栓性形成,而保护血管内皮、阻断内皮下基质暴露,也能起到抗血小板作用[6]。
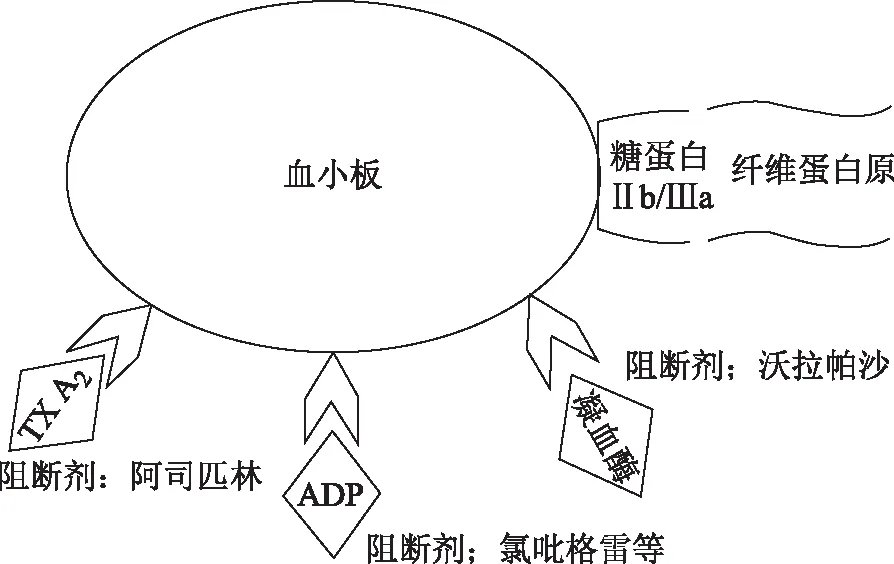
图1 抗血小板药物作用靶点示意图
2 人参皂苷抗血小板实践
2.1 人参总皂苷
研究发现,人参总皂苷呈剂量抑制凝血酶诱导的血小板聚集,并抑制血块凝缩,上述效应可能与其下调糖蛋白Ⅱb/Ⅲa与配体纤维蛋白原结合的作用有关:人参总皂苷通过提高环磷酸腺苷表达水平,活化血管扩张刺激磷蛋白(Ser157)并降低血小板内钙离子浓度、抑制三磷酸腺苷释放,从而抑制糖蛋白Ⅱb/Ⅲa与纤维蛋白原结合[7-8]。进一步研究显示,人参总皂苷中的GS-Ro可能是上述抗血小板聚集作用的主要活性成分之一[9]。有研究显示[6],以GS-Re为主要成分的人参茎叶总皂苷与双联抗血小板(阿司匹林、氯吡给雷)联合应用可增强抗血小板效应:双联抗血小板与双联联合总皂苷两种干预方法对血小板环氧化酶(Cyclooxygenase,COX)-1/TX A2的抑制作用类似,但双联抗血小板下调人脐静脉内皮细胞(Human Umbilical Vein Endothelial Cells,HUVECs)COX-2和前列腺素(Prostaglandin,PG)-I2表达水平,而双联联合人参茎叶总皂苷后则上调HUVECs PG-I2表达水平、不影响COX表达水平,不增加出血风险,并且能够通过减少内皮凋亡、保护血管内皮等提高抗血小板效应,提示人参茎叶总皂苷是双联抗血小板的重要补充。然而与上述研究不同,临床研究显示,3~6个月的人参总皂苷治疗能够提高免疫性血小板,减少症患者的血小板数量,可能与人参总皂苷对造血和免疫的双重调控有关[10]。
2.2 GS-Re
人参茎叶总皂苷含有GS-Re、GS-Rb2、GS-Rd、GS-Rb1、GS-Rg1、GS-Rb3等活性成分,其中以GS-Re含量最高,已有研究提示,GS-Re可能具有抑制血小板的潜在效应[6]。离体研究则证实,GS-Re呈剂量依赖性抑制ADP、血小板活化因子、花生四烯酸等诱导的血小板聚集,其中对ADP诱导的血小板聚集抑制作用最强,可能与其提高腺苷酸环化酶活性、降低血小板内钙离子浓度的作用有关[11-12]。另一研究显示,GS-Re通过失活细胞外信号调节激酶(Extracellular Signal-Regulated Kinase,ERK)-2、p38信号通路下调细胞内钙离子浓度,可以抑制胶原蛋白、凝血酶等诱导的血小板活化[13]。
2.3 GS-Rg1
与GS-Re类似,GS-Rg1也可以通过失活ERK-2、p38信号通路下调细胞内钙离子浓度,从而抑制胶原蛋白、凝血酶等诱导的血小板活化,显示出抗血小板作用[13]。然而早前的研究显示,GS-Rg1虽然抑制胶原蛋白、凝血酶等诱导的血小板活化,并且可能与其失活ERK信号通路有关,但并未涉及对p38信号的调节[14]。此外,GS-Rg1虽然能够抑制ADP等诱导的血小板聚集,但不影响血小板内cAMP表达水平,可能与其提高腺苷酸环化酶活性或者降低血小板胞内的钙离子水平等作用有关[15]。
2.4 GS-Rg3
不同手性构型的GS-Rg3对血小板的调控作用存在显著差异:20R型GS-Rg3抑制ADP诱导的血小板聚集,而20S型GS-Rg3则促进ADP诱导的血小板聚集[16]。而离体和在体研究均显示,GS-Rg3的衍生物GS-Rp1提高环磷酸腺苷表达水平,活化血管扩张刺激磷蛋白(Ser157)并降低血小板内钙离子浓度,从而抑制Ⅱb/Ⅲa与体纤维蛋白原结合,拮抗血小板聚集[17]。作为GS-Rp1衍生物的GS-Rp4,化学稳定性更好,也能够降低血小板细胞内钙离子浓度,并能够抑制ADP诱导的Ⅱb/Ⅲa与体纤维蛋白原结合,相关机制涉及对ERK-2、p38等信号通路的失活[18]。
2.5 GS-Rk1
应用代谢学方法进行的研究表明,GS-Rk1能够抑制COX、下调TXA2代谢产物TXB2表达水平,显示GS-Rk1具有抗血小板作用[19]。此外,GS-Rk1的抗血小板作用也与其调控细胞膜上12-脂氧合酶的作用有关:GS-Rk1下调细胞内钙离子水平、抑制12-脂氧合酶由胞浆转位至细胞膜,从而下调12-羟基二十烷四烯酸表达,最终阻断花生四烯酸诱导的血小板活化[19]。
由以上可见,人参总皂苷、GS-Re、GS-Rg1、GS-Rk1、GS-Rg3及GS-Rg3衍生物GS-Rp1均显示出抗血小板作用见表1。

表1 人参皂苷调控血小板活性的机制和效应
注:ADP:Adenosine Diphosphate,二磷酸腺苷;COX:Cyclooxygenase,环氧化酶;ERK:Extracellular Signal-Regulated Kinase,细胞外信号调节激酶;HUVECs:Human Umbilical Vein Endothelial Cells,人脐静脉内皮细胞;TX B2:Thromboxane B2,血栓素B2。
3 问题与分析
3.1 阿司匹林抵抗
阿司匹林抑制COX-1介导的血小板活化,是目前心脑血管疾病一级和二级预防中应用最广泛的药物,然而阿司匹林尚不能完全阻断血小板活化,临床中存在不同的阿司匹林抵抗现象,主要与单核苷酸多态性、并存炎症反应、代谢紊乱等因素相关,而一类被称为microRNA(miRNA)的单链RNA通过在转录后水平调控基因表达也参与调控阿司匹林抵抗[20]。阿司匹林抵抗、不耐受等为包括中药活性成分在内的新药研发提供了空间。而GS能够一定程度上提高抗血小板治疗效果,可能是现代抗血小板药物治疗的重要补充[21]。
3.2 新技术的应用
应用miRNA研究技术显示,一些miRNA,如miRNA-223、miRNA-191、miRNA-126、miRNA-150等已被证实可以作为血小板活化的标志物,并且miRNA也参与调控阿司匹林抵抗[20-22]。而笔者前期分析表明,中药及GS-Rg1、GS-Rb1、GS-Rh2等人参活性成分药理作用可由miRNA及相关靶基因介导[23-24]。提示miRNA可以作为GS抗血小板治疗研究的新靶点。
3.3 新研究方法的应用
不同的血小板活化途径在血小板活化过程中存在相互作用,因此试图阐述单个药物对特定活化途径的调控作用时往往存在困难[5]。现代新药“一个药物、一个靶标、一种疾病”的研发策略靶标单一,研发的新药临床疗效往往不尽如人意,可能原因在于同一种疾病的分子模块不同[25]。通过探索药物分子模块特征可以为老药新用或中药新用提供更多研究方法[25]。GS的抗血小板研究可以应用这一药效学新方法进行。
3.4 不良反应
单独服用人参一般较为安全,但与其他药物同时服用时(如非甾体类抗炎药物)会产生药物相互作用,具体机制尚未得到明确阐述[2]。陈可冀院士指出,虽然人参活性成分药理作用机制的研究不断深入,但GS的药物毒理学研究不可忽视,要明确其产生不良反应的机制、途径及预防方法[3]。笔者的分析显示,GS通过肝脏中药物代谢酶P450可以与其他药物发生相互作用,可能是相关药物相互作用的机制之一[26]。更多GS药物间相互作用仍需要进一步研究证实。
以结合医学的研究方法,发挥中西医优势互补思维,可以实现中医药学的时代转化,更好服务于健康[27]。人参及其活性成分GS可以在医生指导下发挥补充治疗作用,然而尚不能取代传统抗血小板药物,也需要进一步分析GS与其他药物间相互作用及临床应用的适合剂量[21]。对于人参活性成分GS的抗血小板研究应当理论与实践并重,采用新技术、新方法,既精确定位作用靶点,系统阐释相关分子网络变化。
[1] Zheng S D,Wu H J,Wu D L.Roles and mechanisms of ginseng in protecting heart[J].Chin J Integr Med,2012,18(7):548-555.
[2] Stanger M J,Thompson L A,Young A J,et al.Anticoagulant activity of select dietary supplements[J].Nutr Rev,2012,70(2):107-117.
[3] Sun Y Y,Liu Y,Chen K J.Roles and mechanisms of ginsenoside in cardiovascular diseases:progress and perspectives[J].Science China-Life Sciences,2016,59(3):292-298.
[4] Mega J L,Simon T.Pharmacology of antithrombotic drugs:an assessment of oral antiplatelet and anticoagulant treatments[J].Lancet,2015,386(9990):281-291.
[5] Gorog D A,Fuster V.Platelet function tests in clinical cardiology:unfulfilled expectations[J].J Am Coll Cardiol,2013,61(21):2115-2129.
[6] Wang M M,Xue M,Miao Y,et al.Panaxquinquefoliumsaponin combined with dual antiplatelet drugs inhibits platelet adhesion to injured HUVECs via PI3K/AKT and COX pathways[J].J Ethnopharmacol,2016,192:10-19.
[7] Lee D H,Cho H J,Kim H H,et al.Inhibitory effects of total saponin from Korean red ginsengviavasodilator-stimulated phosphoprotein-Ser(157)phosphorylation on thrombin-induced platelet aggregation[J].J Ginseng Res,2013,37(2):176-186.
[8] Kwon H W,Shin J H,Cho H J,et al.Total saponin from Korean Red Ginseng inhibits binding of adhesive proteins to glycoprotein IIb/IIIa via phosphorylation of VASP(Ser(157))and dephosphorylation of PI3K and Akt[J].J Ginseng Res,2016,40(1):76-85.
[9] Shin J H,Kwon H W,Cho H J,et al.Vasodilator-stimulated phosphoprotein-phosphorylation by ginsenoside Ro inhibits fibrinogen binding to alphaIIb/beta3 in thrombin-induced human platelets[J].J Ginseng Res,2016,40(4):359-365.
[10] 马逢顺,高瑞兰,林筱洁,等.升血灵胶囊(人参总皂苷)治疗免疫性血小板减少症的临床研究[J].浙江中医药大学学报,2012,36(2):137-140.
[11] 闫海峰,代向东,樊克涛,等.人参皂苷Re对ADP、PAF、AA诱导家兔血小板聚集功能的影响[J].天津中医药大学学报,2016,35(5):310-313.
[12] 刘晓春,张瑞英.人参皂苷Re抗血小板聚集及作用机制研究[J].山西医药杂志,2015,44(14):1610-1612.
[13] Qi H,Huang Y,Yang Y,et al.Anti-platelet activity of panaxatriol saponins is mediated by suppression of intracellular calcium mobilization and ERK2/p38 activation[J].BMC Complement Altern Med,2016,16:174.
[14] Zhou Q,Jiang L,Xu C,et al.Ginsenoside Rg1inhibits platelet activation and arterial thrombosis[J].Thromb Res,2014,133(1):57-65.
[15] 华声瑜,曲凤,陈丽平,等.人参皂苷Rg1对血小板聚集及环磷腺苷的影响[J].天津中医药大学学报,2012,31(1):31-33.
[16] 彭茗,张瑱,张彤,等.手性人参皂苷Rg3的抗凝血和抗血小板聚集活性差异研究[J].中华中医药学刊,2015,33(9):2072-2075.
[17] Endale M,Lee W,M,Kamruzzaman S,M,et al.Ginsenoside-Rp1inhibits platelet activation and thrombus formation via impaired glycoprotein VI signalling pathway,tyrosine phosphorylation and MAPK activation[J].Br J Pharmacol,2012,167(1):109-127.
[18] Son Y,M,Jeong D,H,Park H,J,et al.The inhibitory activity of ginsenoside Rp4in adenosine diphosphate-induced platelet aggregation[J].J Ginseng Res,2017,41(1):96-102.
[19] Ju H,K,Lee J,G,Park M,K,et al.Metabolomic investigation of the anti-platelet aggregation activity of ginsenoside Rk1reveals attenuated 12-HETE production[J].J Proteome Res,2012,11(10):4939-4946.
[20] Du G,Lin Q,Wang J.A brief review on the mechanisms of aspirin resistance[J].Int J Cardiol,2016,220:21-26.
[21] Caliskan A,Karahan O,Yazici S,et al.Protective effects of ginseng extracts and common anti-aggregant drugs on ischaemia-reperfusion injury[J].Cardiovasc J Afr,2015,26(6):222-226.
[22] Willeit P,Zampetaki A,Dudek K,et al.Circulating microRNAs as novel biomarkers for platelet activation[J].Circ Res,2013,112(4):595-600.
[23] 郑思道,于雯,王宁元.MicroRNA介导的人参及其活性成分药理作用与机制[J].世界中西医结合杂志,2016,11(6):880-883.
[24] 郑思道,吴红金,刘宇娜.microRNA在现代中医药研究中的作用和意义[J].中西医结合心脑血管病杂志,2012,10(7):857-860.
[25] 张弛,张戈,陈可冀,等.从疾病中医证候分类到分子模块分类[J].中国中西医结合杂志,2016,36(7):781-786.
[26] 吴德琳,刘娟,郑思道.人参活性成分及人参复方制剂对细胞色素P450酶调节作用的研究进展[J].中西医结合心脑血管病杂志,2016,14(16):1874-1876.
[27] 陈可冀.我的中西医结合六十年[J].中国中西医结合杂志,2016,36(7):773-775.