遗传性对称性色素异常症一家系ADAR1基因突变检测
2018-05-21崔红宙郭书萍
高 杰 崔红宙 王 霆 郭书萍
遗传性对称性色素异常症(dyschromatosis symmetrica hereditaria,DSH,OMIM127400)是一种以对称分布于手背、足背的雀斑样色素沉着及色素减退斑为临床表现的常染色体显性遗传病[1]。2003年,Zhang等[2]在2例中国汉族家系内将本病定位在1q11~1q12区间内,同年Miyamura等[3]采用全基因组扫描及候选基因测序的方法,在上述定位区域内发现致病基因ADAR1。本研究前期确诊并收集1例中国汉族DSH家系(图1),现对ADAR1基因外显子区域进行测序,发现位于第13号外显子上的错义突变c.3232C>T在家系内传递。现报道如下。
1 对象与方法
1.1 对象 先证者(III2),女,20岁。自2岁开始双手、足背出现散在点状白色及褐色斑疹,随着年龄增长皮疹稍增多,无自觉不适。智力及发育正常,其他系统检查未见异常。皮肤科查体见双手背及足背对称分布点状针尖至绿豆大的褐色斑点,其间可见色素减退斑,部分皮疹融合成斑片(图2)。面部、口腔黏膜、躯干及掌跖部位无类似皮损。先证者母亲和外祖父手足背部也出现对称分布的色素减退斑和色素沉着,出生即有,病情程度有差异,但较先证者轻。该家系符合常染色体显性遗传。结合家族史及临床表现,诊断为:遗传性对称性色素异常症。健康对照100名均来自于我院体检中心的患者,签署知情同意书,研究获得医院伦理委员会批准。
1.2 方法
1.2.1 外周血基因组DNA提取 抽取先证者(III2)、先证者母亲(II1)及该家系表型正常者(II3、II6)的外周静脉血5 mL,置于2% EDTA抗凝管中,-80℃低温储存。应用QIAamp DNA blood mini kit(QIAGEN公司,德国)提取基因组DNA,同时提取100名与该家系无亲缘关系的健康个体作为对照,以排除基因的多态性。
1.2.2 引物设计及PCR扩增 采用Primer 5.0软件针对ADAR1基因外显子区和侧翼序列设计引物,交由上海生工生物技术服务有限公司合成。其中第13号外显子引物为:上游5’-CTGTGGTAGGAAGATCCTGGTA-3’,下游5’-CAACGGGAGAAAGATGGAAA-3’。PCR反应条件:94℃预变性2 min;98℃变性10 s,58℃退火30 s,72℃延伸1 min,共30个循环;72℃终极延伸5 min。
1.2.3 DNA测序 PCR扩增产物经1.5%琼脂糖凝胶电泳,交由上海生工生物技术服务有限公司进行Sanger测序,测序结果使用Chromas软件解读,并与人类基因组数据库中ADAR1基因序列进行比对。
2 结果
该家系患者ADAR1基因第13号外显子发现错义突变c.3232C>T(图3),突变使得第1078位表达氨基酸由精氨酸(Arg)变成半胱氨酸(Cys)(p.R1078C),表型正常的家族成员及100名无亲缘关系的正常人对照中均未发现该突变位点。
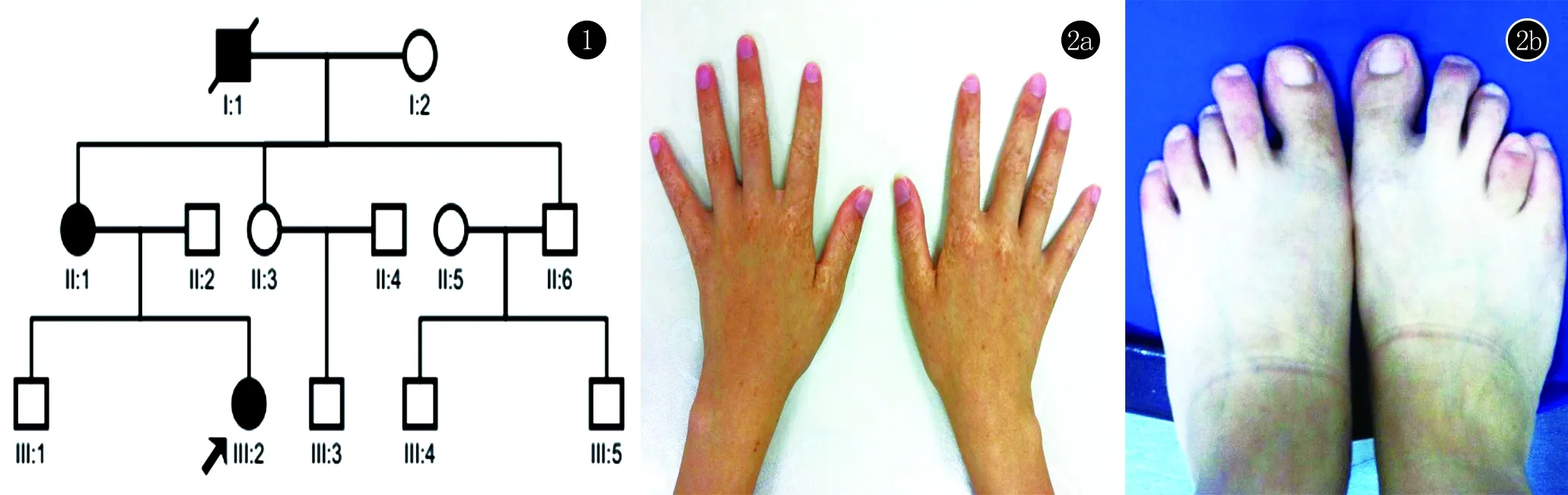
图1 DSH家系图(I:1、II:2为患者,III:2为先证者)图2 先证者临床表现(a,b):双手背及足背对称分布点状针尖至绿豆大的褐色斑点,其间可见色素减退斑,部分皮疹融合成斑片
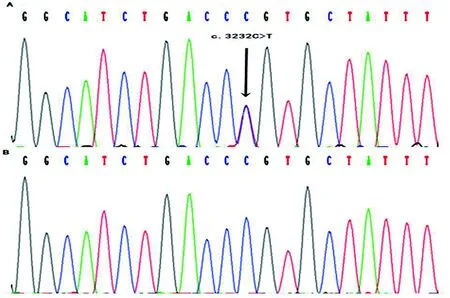
图3 ADAR1基因第13号外显子错义突变c.3232C>T(A:患者,B:健康对照者)
3 讨论
遗传性对称性色素异常症首次在日本人群中发现,其主要见于黄种人,男性多于女性,其临床表现为四肢伸侧,尤其是手、足背对称性弥漫分布色素减退及色素沉着斑,面部的皮损表现类似于雀斑。无明显自觉症状,夏重冬轻。目前尚无特殊疗法。
3.1 发病机制 DSH表现为常染色体显性遗传,自2003年Miyamura等[3]在4个DSH家系中发现了ADAR1的杂合突变,目前已经发现有140种以上ADAR1基因突变位点[4-10],以错义突变及移码突变最为多见[11-13]。其中错义及无义突变80种,剪接突变11种,缺失突变37种,插入突变13种。ADAR1基因包含15个外显子,编码含有1226个氨基酸序列的双链RNA特异性腺苷脱氨酶(RNA-specific adenosine deaminase 1),该酶含有6个功能域,分别包含2个Z-DNA结合结构域(Z-DNA-binding domin in adenosine deaminases,Zalpha);3个ds-RNA结合区域(doublestranded RNA binding motif,dsrm);1个腺苷脱氨催化区(tRNA-specifific and double-stranded RNA adenosine deaminase,ADEAMc),其中ADEAMc区由第886位至1221位氨基酸所编码,在人、牛等哺乳动物中高度保守[14],在RNA的编辑中发挥着重要的作用,编码结构实现腺苷的脱氨基作用[15],是基因的功能核心区域。目前报道的基因突变几乎均局限于ADEAMc区域[4,5]。RNA编辑功能障碍可以影响一系列生物活性。Miyamura等[3]认为,RNA编辑的失败能够影响黑素母细胞的分化,产生高活性及低活性两种不同的黑素细胞。另外,李聪颖等[16]证实HaCaT细胞中ADAR1基因沉默可降低Wnt蛋白的表达,Wnt信号通路参与毛囊干细胞和黑素干细胞的协调作用[17],黑素干细胞中Wnt信号通路失活可以影响A375细胞酪氨酸酶活性,最终导致色素异常。
3.2 突变与表型可能的关系 本研究通过对1例中国汉族DSH患者进行ADAR1基因编码区测序发现在第13号外显子上错义突变c.3232C>T,导致位于ADEAMc功能域的第1078位氨基酸由精氨酸(Arg)变成半胱氨酸(Cys),此突变曾于2004年在汉族种群中首次报道。使用PolyPhen-2软件进行蛋白功能的预测,预测结果为 probably damaging (score=1.0)。本研究发生于ADAR1基因突变可能导致有害的蛋白表达,影响ADEAMc结构稳定性,导致RNA编辑的失败,影响黑素母细胞的分化,以致产生高活性及低活性两种不同的黑素细胞,推测可能参与DSH色素的异常。另外,本研究中的ADAR1基因错义突变的发生也有可能降低Wnt蛋白的表达,或者影响A375细胞酪氨酸酶的活性,推测可能参与DSH表型的发生。
3.3 展望 目前热点突变找寻使得DSH疾病诊断以及表型分型不断完善。但仍有基因型-表型不匹配,如不伴ADAR1基因突变的DSH发病以及明确伴ADAR1基因突变的DSH患者中合并头发颜色改变、牙齿异常和自身免疫性疾病等[18],下一步我们以ADAR1基因导致皮肤色素异常表型的机制展开工作,同时重点关注不伴ADAR1基因突变的DSH的致病基因找寻。
参考文献
[1] 赵辨.中国临床皮肤病学[M].南京:江苏科学技术出版社,2009.1407-1408.
[2] Zhang XJ,Gao M,Li M,et al. Identification of a locus for dyschromatosis symmetrica hereditaria at chromosome 1q11~1q21[J]. J Invest Dermatol,2003,120:776-780.
[3] Miyamura Y,Suzuki T,Kono M,et al. Mutations of the RNA-specific adenosine deaminase gene(DSRAD)are involved in dyschromatosis symmetrica hereditaria[J].Am J Hum Genet,2003,73:693-699.
[4] Fritz J,Strehblow A,Taschner A,et al. RNA-regulated interaction of transportin-1 and exportin-5 with the double-stranded RNA-binding domin regulates nucleocytoplasmic shuttling of ADAR1[J]. Mol Cell Biol,2009,29(6):1487-1497.
[5] Li M,Yang L,Li C,et al. Mutational spectrum of the ADAR1 gene in dyschromatosis symmetrica hereditaria[J]. Arch Dermatol Res,2010,302(6):469-476.
[6] Murata I,Hozumi Y,Kawaguchi M,et al. Four novel mutations of the ADAR1 gene in dyschromatosis symmetrica hereditaria[J]. J Dermatol Sci,2009,53(1):76-77.
[7] Zhang F,Liu H,Jiang D,et al. Six novel mutations of the ADAR1 gene in Chinse patients with dyschromatosis symmetrica hereditaria[J]. J Dermatol Sci,2008,50(2):109-114.
[8] 刘红,蒋德科,田洪清,等. 一个遗传性对称性色素异常症家系DSRAD基因剪切位点突变的鉴定[J].中华皮肤科杂志,2008,41(3):163-165.
[9] Wang XP,Wang WJ,Wang JM,et al. Four novel and two recurrent mutations of the ADAR1 gene in Chinse patients with dyschromatosis symmetrica hereditaria[J]. J Dermatol Sci, 2010,58(3):217-218.
[10] Bassi E,Roujeau JC,Grimbert P,et al. Grover's disease in a renal transplant patient,after hemodialysis renewal[J]. G Ital Dermatol Venereol,2012,147(2):222-223.
[11] Kawaguchi M, Hayashi M, Murata I, et al. Eleven novel mutations of the ADAR1 gene in dyschromatosis symmetrica hereditaria[J]. J Dermatol Sci,2012,66(3):244-245.
[12] Murata I,Hayashi M,Hozumi Y,et al. Mutation analyses of patients with dyschromatosis symmetrica hereditaria: five novel mutations of the ADAR1 gene[J]. J Dermatol Sci,2010,58(3):218-220.
[13] 李敏,王丽君,张彩娥,等.一个遗传性对称性色素异常症家系DSRAD基因突变分析[J].第四军医大学学报,2008,29(4):366-368.
[14] Li CR,Xu XL,Sun XJ,et al. Two new mutations of the ADAR1 gene associated with dyschromatosis symmetrica hereditaria[J]. Arch Dermatol Res,2010,302(6):477-480.
[15] Suzuki N,Suzuki T,Inagaki K,et a1. Ten novel mutations of the ADAR1 gene in Japanese patients with dyschromatosis symmetrica hereditaria[J]. J Invest Dermatol,2007,127:309-311.
[16] 李聪颖,沈征宇,汪蓓青,等.HaCaT细胞ADAR1基因沉默对Wnt11表达和A375细胞酪氨酸酶活性的影响[J].中华皮肤科杂志,2013,46(12):877-880.
[17] Rabbani P,Takeo M,Chou WC,et al. Coordinated activation of Wnt in epithelial and melanocyte stem cells initiates pigmented hair regeneration[J].Cell,2011,145(6):941-955.
[18] Liu Q,Wang Z,Wu Y,et al. Five novel mutations in the ADAR1 gene associated with dyschromatosis symmetrica hereditaria[J].BMC Med Genet,2014,5(1):1-17.
