大鼠脑缺血再灌注后线粒体ATP酶活性、形态学变化及丹参多酚酸的保护作用
2018-05-21李富强尹金鹏尹晓刚刘荣志白宏英
李富强, 王 伟, 尹金鹏, 冯 涛, 尹晓刚, 邓 倩, 刘荣志, 白宏英
线粒体功能障碍在缺血性脑损伤中起着重要作用。近年来研究发现线粒体功能障碍与线粒体ATP酶密切相关。线粒体ATP酶是一种存在于线粒体膜依靠ATP能量蛋白酶,主要有Na+/K+ATP酶、Ca2+ATP酶、Mg2+ATP酶组成;依靠ATP能量逆梯度转运线粒体内Na+、Ca2+,维持线粒体钙平衡。脑缺血再灌注损伤后,线粒体功能衰竭,ATP合成障碍,线粒体ATP酶活性下降,引起线粒体内钙超载,最终引起细胞凋亡[1]。丹参属于唇齿科植物,其根茎有活血、养血、通心络作用,已经广泛应用心血管疾病、脑血管疾病、白血病等[2]。注射用丹参多酚酸(Salvianolate)是从中药丹参中提取的水溶成分,其主要成分是丹酚酸B,研究证明其可以通过提高血管内皮生长因子,白细胞介素-10表达,减低大鼠神经行为学评分起到脑保护作用[3]。但其对线粒体的保护作用研究较少,本研究通过大鼠缺血再灌注模型探讨注射用丹参多酚酸的脑保护作用是否与线粒体ATP酶相关,为明确保护机制提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物与模型制备 健康雄性SD大鼠,体重(300±20)g,由郑州大学动物实验中心提供。将54只雄性SD大鼠随机分成3组(n=18):假手术组、注射用丹参多酚酸组、缺血再灌注组。模型制备:采用改良Zea Longa法制备大鼠右侧中动脉缺血再灌注模型。假手术组手术过程中,分离右侧颈总、颈内、颈外动脉但不插入线栓。注射用丹参多酚酸组、缺血再灌注组线栓待缺血2 h后,缓慢抽出线栓再灌注24 h。动物苏醒后出现右侧Horner征、眼裂变小、瞳孔缩小和左侧躯体运动障碍评定为模型成功。丹参多酚酸组于缺血2 h再灌注24 h后连续7 d给予10 mg/kg尾静脉注射,每天1次。假手术组、缺血再灌注组给予等量生理盐水尾静脉注射。末次给药6 h后功能评分后取脑。
1.1.2 主要试剂与仪器 注射用丹参多酚酸(天津天士力之骄药业有限公司,国药准字Z20110011),显微手术器械(上海手术器械厂);氯化三苯基四氮唑(TTC,批号:030227,北京化学试剂公司);低温高速离心机(德国,Kendro Labrotary);石蜡切片机、倒置显微镜(德国Leica公司);丙二醛试剂盒及ATP酶试剂盒(南京建成科技有限公司)。
1.2 方法
1.2.1 脑梗死体积测定 大鼠脑组织应用冰箱-20 ℃冷冻20 min后取出,沿视交叉向前冠状位平行依次切片2 mm×5片。将切好的脑片放置在2%TTC磷酸缓冲液中,恒温箱37℃避光孵育30 min后,用4%多聚甲醛固定。用数码相机拍照后输入计算机,应用图像分析软件计算脑梗死体积百分比。梗死体积百分比=(左侧正常脑组织体积-右侧正常脑组织的体积)/左侧正常脑组织体积×100%,以此作统计分析。
1.2.2 实验动物取材及HE染色标本的制备 4%多聚甲醛(4℃)将大鼠灌流固定断头取脑后,将脑组织浸入4%多聚甲醛(4 ℃预冷)中固定24 h,常规梯度乙醇脱水、石蜡包埋。将包埋好的脑组织在恒温切片机上沿冠状面连续切片,片厚约5 μm,展片、捞片后置于载玻片上放在4 ℃冰箱保存备用。在70 ℃烤箱中烘烤30 min常规脱蜡,二甲苯及梯度乙醇脱蜡至纯水,Harris苏木素染色15 min,自来水冲洗;1%盐酸乙醇分化3~5 s,自来水冲洗返蓝;伊红染色1 min,自来水冲洗。脱水、透明、中性树胶封片。
1.2.3 脑组织线粒体的提取 利用差速离心法提取线粒体。麻醉后迅速处死动物取脑,去除脑膜、小脑,嗅球、脑干后,留取右侧大脑半球,冰盐水冲去血液,用小剪刀于冰浴的小烧杯中将脑组织剪成边长约3 mm的小块,应用缓冲液(0.1 mol/ L Tris-HCl,pH 7.4,0.25 mol/L Sucrose,0.01 mol/ L EGTA)按9∶1比例混合后,转移至预冷的玻璃匀浆器中,上下均匀匀浆10次制成10%匀浆(避免出现气泡)。低温高速离心机(温度4 ℃)以7650 rpm转速离心20 min后,取上清液再以8400 rpm转速离心20 min后,取沉淀物加入线粒体保存液充分震荡,反复吹打,得到线粒体悬浮液。上述操作均4 ℃下进行[4]。Lowry法检测蛋白浓度。
1.2.4 线粒体丙二醛及ATP酶测定 丙二醛监测采用硫代巴比妥酸(TBA)方法。丙二醛(结构OHC-CH2-CHO)与硫代巴比妥酸反应后产物,在532 nm处有最大吸收峰。ATP酶即三磷酸腺苷酶,ATP酶分解ATP为ADP和无机磷,无机磷在660nm处有最大吸收峰。取脑线粒体悬浮液监测,具体检测步骤按照试剂盒说明书操作。

2 结 果
2.1 脑梗死体积 假手术组双侧脑组织均匀红染,未发现梗死灶;IR组和丹参多酚酸组可见右侧大脑半球不同范围的苍白色梗死灶。丹参多酚酸组脑梗死体积显著小于IR组(P<0.05)(见图1)。

注:与缺血再灌组相比*P<0.05
2.2 光镜下观察大鼠脑组织神经元形态学变化 假手术组(见图2)神经元胞质呈深红色,胞核呈蓝色。细胞形态正常,边界清楚,核大而圆,核膜、核仁清晰可见。缺血再灌注组(见图3)神经细胞排列紊乱,呈缺血性改变的锥体细胞,胞体肿胀变形成多角形、核固缩;丹参多酚酸组(见图4)干预后神经细胞缺血性改变程度均较缺血再灌注组轻,间质水肿明显减轻,神经细胞及细胞间质水肿明显减轻,细胞核基本正常,核仁较清晰,可见少量神经细胞形态异常、核固缩或消失。
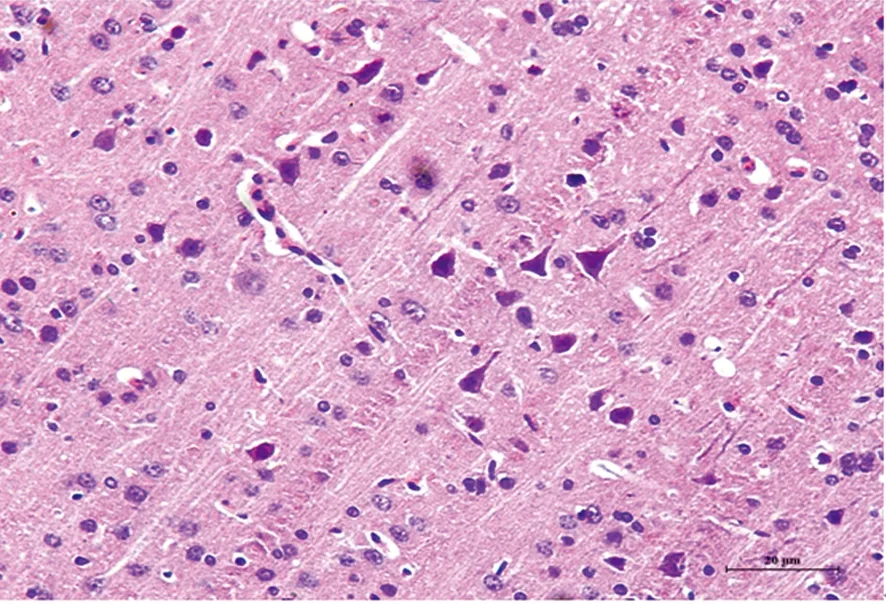
图2 假手术组

图3 缺血再灌注组

各组大鼠脑组织神经元形态学变化(HE染色 ×200)
2.3 丙二醛测定 丹参多酚酸治疗组显著抑制缺血再灌注后线粒体膜损伤。与缺血再灌注组相比,丹参多酚酸治疗组丙二醛含量(0.901±0.472)显著减少(P<0.05);与假手术组相比,缺血再灌注组丙二醛含量(1.501±0.149)显著增多(P<0.05)。(见图5)
2.4 线粒体ATP酶的影响 缺血再灌注组Na+/K+ATP酶(2.968±0.178),Ca2+ATP酶(3.641±0.145),Mg2+ATP酶(1.055±0.153)与假手术组相比明显下降(P<0.05);与缺血再灌注组相比,丹参多酚酸组Na+/K+ATP酶(5.032±0.154),Ca2+ATP酶(4.987±0.122),Mg2+ATP酶(2.503±0.260)能提高线粒体ATP酶活性(P<0.05)(见图6)。

注:与缺血再灌组相比*P<0.05);缺血再灌注组与假手术组相比P<0.05
图5 丹参多酚酸组对线粒体丙二醛的影响

注:Na+/K+ATP酶:*与缺血再灌组相比(P<0.05);Ca2+ATP酶:#与缺血再灌组相比(P<0.05);Mg2+ATP酶:**与缺血再灌组相比(P<0.05)
图6 丹参多酚酸对线粒体ATP酶的影响
3 讨 论
我们实验发现,缺血再灌注后大鼠脑线粒体丙二醛含量升高,线粒体Na+/K+ATP酶、Ca2+ATP酶、Mg2+ATP酶活性降低,提示线粒体膜破坏,线粒体ATP酶功能障碍;HE切片上可以看到神经细胞胞体肿胀变形,核固缩,神经元细胞减少,TTC染色可见脑梗死体积明显增加。近年来研究发现,脑缺血时线粒体功能障碍是神经损伤的关键因素。正常情况下,线粒体依赖线粒体膜上ATP酶维持线粒体内Na+、K+、Ca2+及线粒体内膜电位平衡。脑缺血时,细胞无氧酵解,缺血区乳酸堆积,缺血区PH值降低,抑制三羧酸循环,而且组织内H离子增加激活Na+/ H+交换。Na+内流,线粒体膜电位下降,线粒体内离子平衡破坏,ATP合成受抑制,尤其是再灌注时大量活性氧产生,损害线粒体细胞膜,线粒体结构性破坏,导致ATP合成进一步减少[5]。线粒体能量障碍引起线粒体膜上依靠ATP能量的Na+/K+ATP酶、Ca2+ATP酶、Mg2+ATP酶活性降低;Na+/K+ATP酶不能维持线粒体内K+梯度优势,引起Na+内流,Na+过度引起Na+/ Ca2+交换,Ca2+进入线粒体,引起钙超载[6]。Ca2+ATP酶和Mg2+ATP酶依靠ATP能量将Ca2+泵出,线粒体钙平衡;线粒体损伤时线粒体膜破坏,ATP合成减少,线粒体内Ca2+溶度增加,引起线粒体钙超载,触发线粒体通透型转化孔开放[6]。线粒体通透型转化孔开放引起分子量大于1500Da的物质自由通过线粒体内膜,引起线粒体肿胀,线粒体外膜破裂,释放细胞色素C、Smac/DIABLO、核酸内切酶G等促凋亡物质释放[7];而且钙超载激活依赖钙离子降解酶,导致细胞结构破坏,细胞灾难性损伤[8]。
注射用丹参多酚酸是采用柱层析技术提取的丹参水溶成分,其主要有效成分是丹酚酸B。实验研究表明,丹参多酚酸通过上调高尔基磷酸化蛋白-3表达,激活Akt和mTOR磷酸化途径减少TUNEL细胞起到脑保护作用[9]。我们研究发现,丹参多酚酸组丙二醛含量减少,Na+/K+ATP酶、Ca2+ATP酶、Mg2+ATP酶活性升高,与缺血再灌组相比,脑梗死体积明显较少,HE接片神经细胞及细胞间质水肿明显减轻,细胞核基本正常,核仁较清晰。因此我们认为,提高线粒体ATP酶活性,维持线粒体离子平衡,保护线粒体膜稳态可能是注射用丹参多酚酸发挥脑保护作用的主要机制。
[参考文献]
[1]Chen SD,Yang DI,Lin TK,et al. Roles of oxidative stress,apoptosis,PGC-1α and mitochondrial biogenesis in cerebral ischemia[J]. Int J Mol Sci,2011,12(10):7199-7215.
[2]梁 勇,羊裔明. 丹参酮药理作用及临床应用研究进展[J]. 中草药,2000,31(4):304-306.
[3]白 蓉,王 淑. 注射用丹参多酚酸对脑缺血大鼠 VEGF,IL-10 的影响[J]. 中风与神经疾病杂志,2016,33(5):411-416.
[4]李富强,白宏英,娄季宇,等. 脑缺血后处理对缺血再灌注脑组织线粒体通透性转换的影响[J]. 中风与神经疾病杂志,2011,28(9):796-799.
[5]Walters AM,Porter GA,Brookes PS. Mitochondria as a drug target in ischemic heart disease and cardiomyopathy[J]. Circ Res,2012,111(9):1222-1236.
[6]Suvanish Kumar VS,Gopalakrishnan A,Naziroglu M,et al. Calcium Ion-The Key Player in Cerebral Ischemia[J]. Curr Med Chem,2014,21(18):2065-2075.
[7]Baines CP. The molecular composition of the mitochondrial permeability transition pore[J]. J Mol Cell Cardiol,2009,46(6):850-857.
[8]Tajeddine N. How do reactive oxygen species and calcium trigger mitochondrial membrane permeabilisation[J]. Bba-Gen Subjects,2016,1860(6):1079-1088.
[9]You H,Li T,Zhang J,et al. Reduction in ischemic cerebral infarction is mediated through golgi phosphoprotein 3 and Akt/mTOR signaling following salvianolate administration[J]. Curr Neurovasc Res,2014,11(2):107-113.
