不同发作频率偏头痛病人头痛特征及伴随症状差异分析*
2018-05-21许春阳严满云郭效宁倪健强陆海锋赵红如
陈 灿 许春阳 严满云 郭效宁 倪健强 陆海锋 赵红如
(苏州大学附属第一医院神经内科,苏州215031)
偏头痛(migraine)是一种严重的慢性致残性神经功能障碍,全球年患病率为15%~18%[1],中国大陆流行病学调查显示患病率为9.3%;女:男约为2.25:1[2]。偏头痛对生活质量的影响巨大,目前已被世界卫生组织列为与痴呆、四肢瘫痪和严重精神病共同影响人类健康的四大疾病之一[3~5]。此外,偏头痛的反复发作还可导致认知功能下降[6]。长期以来,由于止痛药物的过度使用及急性期不恰当治疗、基线期的头痛频繁或偏头痛病程长等诸多因素影响,偏头痛的慢性化趋势及程度越来越严重。既往研究表明,每年约有2%~2.5%左右的周期型偏头痛发生慢性转化[7]。慢性偏头痛较发作性偏头痛对病人身体健康和生活质量危害更大。偏头痛病人头痛发作期经常会伴随一些非头痛症状,如恶心、呕吐、畏光、畏声、皮肤异常疼痛、畏嗅、认知下降等,这些伴随症状在偏头痛中有较高的灵敏度及特异度,对于伴随症状的研究主要集中于辅助偏头痛诊断,但在偏头痛病程进展中,不同发作频率病人伴随症状所具有的不同特点,现已有研究发现这些伴随症状与病人病程、频率等相关,而国内尚缺乏系统而量化的研究。本研究重点比较不同发作频率病人头痛特点及伴随症状的差异,对其临床特征进行分析,为进一步探讨其病理生理机制提供依据。
方 法
1.一般资料
收集2016年12月1日至2017年9月30日期间就诊于苏州大学附属第一医院神经内科门诊及头痛门诊,符合ICHD-3版无先兆偏头痛诊断标准[8]的病人334例,年龄14~86岁。根据每月头痛天数,对病人发作频率人为规定,分为三组:①偏头痛偶发组(Infrequent episodic migraine,IEM):符合ICHD-3偏头痛诊断标准,且每月头痛天数≤2天,入组病人132例[男45例,女87例,平均年龄(38.40 ± 11.00)岁]。②偏头痛频发组(frequent episodic migraine,FEM):符合ICHD-3偏头痛诊断标准,每月头痛天数3~14天,入组病人157例[男49例,女108例,平均年龄(41.30 ±10.25)岁]。③慢性偏头痛组(chronic migraine,CM):符合ICHD-3慢性偏头痛诊断标准(头痛≥15 天/月,持续大于3个月,至少8天/月符合偏头痛特征)。入组病人45例[男7例,女38例,平均年龄(46.94±14.73)岁]。
采用问卷调查方式收集病人资料,收集以下数据:①临床资料:病人的年龄、性别、病程、受教育年限、发作频率(每月头痛天数);②头痛症状特点:头痛性质、程度、部位、是否活动后加重及止痛药物使用情况;③伴随症状:恶心、呕吐、畏光、畏声、畏嗅、皮肤异常疼痛等症状;④生活质量:焦虑、抑郁、睡眠障碍及头痛致残性评分。
头痛程度的判定使用疼痛视觉模拟评分(visual analog scales,VAS);焦虑采用广泛性焦虑量表(generalized Anxiety Disorder Scale,GAD-7)量 化;抑郁采用PHQ-9抑郁筛查量表量化;睡眠障碍采用阿森斯失眠量表量表 (athens Insomnia Scale,AIS)量化;头痛致残性采用偏头痛残疾程度评估量表 (migraine disability assessment scale,MIDAS)量化。
2.统计学分析
数据分析使用SPSS 19.0统计学软件。计量资料以均数±标准差(x±SD)表示,比较采用单因素方差分析或独立样本t检验;计数资料以例数(或百分率%)表示,比较采用X2检验。以P< 0.05表示差异有统计学意义。
结 果
1.三组间基本资料比较
IEM组与FEM组间,年龄存在统计学差异,其余无统计学差异;FEM组与CM组间,年龄、性别、受教育年限、病程均存在统计学差异;IEM与CM组间受教育年限无统计学差异,其余均存在统计学差异。三组间基本资料对比(见表1)。
2.三组间头痛特点差异比较
本组资料结果显示,IEM组和FEM组除止痛药物使用比例有统计学差异外,在头痛单侧性、头痛性质及活动后加重等方面均无明显差异;CM组和FEM组除单侧疼痛及头痛程度方面无明显差异外,其余头痛特征均显示明显统计学差异;IEM组和CM组相比,除单侧疼痛及疼痛程度外,其余头痛特征均存在统计学差异(见表2)。
3.三组间伴随症状差异比较
头痛伴随症状方面,IEM组和FEM组各项伴随症状均无明显差异;CM组与FEM组在恶心、呕吐、畏声方面无明显统计学差异,但CM组的畏光、畏嗅、异常疼痛比率均明显高于FEM组;CM组与IEM组相比,恶心、呕吐、畏声方面无明显统计学差异,其余畏光、畏嗅、异常疼痛方面CM组均明显高于IEM组,结果存在统计学差异(见表3)。
4.三组间生活质量的比较
生活质量方面,IEM组与FEM组相比,抑郁、睡眠障碍评分未见明显差异,焦虑、头痛致残性方面FEM组高于IEM组;CM组抑郁、焦虑、睡眠障碍及头痛致残性各项指标均明显高于IEM组及FEM组(见表4)。
讨 论
按最新发表的ICHD-3诊断标准[8],偏头痛可分为:无先兆偏头痛,先兆型偏头痛,慢性偏头痛、偏头痛并发症、很可能的偏头痛及可能与偏头痛相关的周期性综合征。通常为研究需要,偏头痛按发作频率分类分为发作性偏头痛(episodic migraine,EM)及慢性偏头痛(chronic migraine,CM)。CM多由EM转化而来,但偏头痛慢性转化(Chronif i cation)不仅是头痛发作日的增加,而且发生了质的转化。随着发作频率的增加,偏头痛样症状的严重程度往往会降低,症状趋向于不典型。

表1 临床资料Table 1 The clinical characteristics of the subjects

表2 各组间头痛症状比较Table2 Headache symptoms between groups
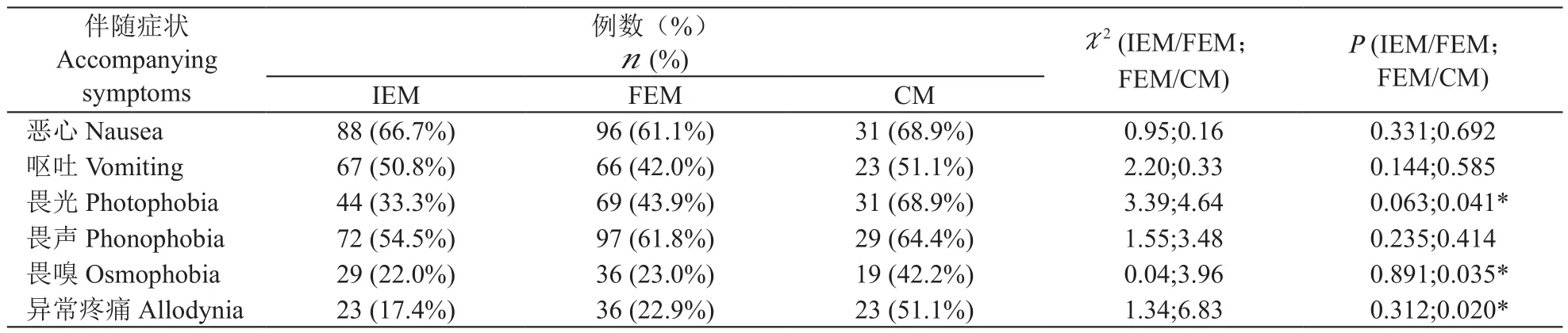
表3 各组间头痛伴随症状比较Table3 Accompanying symptoms between groups

表4 各组间生活质量比较Table4 Life quality between groups
本研究结果显示,在头痛症状方面,EM亚组间并无明显差异,而CM组则较不典型,活动后加重、搏动性头痛等特点较EM不明显,本结果与既往文献基本一致[9]。对于头痛频繁或者持续发作的病人,很难区分每次发作头痛的性质,因CM常合并焦虑、抑郁及药物过度使用,故其头痛特征可不表现为偏头痛样头痛,而表现为紧张型头痛。ICHD-2版仅把CM作为“偏头痛并发症”而未独立分类,直至ICHD-3才将其作为独立诊断。由于CM症状的不典型,临床医生对本病认识不足,易导致误诊,病人得不到及时有效的治疗,头痛迁延不愈,多数病人合并严重的抑郁焦虑,严重影响病人的生活质量和工作能力。
CM组,与感觉敏感度增加的伴随症状诸如畏光、畏嗅、头皮触痛等症状均明显高于EM各亚组。既往认为,畏光在偏头痛病人中属于常见伴随症状,如国外学者调查发现偏头痛病人伴随畏光症状约为91.4%[10],国内数据约为65%[11]。国内外资料的差异,我们考虑一方面可能由于病人对自身症状的敏感、关注及耐受程度有差异;另一方面与研究者对症状的问诊方式有关[12]。本组资料显示,在EM各组病人中畏光比率偏低(33.3%,43.9%),而在CM病人中畏光比率大大增加(68.9%)。我们在对于畏光、畏声的问诊中,采取Evans[12]推荐的序贯问诊方式:首先采用常规问诊“您在头痛时是否感受到怕光、怕吵?”,如病人否定,则进一步问诊:“您在头痛发作时,是否感受到在较黑暗、安静的环境中会感到舒适?”如病人回答“是”,则同样列为阳性诊断。而对于不同频率偏头痛病人间畏光比率的差异,则可能与畏光的产生机制有关。Boulloche[13]等通过PET-MRI模拟疼痛与空间注意的研究发现,畏光主要表现为对空间关注的异常不适。在对模拟疼痛伴畏光的研究中可发现楔前叶(BA7区)的激活,楔前叶可能对疼痛及疼痛引起的注意进行自上而下的调控,可能由皮层下结构包括蓝斑核介导。而蓝斑核是重要的伤害感受调节区域[14,15],且其与楔前叶共同参与视觉空间关注网络。这些区域可能直接或间接的通过楔前叶,经视觉皮层激活导致疼痛不适感的增强。因此,畏光症状,并非单纯对光线敏感,而更多地表现为对光线导致的空间关注网络改变的过度敏感,不仅涉及到视觉,还包括空间认知方面。而在CM中,目前发现长期的头痛发作可导致视觉注意、空间认知异常[16,17],这可能共同构成CM病人伴随畏光比例的增加。
皮肤异常性疼痛(allodynia)是CM组明显高于EM组的另一大伴随症状。目前研究发现,皮肤异常性疼痛被认为是发生慢性偏头痛的危险因素之一,并作为偏头痛慢性化的一个预测因素。目前报道皮肤异常性疼痛在偏头痛病人中的发生率约为50%~80%[18],且其与偏头痛的疼痛时间、疼痛程度及频率密切相关[19]。目前认为,中枢敏化(central sensitization)是偏头痛慢性转化(chroni fi cation)的主要机制。偏头痛的中枢敏化,主要涉及丘脑敏化、下行易化系统的激活、下行抑制系统损伤三个方面[20~22]。丘脑后部在中枢敏化中起到主要介导作用[20,23],而下行疼痛调控系统损伤主要由中脑导水管周围灰质(PAG)、楔状核(NCF)、延髓头端腹内侧核(RVM)等共同调控,其易化或抑制系统的失衡均可能导致中枢敏化及慢性疼痛的形成[20]。Burstein等[24]认为在偏头痛早期,主要为外周敏化,而中枢敏化主要出现在后期,这与偏头痛不断加重至慢性转化的过程相一致。
畏嗅(osmophobia)是CM另一个重要的伴随症状,在ICHD-II版中作为诊断偏头痛的伴随症状之一,但在最新ICHD-III[8]版中予以删除。目前有学者[25]研究发现,畏嗅在偏头痛病人比例约为48.5%,其敏感性及特异性均较高,故仍建议偏头痛诊断标准中加入畏嗅。畏嗅主要表现为对异常气味反应敏感性增加或对正常能够忍受甚至喜欢的气味难以忍受,以香水、香烟烟雾及汽车尾气为著[26]。畏嗅目前机制不明,Lovati等[27]认为与嗅皮质的中枢敏化相关。我们的另外一项脑fMRI研究(资料待发表)发现,慢性偏头痛病人可观察到嗅皮质的激活,这也能解释慢性偏头痛病人伴畏嗅的比例要高于IEM及FEM组的病人。
在生活质量方面,我们观察到,焦虑、抑郁及睡眠障碍、头痛致残性方面,各组间均存在较大差异。多项研究[28~30]表明,偏头痛病人的焦虑、抑郁症状明显高于健康人群,且亦高于其他原发性头痛病人;情感障碍也是偏头痛慢性转化的重要危险因素。其机制涉及基因[31]、神经递质[32]、解剖结构[33]等多个层面。目前应用fMRI技术发现,长期发作的偏头痛病人可观察到边缘系统的广泛激活[34],以及情感调节相关的环路诸如丘脑、前额叶皮质、前扣带回皮质、纹状体-苍白球系的激活。其中,5-羟色胺(5-HT)分泌的失调同时参与偏头痛的发作及抑郁的产生。Maizels等[35]提出了一个包括边缘系统功能障碍以及皮质过度兴奋的偏头痛中枢敏化模型,边缘系统的激活使偏头痛病人对于压力及情绪反应易感,形成一个与三叉神经伤害感受器相关的双向通路,导致偏头痛发作传入和传出反馈数小时甚至数天。故偏头痛与情感障碍可能存在双向正反馈关系,导致偏头痛发作频率不断增加的同时,焦虑、抑郁的症状加重,使头痛逐渐慢性化。
睡眠障碍可能与下丘脑、蓝斑核及背缝核功能障碍相关。在快动眼睡眠期头痛病人的背缝核和蓝斑活动消失,而该区与脑内5-HT的分泌有密切关联。5-HT在偏头痛的发生及头痛过程中均起着关键作用。下丘脑是调节睡眠的关键部位,是睡眠启动和维持的中枢,蓝斑和背缝核与快动眼睡眠的启动和维持有关系[36]。Kelman等[37]研究认为,控制睡眠和疼痛的神经通路在生理、生化及解剖结构上存在耦合。这些神经系统位于脑干、下丘脑和大脑基底部。因此,下丘脑、蓝斑核以及背缝核被认为是睡眠障碍和头痛共同的病因学解剖基础,它们功能紊乱时引起睡眠特殊阶段多种激素、及神经递质的异常,加重头痛的发作。
在IEM组和FEM组的比较中,我们人为将EM病人分组的目的是为观察各项头痛症状及伴随症状是否随着频率的增加而改变。结果显示,除发作频率、止痛药物的使用比例及生活质量中焦虑、致残性等有差异外,其余头痛症状、伴随症状等EM亚组之间并无明显差异。故认为,IEM与FEM的神经病理学机制无明显质的改变。目前认为,与慢性转化不同的是,EM的头痛频率增加过程中,主要涉及三叉神经血管系统及疼痛上行通路投射及疼痛调节系统功能异常等[20]。而在CM中,丘脑的敏化以及疼痛调控网络的失衡,导致其上行投射,以及感觉、边缘系统的广泛敏化,外在症状则表现为广泛的感觉异常,包括畏光、畏嗅、皮肤异常疼痛等。因此,对于CM病人,其伴随症状的问诊对诊断具有重要的意义。
本研究通过比较不同频率偏头痛病人的临床特点、伴随症状及生活质量,其亮点在于,将偏头痛病人按头痛发作频率进行分组,比较各组病人的临床特征,旨在模拟偏头痛病人在发作频率不断增加及慢性转化过程中,其头痛特点、伴随症状及生活质量的改变,进而探讨偏头痛发生、发展及慢性转化过程中的机制,我们的研究显示,CM病人的头痛性质主要表现为非搏动性,多不因日常活动加重,其性质不如EM典型,但存在广泛感觉敏感性增高,畏光、畏嗅、皮肤异常疼痛等伴随症状出现比例均高于发作性偏头痛,且情感障碍、睡眠障碍及头痛致残性均明显高于EM。这些可能为慢性偏头痛的诊断、治疗以及探索其发病机制提供重要线索。本文尚存在一定的局限性。首先,研究采用横断面研究,未能对病人进行长期随访;其次,本研究入组的偏头痛病人相对偏少,尤其在慢性偏头痛病人方面难免有抽样偏倚,需要在更大群体中进行验证。
参 考 文 献
[1]Advisory Group AMPP.Migraine prevalence,disease burden,and the need for preventive therapy.Neurology,2007,68: 343 ~ 349.
[2]Shengyuan Yu,Ruozhuo Liu,Gang Zhao,et al.The Prevalence and Burden of Primary Headaches in China:A Population-Based Door-to-Door Survey.Headache,2012,52(4):582 ~ 591.
[3]Global Burden of Disease Study.Global,regional,and national incidence,prevalence,and years lived with disability for 301 acute and chronic diseases and injuries in 188 countries,1990-2013: a systematic analysis for the Global Burden of Disease Study 2013.Lancet,2015,386: 743 ~ 800.
[4]Jensen R,Stovner LJ.Epidemiology and comorbidity of headache.The Lancet Neurol,2008,7(4):354 ~ 361.
[5]Lanteri-Minet M.Economic burden and costs of chronic migraine.Curr Pain Headache R,2014,18(1): 385.
[6]李舜伟,李焰生,刘若卓,等.中国偏头痛诊断治疗指南.中国疼痛医学杂志,2011,17(2):65.
[7]Yalın OÖ,Uluduz D,ÖzgeA,et al.Phenotypic features of chronic migraine.J Headache Pain,2016,17(1):17 ~ 26.
[8]Olesen J,Bes A,Kunkel R,et al.Headache classi fi cation committee of the international headache society (IHS)The international classi fi cation of headache disorders,3rd edition.Cephalalgia,2018,38(1): 1 ~ 211.
[9]Blumenfeld AM,Varon SF,Wilcox TK,et al.Disability,HRQoL and resource use among chronic and episodic migraineurs: Results from the International Burden of Migraine Study (IBMS).Cephalalgia,2011,31(3):301 ~ 315.
[10]Kelman L,Tanis D.The relationship between migraine pain andother associated symptoms.Cephalalgia,2016,26(5):548 ~ 553.
[11]齐晶晶,姚刚,毛西京,等.偏头痛发作期伴发的非头痛症状临床分析.中华神经医学杂志,2012,11(2):173 ~ 176.
[12]Evans RW,Seifert T,Kailasam J,et al.The use of questions to determine thepresence of photophobia and phonophobia during migraine.Headache,2008,48(3): 395 ~ 397.
[13]Géraud G,TrotterY,NFabre P,et al.Photophobia in migraine: an interictal PET study of cortical hyperexcitability and its modulation by pain.J NeurolNeurosurg Psychiatry,2010,81:978 ~ 984.
[14]Matsutani K,Tsuruoka M,Shinya A,et al.Stimulation of the locus coeruleus suppresses trigeminal sensorimotor function in the rat.Brain Res Bull,2000,53:827 ~ 832.
[15]Tsuruoka M,Matsutani K,Maeda M,et al.Coeruleotrigeminal inhibition of nociceptive processing in the rat trigeminal subnucleuscaudalis.Brain Res,200,993(1-2):146 ~ 153.
[16]Antal A,Temme J,Nitsche MA,et al.Altered motion perception inmigraineurs: evidence for interictal cortical hyperexcitability.Cephalalgia,2015,25:788 ~ 794.
[17]Ditch fi eld JA,McKendrick AM,Badcock DR.Processing of global form and motioninMigraineurs.Vision Res,2006,46(1-2):141 ~ 148.
[18]Guven H,Cilliler AE,Comoglu SS.Cutaneous allodynia in patients with episodic migraine.Neurol Sci,2013,34:1397 ~ 1402.
[19]Lucchesi C,Bonanni E,Maestri M,et al.Evidence of increased restless legs syndrome occurrence in chronic and highly disabling migraine.Funct Neurol,2012,27(2): 91 ~ 94.
[20]GoadsbyPJ,HollandPR,Martins-Oliveira M,et al.Pathophysiology of Migraine: A Disorder of Sensory Processing.Physiol Rev,2017,97(2):553 ~ 622.
[21]Noseda R,Burstein R.Migraine pathophysiology:anatomy of the trigeminovascular pathway and associated neurological symptoms,conical spreading depression,sensitization,and modulation of pain.Pain,2013,154(1): 44 ~ 53.
[22]Schwedt TJ,Larson-Prior L,CoalsonRS,et al.Allodynia and descending pain modulation in migraine: a resting state functional connectivity analysis.Pain Med,2014,15:154 ~ 165.
[23]Burstein R,JakubowskiM,Garcia-NicasE,et al.Thalamic sensitization transforms localized pain into widespread allodynia.Ann Neurol,2010,68:8l ~ 91.
[24]Burstein R,Cutrer MF,Yarnitsky D.The development of cutaneous allodynia during a migraine attack clinical evidence for the sequential recruitment of spinal and supraspinalnociceptive neurons in migraine.Brain,2000,123( 8):1703 ~ 1709.
[25]Zanchin G,Fuccaro M,Battistella P,et al.A lost track in ICHD 3 beta: A comprehensive review on osmophobia.Cephalalgia,2016:1 ~ 13.
[26]Fornazieri,Aurélio1 M,Rodrigues NA,et al.Olfactory symptoms reported by migraineurs with and without auras.Headache,2016,56(10):1608 ~ 1616.
[27]LovatiC,Giani L,Castoldi D,et al.Osmophobia in allodynicmigraineurs: cause or consequence of central sensitization? Neuro Sci,2015,36(1):145 ~ 147.
[28]Hung CI,Liu CY,Yang CH,et al.The impacts of migraine among outpatients with major depressive disorder at a two-year follow-up.PLoS One,2015,10(5):e0128087.
[29]Radat F,Mekies C,Geraud G,et al.Anxiety,stress and coping behaviours in primary care migraine patients: results of the SMILE study.Cephalalgia,2008,28(11):1115 ~ 1125.
[30]Peres MP,Mercante JP,Tobo PR,et al.Anxiety and depression symptoms and migraine: a symptom-based approach research.J Headache Pain,2017,18 (1) : 37.
[31]Stam AH,De Vries B,Janssens AC,et al.Shared genetic factors in migraine and depression:evidence from a genetic isolate.Neurology,2010,74(4):288 ~ 294.
[32]Hamel E.Serotonin and migraine: biology and clinical implications.Cephalalgia,2007,27(11):1295 ~ 1300.
[33]Grinberg AS,Seng EK.Headache-Specific Locus of Control and Migraine-Related Quality of Life: Understanding the Role of Anxiety.Int J Behav Med,2017,24(1): 136 ~ 143.
[34]Wilcox SL,Veggeberg R,Lemme J,et al.Increased functional activation of limbic brain regions during negative emotional processing in migraine.Frontiers in Human Neuroscience,2016,10:1 ~ 10.
[35]Maizels M,Aurora S,Heinricher M.Beyond neurovascular: migraine as a dysfunctional neurolimbic pain network.Headache,2012,52:1553 ~ 1565.
[36]Messina A,Bitetti I,Precenzano F,et al.Non-Rapid Eye Movement Sleep Parasomnias and Migraine: A Role of Orexinergic Projections.Front Neurol,2018,9:95.
[37]Kelman L,Jeanetta C.Headache and sleep: examination of sleep patterns and complaints in a large clinical sample of migraineurs.Headache,2005,45(7):904 ~ 910.
