体外膜肺氧合辅助支持成功救治急性暴发性心肌炎1例
2018-05-19盛琴慧郑博宋波董士勇洪涛丁文惠
盛琴慧 郑博 宋波 董士勇 洪涛 丁文惠
1 临床资料
患者女,43岁。因“恶心、腹胀伴发热3 d,反复晕厥半天”急诊入北京大学第一医院。患者3 d前持续劳累后出现恶心、腹胀伴纳差,随后出现发热,体温最高38℃,伴畏寒、寒战,自行服用阿奇霉素、吗丁啉、金银花等药物后体温降至正常。入院当天因排黑便1次,就诊于外院,血清生化示肝功能轻度异常(具体不详),心电图(ECG)示室内传导阻滞,左后分支传导阻滞(图1)。予左氧氟沙星及克林霉素静脉滴注,静脉滴注过程中反复出现晕厥共8次,每次1 min可自行缓解,随后转至北京市顺义区医院,当时血压86/62 mmHg(1 mmHg=0.133 kPa),心率 88次 /min。血清心肌酶升高,肌酸激酶(CK)619.3 U/L,肌酸激酶同工酶(CK-MB) 70 U/L,心肌肌钙蛋白I(cTnI)4.2 ng/ml,N 末端B型脑利钠肽前体(NT-proBNP)17 100 pg/ml(正常范围300~900 pg/ml)。予奥美拉唑40 mg 静脉滴注及补液支持,患者再发晕厥,复查ECG示Ⅲ度房室传导阻滞(图2)、高度房室传导阻滞(图3)。随后予患者维持异丙肾上腺素静脉滴注转入北京大学第一医院,急诊收入冠心病重症监护室(CCU)。复查心肌酶谱:乳酸脱氢酶(LDH)403 U/L,CK 571 U/L,CK-MB 73.8 U/L,cTnI 24.04 ng/ml。患者自发病以来,食欲差,近3 d基本未进食,大便少,今日黑便1次,尿量基本正常,体重变化不详。既往无特殊病史。
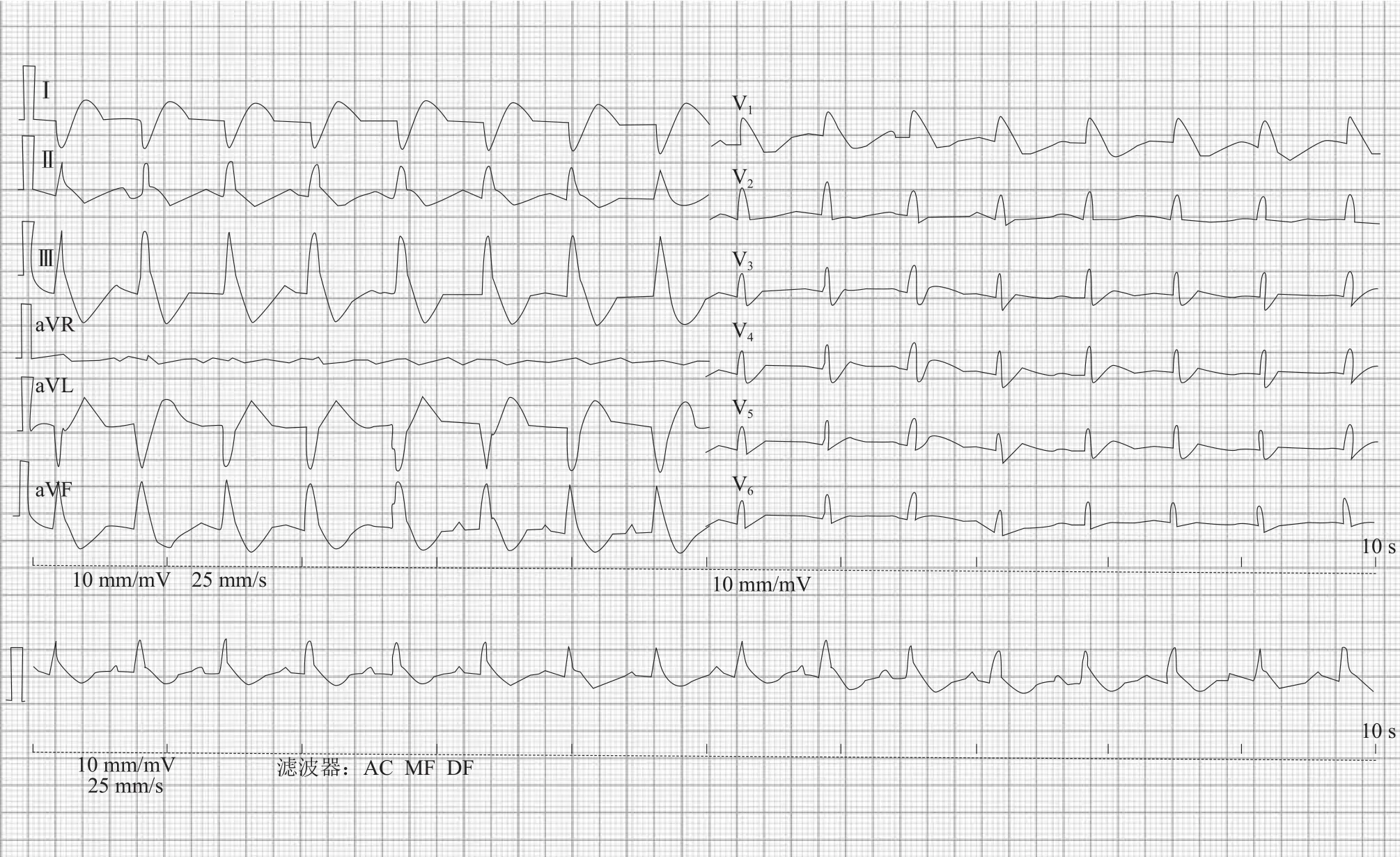
图1 室内传导阻滞+左后分支阻滞
入院查体:体温36℃,脉搏49 次/min,呼吸15次/min,血压 52/34 mmHg[多巴胺 7 μg/(kg·min)];平车推入病房,表情痛苦,精神萎靡,颈动脉、股动脉搏动弱,四肢及额部皮肤湿冷,可见颈静脉怒张;双肺呼吸音清,未闻及明显干湿、性啰音,心界不大,心音低钝,心率49次/min,心律齐,P2>A2,各瓣膜听诊区未闻及杂音及心包摩擦音。入院后患者心率波动在40~50 次/min,血压不能维持,维持多巴胺、异丙肾上腺素静脉滴注。急诊植入临时起搏器,起搏频率70~90 次/min,后患者心率波动在80~110 次/min,为加速性室性自主心律(图4)。大剂量血管活性药物支持下[多巴胺 20 μg/(kg · min)、多巴酚丁胺 20 μg/(kg · min)、去甲肾上腺素15 μg/min],血压仍不能维持,间断恶心、呕吐,烦躁不安。床旁超声心动图示:室壁增厚,运动微弱,估测左心室射血分数(LVEF)<20%。考虑患者心源性休克不能纠正,应积极予心肺循环辅助支持。故于床旁为患者行体外膜肺氧合(ECMO)治疗(V/A模式,转速3430 转 /min,流量3.55 L/min,气流量1.5 L/min,氧浓度90%)。同时予甲基强的松龙冲击治疗,并给予丙种球蛋白、人血白蛋白、新鲜血浆及营养补液等对症支持及抗感染治疗。患者循环逐渐稳定, 1周后撤ECMO,恢复自主饮食,床旁超声心动图示心脏结构功能基本正常。于入院后24 d出院。出院前超声心动图提示左心室舒张末期内径4.2 cm,LVEF 76%。
2 讨论
感染、物理和化学等多种因素均可引起心肌的炎症性病变,临床以感染后的病毒性心肌炎多见。心肌损伤程度差异很大,临床表现也各不相同,重症患者可发生严重的心力衰竭、心源性休克和恶性心律失常,甚至猝死[1-4]。这些急性重症患者中,部分起病急骤,病情进展迅速,预后凶险,又被称为暴发性心肌炎。本例患者心脏症状以晕厥为首发表现,短时间内,ECG从束支传导阻滞发展为完全及高度的房室传导阻滞,伴有严重的血流动力学障碍,药物治疗难以纠正,符合暴发性心肌炎的诊断[5]。
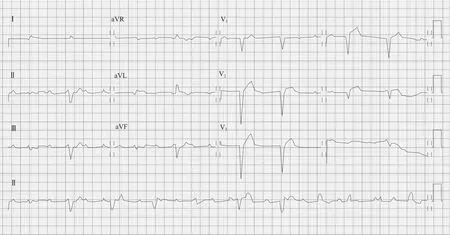
图2 Ⅲ度房室传导阻滞

图3 高度房室传导阻滞
病毒性心肌炎通常在呼吸道或消化道等前驱感染后2周起病,而暴发性心肌炎患者往往缺乏感染后免疫应答过程,前驱感染后数天或数小时甚至同时起病。此时血清特异性病毒抗体的检测可呈阴性结果,提示心肌损伤可能是与心肌极具亲和力的病毒直接侵犯所致,但随后受累心肌发生强烈免疫反应诱发全身性的严重而持久的炎症状态,加重局部心肌的损伤并导致多脏器受累[6-7]。正如本例患者,起病前3 d有发热及胃肠不适症状,随后在短时间内即出现了急剧进展的心脏受累表现。
不当的免疫炎症反应是病毒性心肌炎主要的发病机制,抑制局部免疫反应和全身炎症状态是重症心肌炎的重要治疗措施。临床最常用的是糖皮质激素,一般采用早期大剂量冲击治疗。血流动力学障碍多伴有严重心力衰竭和恶性心律失常,以高度或完全性房室传导阻滞和室性心动过速、心室颤动多见。采用血管活性药物、临时起搏器和积极的复律治疗,多数患者可以纠正。但即使在上述治疗下,病情凶险的暴发性心肌炎,仍有较高的死亡率。此时,及时的血流动力学的辅助支持是救治的关键手段。
ECMO是体外循环技术的扩大和延伸,其原理是将体内的静脉血引出体外,经过人工心肺旁路氧合后注入患者动脉或静脉系统,部分替代患者的心肺功能,维持人体脏器组织氧合血供[8]。多数ECMO无需开胸,操作相对简便,维持时间长,特别适合临床危重患者的急救治疗。各种原因导致的呼吸/心跳骤停、急性严重心功能衰竭和急性严重呼吸功能衰竭是最常用的适应证。本例患者以高度完全性房室传导阻滞为首发表现,后表现为持续的室性自主心律,提示心肌损伤严重。超声心动图显示心肌明显增厚水肿,室壁运动极差。虽早期植入了临时起搏器,大剂量激素冲击并多种血管活性药物大剂量联合应用,仍不能纠正患者心力衰竭和低血压休克状态,是ECMO支持治疗的绝对适应证[5]。采用的VA插管模式可同时支持心肺功能,在ECMO支持治疗期间,患者全身氧供和循环相对稳定,恢复窦性心律,为心脏功能的恢复创造了机会。
ECMO常见的并发症有:血栓和栓塞、出血、插管局部血管损伤及插管侧肢体血液循环障碍、感染等。该患者病史中曾有黑便一次,出血和血栓栓塞事件的平衡尤为关键。在ECMO支持治疗期间,大量红细胞及血小板受到破坏,因此要及时充分地补充成分血,同时密切监测患者的凝血功能,维持活化凝血时间在稳定有效的抗凝范围。
多数急性心肌炎(包括重症心肌炎患者)早期积极治疗后可以痊愈。本例患者病程发展过程中,心腔未见明显扩大及室壁变薄,心功能逐渐恢复至正常,提示发病早期心脏功能障碍以炎症水肿为主,大剂量的激素冲击发挥了重要作用。但即便如此,急性心肌炎后有可能对心功能造成长期的不良影响[9]。该患者心电图显示:肢导低电压、V1~V2导联QS型,胸导联R波递增不良(图5),仍需预防心脏重构对心脏结构和功能的影响,患者的长期预后需进一步随访关注。
综上所述,对血流动力学不稳定,循环难以维持的重症心肌炎患者,早期积极地给予ECMO支持治疗,有助于帮助患者维持循环,降低死亡率,并有利于心脏功能的完全康复,防止发生心肌炎后心肌病。
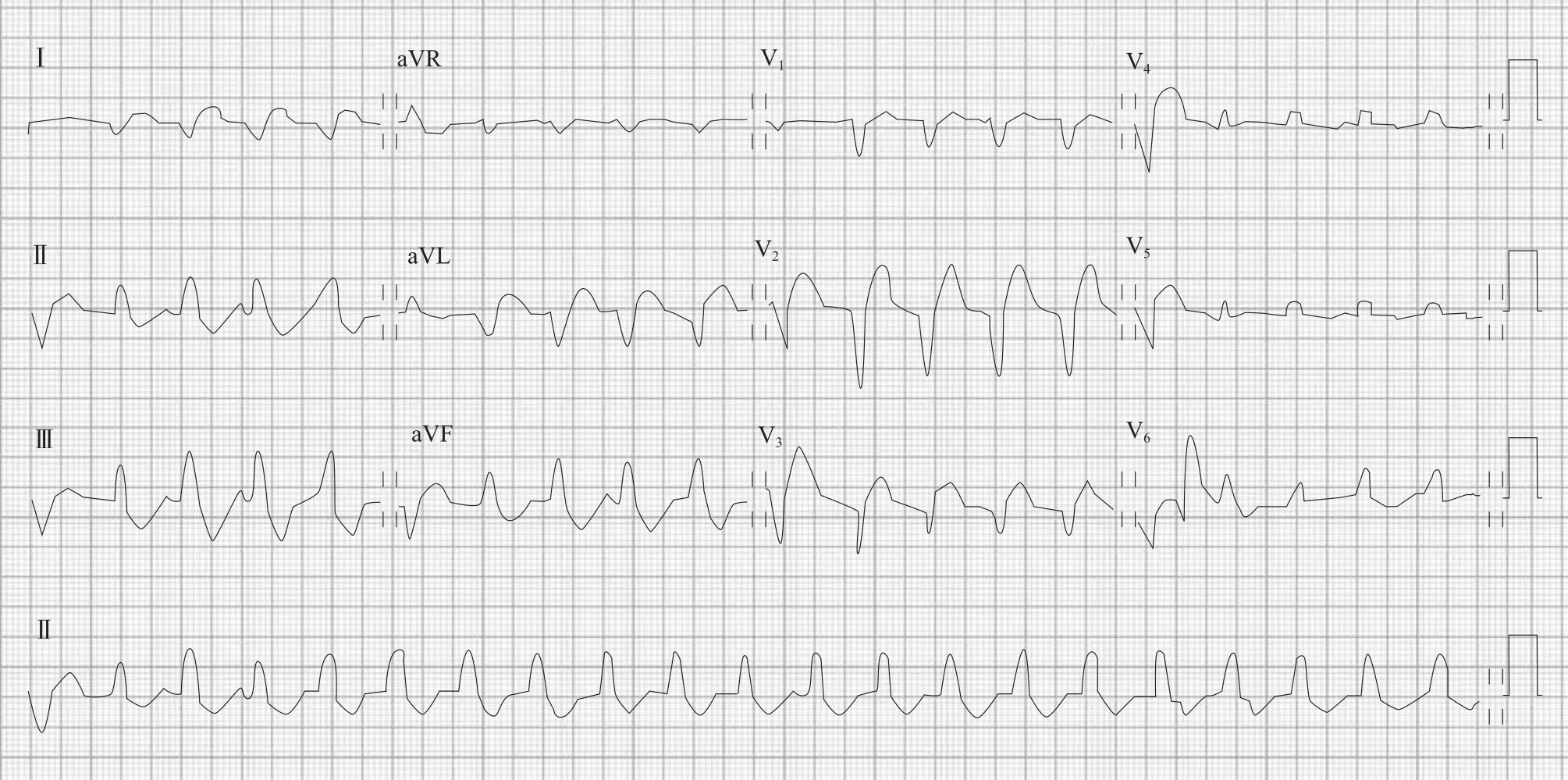
图4 加速性室性自主心律
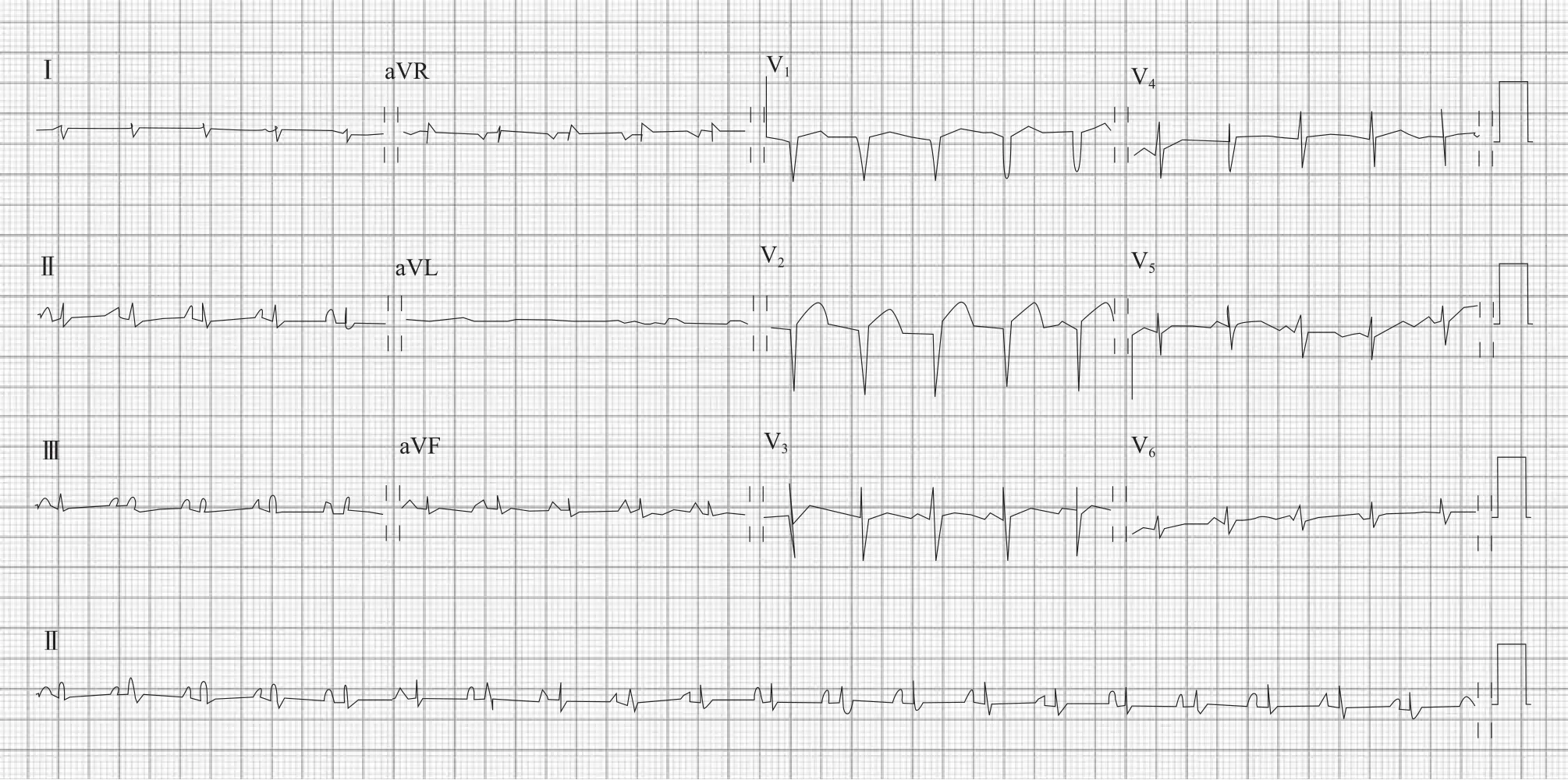
图5 患者发病3周后心电图
