水杨酸浓度对膜荚黄芪生物量、总黄酮和多糖积累的影响
2018-05-18王景然吴松权
王景然,王 萌,汪 洋,吕 爽,付 爽,刘 佳,吴松权
(延边大学农学院,吉林延吉133002)
黄芪是传统的补益类中草药,是多年生草本药用植物,分为膜荚黄芪和蒙古黄芪2个变种[1]。黄芪主产于我国北方地区,如东北、华北、西北和内蒙古。膜荚黄芪别称东北黄芪,是长白山的道地药材之一,是重点保护的珍惜药用植物。黄芪中富含黄酮类、黄芪皂苷、多糖类等[2]多种化学成分,其化学成分决定药用价值。现代药理学研究表明,黄芪具有提高机体免疫力、强心降压、降血糖、抗肿瘤、抗病毒、抗氧化等多种药理功效,能促进免疫器官功能和抗体生成[3]。黄芪不仅用于临床治疗,在保健、食品、化妆品等领域也得到广泛的应用。现今,市场对黄芪的需求主要运用在生产各类黄芪制剂和以黄芪为原料的保健品等方面,由于以黄芪为主的新药研发不断取得突破,导致野生资源遭到严重破坏[4],只能通过人工栽培满足市场需求,而人工栽培黄芪技术又不完善,存在明显的缺陷,人工栽培的黄芪与野生黄芪在主要活性成分含量上存在一定的差距[5]。因此,如何提高黄芪活性成分的积累将在黄芪生产过程中有着十分重要的意义[6]。
水杨酸(salicylicacid,SA)是一种广泛分布于高等植物体内的小分子酚类物质[7],被认为是一种内源信号分子,对植物种子萌发、成花诱导、呼吸代谢、抗性及衰老等生理过程有重要调节作用。水杨酸可以通过改变多种细胞代谢和调节防御机制来响应各种生物和非生物胁迫,从而增强植物的抗逆性[8]。最近几年,已经有大量的关于外源水杨酸在果树、蔬菜、作物、草坪等方面抵御非生物胁迫的相关报道[7-8]。通过研究发现,水杨酸可以通过调节抗氧化酶系统响应逆境胁迫,提高POD、SOD等抗氧化酶的活性来保护细胞质膜通透性和降低MAD的含量,从而提高植物对干旱、高温、高盐等逆境胁迫的抗性。同时水杨酸处理可以提高植物植保素及其相关合成酶类、蛋白含量和各种防御机制,促进植物代谢产物的生成,从而提高植株的抗病性。适宜浓度的水杨酸处理促进植株根与叶的生长,调节植株的光周期和植株叶片气孔,从而提高植物的光合速率和光合产物的积累[9]。
目前,关于黄芪的研究主要集中于主要化学成分的提取和药理活性方面。由于植物的化学成分生物合成的复杂性,促使人们通过不同的手段诱导化学成分的积累。通过诱导子对目标代谢产物的生物合成途径进行调控,被认为是能够提高植物化学成分含量的重要方法之一[10]。水杨酸作为诱导子之一,有利于化学成分的积累。如Tewari等研究表明,水杨酸能够诱导一氧化氮和ROS生成,刺激人参根中人参皂苷的积累[11]。而水杨酸应用于黄芪的研究鲜有报道。因此,本试验旨在研究水杨酸对膜荚黄芪幼苗生长过程中总黄酮和多糖化学成分积累的影响,为提高膜荚黄芪活性成分的含量提供一定的理论依据。
1 材料与方法
1.1 材料、仪器与试剂
长白山野生膜荚黄芪种子;芸香苷对照品,购于上海融禾医药科技发展有限公司;DPPH,购于Solarbio公司;紫外可见分光光度计,购于屹谱仪器制造(上海)有限公司;其他试剂均为分析纯,购于国内公司。
1.2 膜荚黄芪幼苗的培养与处理
2016年10月11日在实验室参照Wu等的方法[12],先用流水冲洗黄芪种子3 h,75%乙醇溶液浸泡1 min,无菌水冲洗3次,再用0.1%HgCl2消毒2 min,无菌水冲洗3次,将处理的膜荚黄芪种子平铺于培养皿上,置于温度为26℃的培养箱中暗培养。10月16日待到种子生根发芽长出子叶时,转到光照为2 500 lx、光/暗为16 h/8 h、温度为25℃的培养室中培养。11月11日选取生长旺盛、生长势一致和伸出真叶的黄芪幼苗作为试验材料进行水杨酸喷施处理,水杨酸浓度分别为 100、200、400μmol/L,分别培养 1、3、7 d收集幼苗,以喷施清水作为对照组,共12个处理,每个处理3次重复。在水杨酸喷施处理前先收集部分黄芪幼苗作为原始对照。
1.3 黄芪生物量的测定
从每个处理中选取生长势一致的3株黄芪幼苗在60℃下烘干至恒质量,测量其干物质的质量,取平均数即为生物量,其他样品烘干后用于测定总黄酮和多糖含量,所有样品都设置3次重复。
1.4 黄芪总黄酮的提取与含量测定
1.4.1 黄芪总黄酮的提取[13]称取 0.1 g烘干至恒质量的样品,加入液氮充分研磨,加入2 mL无水乙醇,175 r/min振荡萃取 24 h,超声处理20 min,12 000 r/min离心15 min,收集上清液用无水乙醇定容至2 mL,即为样品溶液。
1.4.2 黄芪总黄酮含量的测定 采用硝酸铝比色法[14]测定,具体的方法参照秦嘉泽等的方法[4]:准确称取1 mg芸香苷标准品,用30%乙醇溶液溶解定容到容量瓶中,混合均匀配置成标准溶液。分别准确量取对照品溶液0、0.4、0.8、12、1.6、2.0 mL置于容量瓶中,用 30%乙醇加至 5 mL,分别加入0.3 mL 5%亚硝酸铝溶液,混合静置7 min,加入0.3 mL 10%的硝酸铝溶液,混合静置7 min,加入2.0 mL 1 mol/L的氢氧化钠溶液,并用30%乙醇定容至10 mL,静置16 min,测定其在510 nm波长处的吸光度。以标准溶液浓度为横坐标、吸光度为纵坐标绘制标准曲线 y=11.789 9x+0.066 7,r2=0.997 8。
取0.5 mL样品溶液,空白对照组为取样0 mL,参考标准曲线制备方法中的“用30%乙醇加至5 mL”起,至“测定样品溶液的吸光度”,通过标准曲线方程,计算样品溶液总黄酮的浓度。
1.5 黄芪多糖的提取与含量测定
1.5.1 黄芪多糖的提取 采用微波提取法[15]提取膜荚黄芪苗中的多糖:准确称取0.1 g样品,加入3 mL的蒸馏水。调节超声波功率为65W,温度65℃,超声30 min,静置10 min,抽取上清液加入2倍体积的无水乙醇,离心得到的沉淀即为黄芪多糖,用蒸馏水溶解得到的即为多糖样品溶液。
1.5.2 黄芪多糖含量的测定 采用苯酚-硫酸比色法测定膜荚黄芪多糖含量,具体的方法参照陈玉霞等的方法[14]:准确称取葡萄糖标准品10 mg,用蒸馏水溶解定容至100 mL,制成葡萄糖浓度为0.1 mg/mL的标准溶液。分别准确量取对照品溶液 0、1.0、2.0、3.0、4.0、5.0 mL置于容量瓶中,分别加入1 mL的5%苯酚溶液,摇匀后再加入5 mL的浓硫酸,在沸水中加热15 min,取出迅速放入冷水中30 min。取出后测定在490 nm波长处的吸光度,以标准溶液浓度为横坐标、吸光度为纵坐标绘制标准曲线 y=0.243 2x-0.007 54,r2=0.995 4。
取0.5 mL样品溶液,空白对照组为取样0 mL,参考标准曲线制备方法中的“加入1 mL的5%苯酚溶液”起至“测定样品溶液的吸光度”,通过标准曲线方程,计算样品溶液多糖的含量。
1.6 黄芪抗氧化活性的测定
参照Kilani等的方法[16]测定膜荚黄芪抗氧化活性。准确抽取样品溶液0.5 mL,加入1 mL 200μmol/L DPPH溶液,在室温下暗反应35 min,在517 nm处测定吸光度。DPPH自由基清除率 A=[1--)]100%[16];式中:D[17]i为DPPH与样品溶液混合液的吸光度;为无水乙醇与样品溶液混合液的吸光度为无水乙醇与DPPH混合液的吸光度。
1.7 分析数据
利用SPSS软件对试验数据进行方差分析和显著性检验。
2 结果与分析
2.1 不同生长时期黄芪苗生物量
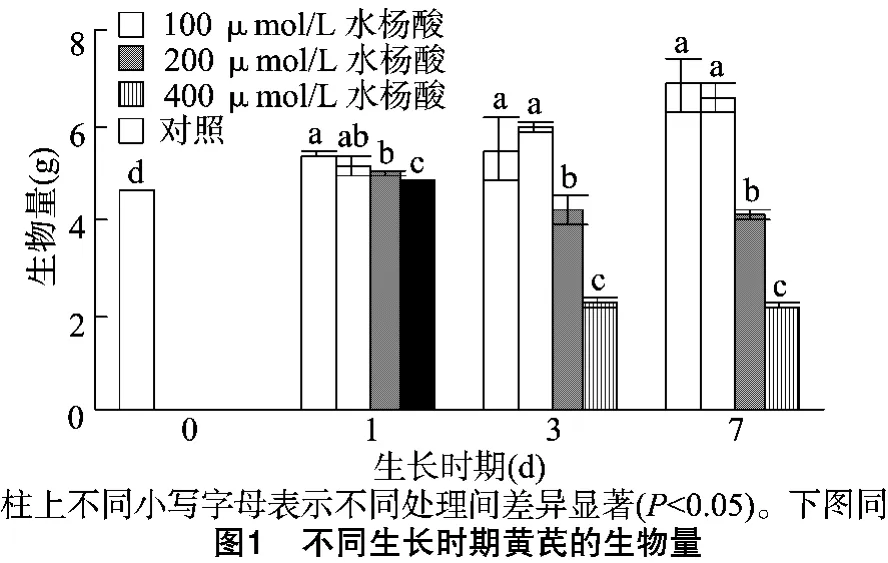
由图1可见,膜荚黄芪苗在培养前期与对照组相比无明显差异,而在培养3、7 d时随水杨酸浓度的增加,观察到黄芪苗生物量逐渐下降。当水杨酸浓度为200、400μmol/L时,观察到黄芪生物量显著下降,并随水杨酸浓度增加下降越明显;而当水杨酸浓度为100μmol/L时,与对照组相比无明显差异,下降幅度小。这与观察到的黄芪幼苗生长的表型相吻合。随着培养时间和水杨酸浓度的增加,黄芪幼苗逐渐表现出生长力减弱、叶片萎蔫的现象。在培养7 d后,黄芪植株叶片黄化甚至出现死亡。
2.2 水杨酸浓度对黄芪苗总黄酮含量的影响
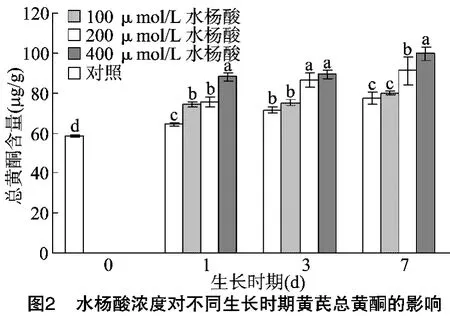
由图2可知,不同水杨酸浓度对黄芪苗总黄酮的积累产生重要的影响。膜荚黄芪苗在培养1 d时总黄酮含量与对照组出现明显差异,在低浓度水杨酸(100、200μmol/L)下总黄酮显著增加,在高浓度水杨酸(400μmol/L)下总黄酮量又显著高于低浓度下的总黄酮量。但是随着培养时间的延长,400μmol/L水杨酸处理的试验组总黄酮量增加的速度明显减慢,基本保持不变,无明显差异;而低浓度水杨酸处理的试验组总黄酮量仍明显的提高。对比100μmol/L水杨酸与200μmol/L水杨酸的试验组,培养天数为 3、7 d时,200μmol/L水杨酸的试验组黄芪苗总黄酮增加量显著高于100μmol/L水杨酸的试验组,而100μmol/L水杨酸的试验组总黄酮的含量无明显差异,在培养7 d后达到最大值(85.13μg/g)。虽然400μmol/L水杨酸处理的试验组总黄酮量高于100μmol/L水杨酸与200μmol/L水杨酸的试验组,但是400μmol/L水杨酸处理的黄芪苗生长势弱且出现死亡的植株,不利于植株的生长。随着培养天数的增加,不同浓度水杨酸处理后黄芪苗中总黄酮的积累量逐渐增加,均明显高于对照组,表明水杨酸对黄芪苗总黄酮的积累具有促进作用。这与杜研等的研究中低浓度水杨酸能够提高黄芪愈伤组织中总黄酮含量的结果[10]相同。黄芪在400μmol/L水杨酸浓度下产生了激素胁迫,对植物细胞具有毒害作用[10]。虽然高浓度水杨酸(400μmol/L)促进总黄酮积累量的增加,但是植株死亡的现象更加严重,与对照组相比,植株的生物量明显下降。
2.3 水杨酸浓度对黄芪苗多糖含量的影响
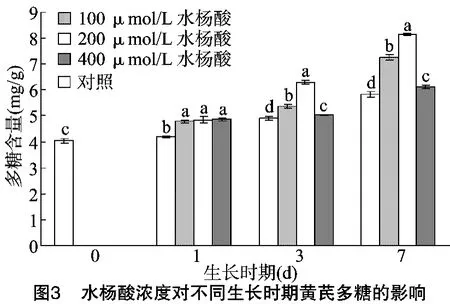
由图3可知,培养1 d时,与对照相比,黄芪植株多糖含量明显提高,但试验组之间多糖含量基本相同,差异不显著,原因可能是由于培养天数过短,水杨酸未对植株产生明显的刺激作用;培养3、7 d时,随着水杨酸浓度的增加,黄芪幼苗中多糖的积累有1个波峰。在100、200μmol/L水杨酸浓度下观察到多糖含量明显提高,在200μmol/L水杨酸浓度下培养7 d达到最大值(8.12 mg/g);在 400μmol/L水杨酸浓度下多糖的含量急剧下降,仅仅大于对照组。结果说明,多糖的积累与水杨酸浓度和培养时间紧密相关,低浓度的水杨酸(100、200μmol/L)促进黄芪幼苗多糖的积累,而高浓度的水杨酸(400μmol/L)对植株形成激素胁迫,植株的生长和组织结构受到破坏,促使植株新陈代谢减慢甚至停止,而原有积累的多糖逐渐降解和破坏[9],以抵抗外界环境的改变。
2.4 水杨酸浓度对黄芪苗抗氧化活性的影响
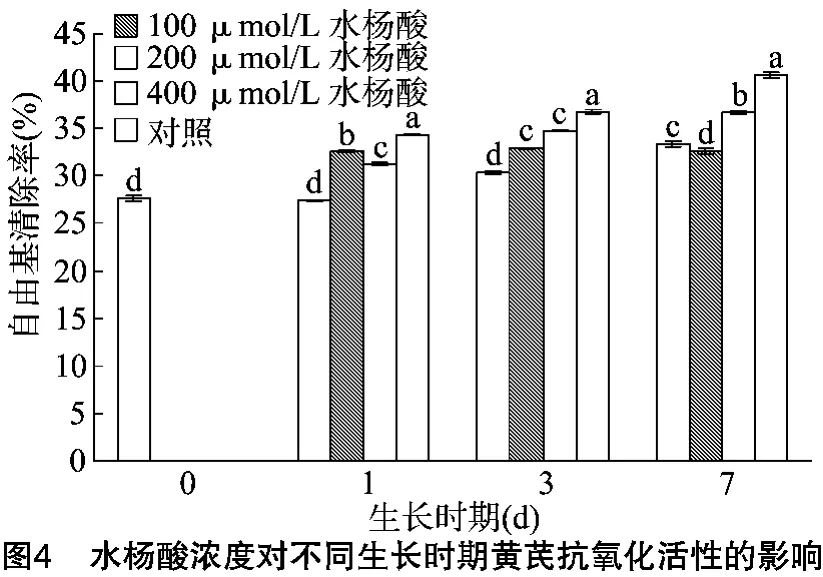
总黄酮最重要的特性为抗氧化活性,因此通过测定DPPH自由基清除率确定黄芪苗生长过程中的抗氧化活性。由图4可知,DPPH自由基清除率表示了黄芪幼苗不同生长时期的抗氧化活性。自由基清除率随着培养天数和水杨酸浓度增加呈现上升的趋势,与黄芪幼苗总黄酮含量成正相关。在培养7 d后,对照组与试验组清除自由基能力达到最大值,且400μmol/L水杨酸处理的试验组清除自由基的能力最强,明显高于其他试验组。虽然400μmol/L水杨酸处理试验组的植株生长势最差,甚至出现死亡的植株,有可能是因为高浓度水杨酸超出植株的承受能力,形成激素胁迫,抑制黄芪幼苗的生长,但是黄芪幼苗为抵制水杨酸逆境胁迫,提高植株植保素及其相关合成酶类、蛋白含量和各种防御机制,从而提高植物次生代谢产物的含量,促进植株体内总黄酮和多糖等次生代谢产物的积累,出现了400μmol/L水杨酸处理的试验组清除自由基能力最强的现象[7]。
3 结论
水杨酸有效地诱导了膜荚黄芪活性成分的积累,在低浓度水杨酸(100、200μmol/L)能够有效促进总黄酮和多糖的积累,从而进一步提高自由基清除率,但是高浓度水杨酸(400μmol/L)不利于多糖和黄芪生物量的积累,高浓度水杨酸对植株形成激素胁迫,抑制植株的生长。
参考文献:
[1]国家药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2009.
[2]张 蔷,高文远,满淑丽.黄芪中有效成分药理活性的研究进展[J].中国中药杂志,2012,37(21):3203-3207.
[3]韩 燕.中药黄芪的研究概况[J].河南中医学院学报,2003,18(6):86-88.
[4]秦嘉泽,全雪丽,田海丽,等.长白山野生膜荚黄芪不定根总黄酮积累规律研究(Ⅰ)[J].北方园艺,2014(16):158-160.
[5]杨映雪,陈建业,王亚平.黄芪总黄酮的抗氧化作用[J].川北医学院学报,2007,22(6):606-608.
[6]董娟娥,梁宗锁.植物次生代谢物积累量影响因素分析[J].西北植物学报,2004,24(10):1979-1983.
[7]孟雪娇,丁国华,邸 昆.水杨酸在植物体内的生理作用的研究进展[J].中国农学通报,2010,26(15):207-214.
[8]彭 洁,宋文路,王晓强,等.水杨酸与植物抗性关系研究进展[J].园艺与种苗,2016(2):70-74.
[9]唐艳萍,文 涛,孙 歆,等.水杨酸对植物光合作用影响的研究进展[J].西北植物学报,2015,35(8):1701-1708.
[10]杜 研.诱导子对黄芪愈伤组织生长及代谢的影响[D].长春:吉林农业大学,2007.
[11]Tewari R K,Paek K Y.Salicylic acid-induced nitric oxide and ROSgeneration stimulate ginsenoside accumulation in Panax ginseng roots[J].Journal of Plant Growth Regulation,2011,30(4):396-404.
[12]Wu S Q,Lian M L,Gao R,et al.Bioreactor application on adventitious root culture of Astragalusmembranaceus[J].In Vitro Cellular&Developmental Biology-Plant,2011,47(6):719-724.
[13]吕凤娇,谢晓兰.黄芪总黄酮乙醇提取工艺研究[J].安徽农业科学,2012,40(33):16380-16382.
[14]李春红,田 吉,何 兵,等.紫外分光光度法测定黄芪总黄酮的含量[J].重庆医科大学学报,2011,36(8):954-956.
[15]陈玉霞,林 峰,莫 娟,等.两种黄芪多糖提取方法比较[J].实验室研究与探索,2015,34(3):20-22,30.
[16]Kilani S,Ammar R B,Bouhlel I,et al.Investigation of extracts from(Tunisian)Cyperus rotundus as antimutagens and radical scavengers[J].Environmental Toxicology and Pharmacology,2005,20(3):478-484.
[17]郑德勇,安鑫南.竹叶提取物清除DPPH自由基的测定方法[J].福建农林大学学报(自然科学版),2005,34(1):59-62.
