紫杉醇联合洛铂治疗局部晚期宫颈癌患者的疗效观察*
2018-05-17王瑞雪付立仙
李 娜,熊 娇,嫣 静,王瑞雪,付立仙
(遵义医学院附属医院妇科,贵州遵义 563000)
局部晚期宫颈癌(locally advanced cervical cancer,LACC)是妇女常见的恶性肿瘤,其发病率逐年增加,临床治疗主要采用手术和放射措施[1]。LACC是一组具有高危因素的宫颈癌,其广义的范围是指ⅠB2~ⅣA期的宫颈癌,狭义的范围则是指局部肿瘤直径大于或等于4 cm的ⅡA期以下(ⅠB2~ⅡA2)的早期宫颈癌,此类肿瘤不易控制,手术难度大,术后容易复发和转移,致使5年生存率明显下降。对此时的宫颈癌进行术前新辅助化疗可提高手术切除率,改善宫颈癌的预后。此化疗基于紫杉醇,可以促进癌细胞的凋亡和肿瘤细胞裂解,抑制宫颈癌远处转移[1-2]。但近年来,有研究表明,LACC存在基因多样性,能够通过影响表达蛋白的性状,导致癌细胞内紫杉醇药物浓度降低,影响紫杉醇对LACC的化疗效果[2]。
近年来,临床应用紫杉醇与铂类进行联合化疗LACC,取得一定的疗效,其中以联合洛铂化疗效果更为显著[3]。洛铂可用于治疗前列腺癌、卵巢癌和输卵管癌等。本研究中将洛铂联合应用于宫颈癌的化疗中,联合化疗的优点是能明显降低化疗药物不良反应,提高患者化疗依从性及耐受性[4]。现将治疗效果报道如下。
1 资料与方法
1.1一般资料 选取2013年8月至2016年12月在本院实施新辅助化疗的58例LACC患者,其中29例患者(A组)采用紫杉醇联合洛铂新辅助化疗方案,29例患者(B组)采用紫杉醇联合顺铂治疗。A组年龄27~62岁,平均(48.0±9.1)岁,国际妇产联盟(FIGO)分期:ⅠB2期10例,ⅡA2期14例,ⅡB1期5例;肿瘤直径1.9~6.7 cm,平均(4.6±1.3)cm;病理类型:鳞状细胞癌25例,腺癌3例,腺鳞癌1例。B组年龄33~64岁,平均(50.2±12.4)岁,FIGO分期:ⅠB2期12例,ⅡA2期9例,ⅡB1期8例;肿瘤直径1.9~6.7 cm,平均(4.6±1.3)cm;病理类型:鳞状细胞癌25例,腺癌3例,腺鳞癌1例。两组的年龄、FIGO分期、肿瘤大小、病理类型比较,差异均无统计学意义(P>0.05)。纳入标准:(1)宫颈癌的诊断标准参考人民卫生出版社《妇产科学》第8版的标准;(2)年龄小于65岁;(3)经宫颈活检病理学检查证实;(4)FIGO分期:ⅠB2期~ⅡA2期;(5)治疗前获得研究对象的知情同意。排除标准:(1)合并严重的内科疾病、肝肾功能障碍;(2)伴有其他部位恶性肿瘤;(3)对本研究涉及的药物过敏;(4)有严重的内外科并发症,存在手术禁忌。
1.2方法
1.2.1新辅助化疗方法 两组患者入院后立即完善相关检查,排除化疗禁忌。A组患者首先给予80 mg/m2的安素泰紫杉醇注射液(澳大利亚Hospira公司,进口药品注册证号H20090175)进行静脉滴注,并给予80 mg/m2的洛铂(海南长安国际制药有限公司,国药准字号H20050309)进行静脉滴注。B组患者首先也给予80 mg/m2的多西紫杉醇,并给予80 mg/m2的顺铂(贵州汉方制药有限公司,国药准字号H20020272)进行静脉滴注。化疗的过程中维持电解质酸碱平衡,注意水化、保肝、解毒等对症治疗,一旦出现严重的不良反应时应立即停止化疗,总化疗周期为3个周期。
1.2.2血清肿瘤标记物检查方法 取冻存患者血清保存液体,25 000 r/min离心30 min,每3.0毫升需裂解的样品中加入0.5 mL的氯仿,进行裂解操作,采用无酶的RNA冲洗液进行洗涤,再20 000 r/min离心5 min,得到血清细胞角蛋白19片段抗原21-1(CYFRA21-1)、鳞状上皮癌抗原(SCCAg),CYFRA21-1采用RNA逆转录进行复制后萃取化验,SCCAg采用抗原-抗体结合法进行检测。检测并对比两组患者化疗前、化疗结束后2周CYFRA21-1和SCCAg的水平。
1.2.3辅助检查 对白细胞、血红蛋白、血小板进行检测。
1.2.4近期疗效评估 近期疗效评价标准:参照实体瘤治疗反应评价标准(RECIST)分为:完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。CR:可见病灶完全消失,未出现新病灶,肿瘤标记物降至正常范围;PR:肿瘤最大直径及最大垂直直径的乘积缩小达到50%以上;SD:肿瘤最大直径及最大垂直直径的乘积缩小小于50%,增大小于25%;PD:患者出现1个或多个病灶的肿瘤最大直径及最大垂直直径的乘积大于25%;缓解率=(CR+PR)/本组样本量×100%,总有效率=(CR+PR+SD)/本组样本量×100%。毒副反应参照WHO毒副反应5级分级标准,0度:无毒副作用;Ⅰ度:轻度反应;Ⅱ度:中度毒副反应;Ⅲ度:重度毒副反应;Ⅳ度:有严重的并发症。
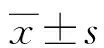
2 结 果
2.1两组患者的近期疗效比较 A组患者的缓解率82.76%、总有效率100.00%;B组患者的缓解率68.97%,总有效率96.55%,两组间比较差异均无统计学意义(P>0.05),见表1。

表1 两组患者的近期疗效比较
2.2两组患者的血清肿瘤标记物水平比较 A、B组CYFRA21-1、SCCAg化疗后较化疗前均明显降低(P<0.05);但A组患者的血清CYFRA21-1、SCCAg水平与B组患者比较差异均无统计学意义(P>0.05),见表2。

表2 两组患者的血清肿瘤标记物水平比较
a:P<0.05,与本组化疗前比较
2.3两组患者的毒副作用发生率比较 化疗过程中,A组患者的恶心呕吐、腹泻发生率分别为17.24%、6.90%,B组患者的恶心呕吐、腹泻发生率分别为48.28%、31.03%,两组比较差异有统计学意义(P<0.05);两组患者白细胞、血红蛋白、血小板降低,肝功能损害,肾损伤,周围神经炎的发生率比较差异均无统计学意义(P>0.05),见表3。
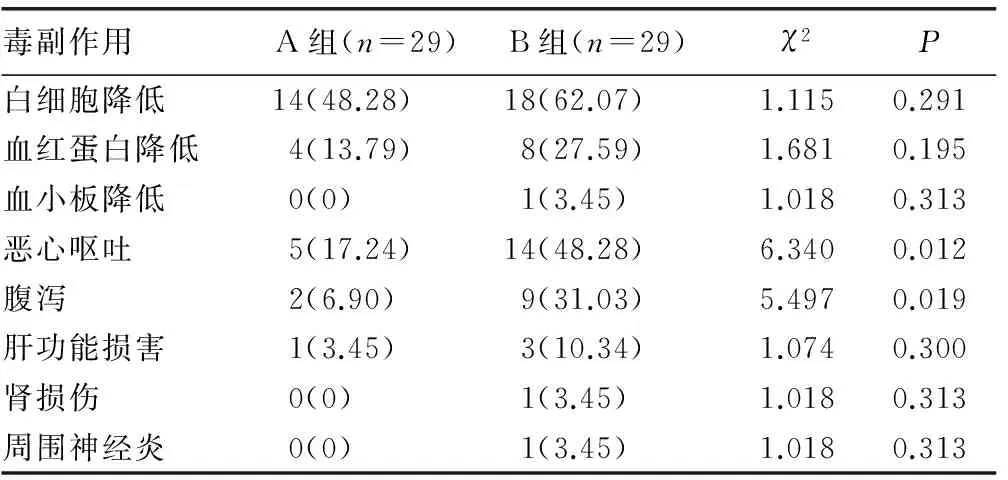
表3 两组患者的毒副作用发生率比较[n(%)]
2.4两组患者3年随访情况比较 对两组患者进行为期36个月的随访,B组有1例患者失访;A组总生存率为68.97%(20/29)、B组患者的总生存率为62.07%(18/29),两组比较差异无统计学意义(χ2=0.305,P=0.581);两组患者的生存函数曲线分析,生存时间比较差异无统计学意义(Z=0.381,P=0.537),见图1。
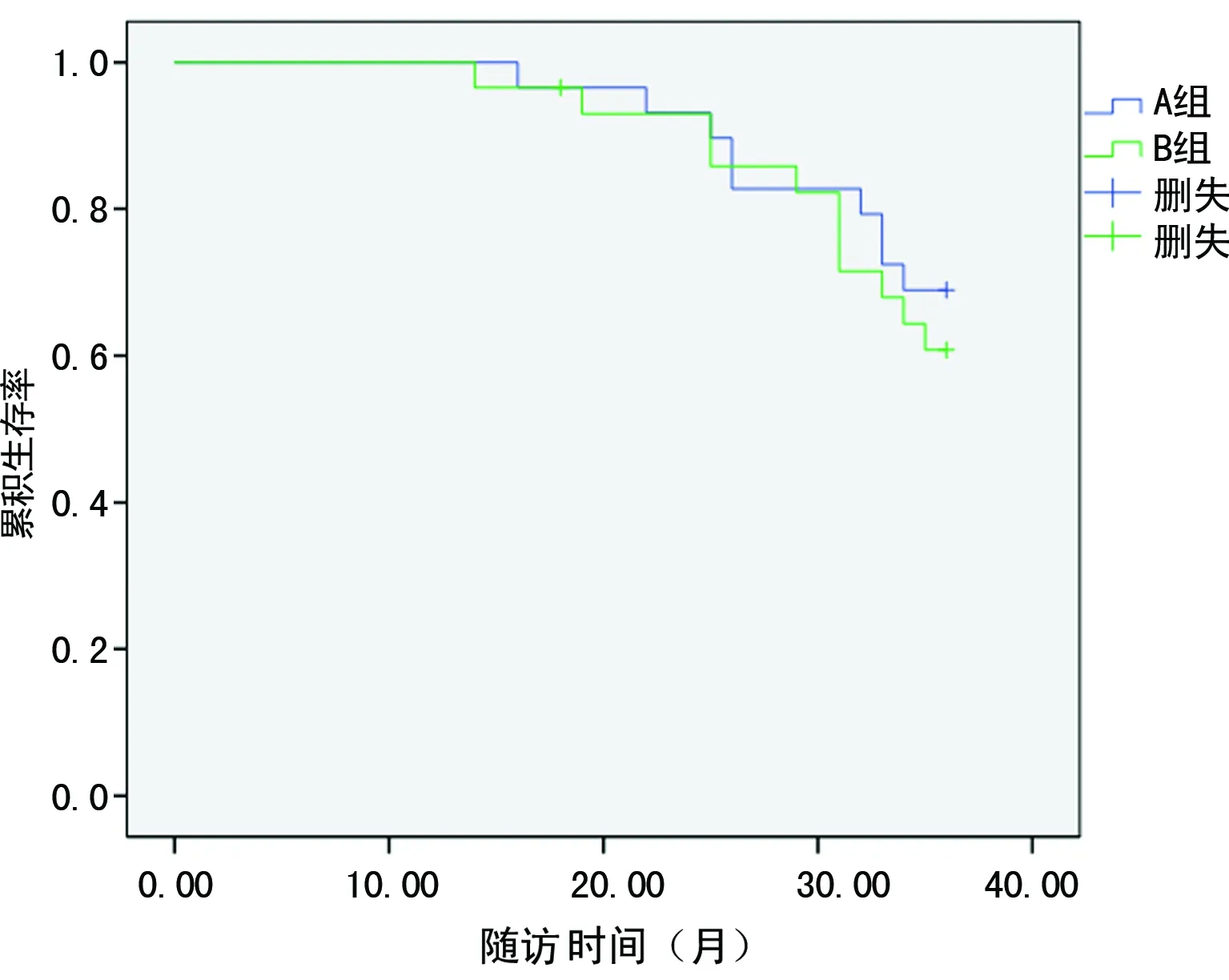
图1 两组患者的生存函数曲线
3 讨 论
宫颈癌每年新发病例在世界范围内约为50万例,病死率达50%。对于女性而言,是最高发及最致命的恶性疾病[5]。宫颈早期巨大癌及局部晚期浸润癌有一定手术难度,术前进行先期化疗可使肿瘤体积缩小或消失,提高手术切除率和彻底切除率,改善预后,延长患者的无瘤间期,使生存率有所提高。其中紫杉联合铂类方案是循证医学研究充分肯定的一线化疗方案[6-7]。采用紫杉醇联合铂类药物对宫颈癌患者进行先期化疗时,能有效改善肿瘤细胞对紫杉醇的耐药性,使紫杉醇发挥杀灭肿瘤细胞的功能,维持在癌细胞中的有效血药浓度[8-9]。
第1代和第2代铂类易在肾脏积聚,并导致肾脏毒性反应。肾毒性和铂类药物的种类密切关系,顺铂是铂类药物中能引起较为严重肾毒性的一种类型,大量的顺铂在体内积累后会导致肾功能不全[10]。在晚期宫颈癌化疗中使用顺铂治疗的患者,其肾损伤的发生率超过25%,严重影响患者的肾功能。第3代代表药物洛铂明显优于顺铂,对肾脏的损伤性较小[11],其主要药理作用为:具有对肿瘤细胞烷基化作用,能将肿瘤细胞聚集成团,并能对肿瘤细胞产生收缩作用,直至肿瘤细胞自身裂解死亡,对人类肿瘤细胞系具有一定的细胞毒性作用,类似于顺铂的肿瘤抑制效果但效果更强,且对人体正常细胞具有识别保护作用,不攻击人体正常组织细胞[12]。洛铂通常不具肾毒性,一般不需要水化,但对脱水尿少患者应适当补充水分,洛铂也没有顺铂常见的神经毒性及耳毒性,恶心呕吐比顺铂轻。洛铂的剂量限制性毒性为血小板减少,其发生率与严重程度与卡铂相近,仅适用于基础血小板在100×109/L以上的患者,使用剂量不得超过50 mg/m2,每3周1次。用药过程中需严密监测血常规及出血症状,对原已有出血倾向的患者,包括活动性溃疡病及癌症病灶有出血危险者,应慎重考虑或避免使用[11-12]。在静脉注射后,血液中的药物浓度维持在基础水平,血液中几乎没有洛铂的代谢物,不会随血液循环回流到身体各处组织器官,具有选择性杀伤作用[13]。在数小时后,体内血液循环和血清蛋白结合的总洛铂浓度仅为2.5%,这说明洛铂对血液中白细胞、血小板无毒害作用,血液运输氧能力仍处于正常水平[14]。当紫杉醇与洛铂进行联合时,能干扰宫颈癌细胞进行基因表达和传代增殖,从而不能完成癌细胞基因传递,导致癌细胞发生异常生理改变,而发生裂解死亡[15]。
本研究结果显示,紫杉醇联合该两种药物对LACC患者行先期化疗3个疗程,患者的缓解率、总有效率及血清中相关肿瘤标记物水平化疗前后比较差异无统计学意义,说明应用紫杉醇联合该两种药物均能杀灭肿瘤细胞,可抑制癌细胞增殖、生长和表达,说明应用紫杉醇联合洛铂或顺铂对患者治疗效果相当。本研究结果还显示,紫杉醇联合洛铂治疗中,患者出现胃肠道反应如恶心呕吐及腹泻的发生率较B组明显降低,而血液系统、肝肾功能的影响及周围神经炎等化疗不良反应的发生接近顺铂使用后所产生的药物毒副反应情况。因此A组中胃肠道发生的毒副作用较低,不良反应小,能更好地提高患者化疗的依从性及耐受性。本研究还对两组患者生存率进行评价,两组患者均能达到较高的生存率,能对LACC宫颈癌患者起到较好的治疗效果。
综上所述,紫杉醇联合洛铂在LACC患者术前新辅助化疗中与紫杉醇联合顺铂的治疗效果相当,但是相对毒副反应发生率更低,有利于提高患者的治疗依从性。洛铂作为第3代铂类抗肿瘤药物,具有水溶性好,抗瘤谱广,抗肿瘤性强,与其他铂类药物无交叉耐药及毒副作用轻的特点,已经显示出明显优势。由于目前仅在中国市场上市,尤其对妇科肿瘤新的适应证研究才刚刚起步,其远期疗效还需要进一步大样本临床随机研究证实。
参考文献
[1]ANGIOLI R,PLOTTI F,MONTERA R,et al.Neoadjuvant chemotherapy plus radical surgery followed by chemotherapy in locally advanced cervical cancer[J].Gynecol Oncol,2012,127(2):290-296.
[2]WIEBE E,DENNY L,THOMAS G.Cancer of the cervix uteri[J].Int J Gynecol Obste,2012,119(S2):S100-109.
[3]ADACHI S,OGASAWARA T,WAKIMOTO E,et al.Phase Ⅰ/Ⅱ study of intravenous nedaplatin and intraarterial cisplatin with transcatheter arterial embolization for patients with locally advanced uterine cervical carcinoma[J].Cancer,2001,91(1):74-79.
[4]FERLAY J,SHIN H R,BRAY F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-2894.
[5]乔友林.适宜发展中国家与地区的宫颈癌快速筛查技术的研究及意义[J].中华预防医学杂志,2015,49(2):110-111.
[6]GREEN J A,KIRMAN J M,TIERNEY J F,et al.Survival and recurrence after concomitant chemotherapy and radiotherapy for cancer of the uterine cervix:a systematic review and meta-analysis[J].Lancet,2001,358(9284):781-786.
[7]邓凯贤,李维丽,陈春林,等.ⅠA2~ⅡA2期宫颈癌主韧带浸润情况调查及危险因素分析[J].重庆医学,2016,45(12):1641-1644.
[8]刘红,张国楠.宫颈癌化疗耐药相关问题[J].中国实用妇科与产科杂志,2015,31(3):198-201.
[9]刘少晓,程晓燕,郑红枫,等.紫杉醇联合顺铂新辅助治疗局部晚期宫颈癌的临床疗效及安全性评价[J].中国临床药理学杂志,2015,31(6):432-434.
[10]SCHMELAR K M,FRUMORIT M,RAMIREZ P T.Conservative management of early stage cerviacal cancer:is there a role for less radical surgery?[J].Gynecolog Oncol,2011,120(3):321-325.
[11]MCKEAGE M J.Lobaplatin:a new antitumour platinum drug[J].Expert Opin Investig Drugs,2001,10(1):119-128.
[12]ENGLE J B ,MARTENS B E,HAHNE J C,et al.Effects of lobaplatin as a single agent and in combination with TRAIL on the growth of triple-negative p53-mutated breast cancers in vitro[J].Anticancer Drugs,2012,23(4):426-436.
[13]HOU Y I,YIM M,SUN F,et al.A metabolomics approach for prediciting the response to the neoadjuvant chemotherapy in cervical cancer patients[J].Mol Biosyst,2014,10(8):2126-2133.
[14]WANG H,ZHU L,LU W,et al.Clinicopathological risk factors for prediciting the response to the neoadjuvant chemotherapy and radical hysterectomy in cervical cancer [J].World J Surg Oncol,2013,11(1):301.
[15]ZHANG H,PENG W,ZHANG Y.Detection of cell apoptosis in pelvic lymphnodes of patients with cervical cancer after neoadjuvant chemotheray[J].J lnt Med Res,2014,42(3):641-650.
